
- •Содержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •3 Растворы
- •3.1 Общие свойства растворов
- •3.1.2 Способы выражения состава растворов
- •3.1.3 Физико-химические процессы образования растворов
- •3.1.4 Экстракция
- •3.2 Растворы неэлектролитов
- •3.2.1 Законы Рауля
- •3.2.2 Осмос
- •3.3 Растворы электролитов
- •3.3.1 Электролитическая диссоциация
- •3.3.2 Сильные и слабые электролиты
- •3.4 PH водных растворов
- •4 Ионно-обменные реакции
- •4.1 Необратимые ионно-обменные реакции
- •4.2 Обратимые ионно-обменные реакции
- •5 Гидролиз солей
- •5.1 Различные случаи гидролиза
- •2) Гидролиз соли образованной сильным основанием и слабой кислотой
- •3) Гидролиз соли образованной слабым основанием и слабой кислотой
- •5.2 Константа гидролиза
- •5.3 Смещение равновесия при гидролизе
- •6. Окислительно-восстановительные реакции
- •6.1 Составление уравнений окислительно-восстановительных реакций
- •6.2 Прогнозирование окислительно-восстановительных свойств веществ по степеням окисления элементов
- •6.3 Основные типы окислительно-восстановительных реакций
- •6.4 Взаимодействие металлов с водой, кислотами и щелочами
- •7 Гальванические элементы
- •7.1 Принцип работы гальванического элемента
- •7.2 Водородный электрод сравнения. Электрохимический ряд
- •8 Электролиз
- •8.1 Электролиз расплавов
- •8.2 Электролиз водных растворов
- •8.3 Количественные расчёты в электролизе
- •8.4 Химические источники электрической энергии
- •9 Коррозия металлов
- •9.1 Виды и типы коррозии
- •9.2 Способы защиты металлов от коррозии
- •9.2.1 Изолирование металлов от внешней среды
- •9.2.2 Изменение состава коррозионной среды
- •9.2.3 Рациональное конструирование
- •9.2.4 Электрохимические способы защиты от коррозии
- •10 Термодинамика
- •10.1 Внутренняя энергия и энтальпия. Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •10.2 Энтропия
- •10.3 Энергия Гиббса
- •11 Химическая кинетика Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •11.1 Скорость реакции
- •Основные факторы, влияющие на скорость реакции:
- •Число частиц с энергией большей, чем Еа равно заштрихованной площади.
- •12.1.2 Модель атома по Бору
- •12.2 Современные представления о строении атома
- •13 Периодический закон и периодическая таблица д.И. Менделеева
- •14 Химическая связь и строение молекул
- •14.1 Химическая связь
- •14.1.1 Квантово-механическое описание модели молекулы водорода
- •14.1.2 Основные характеристики химической связи
- •Валентный угол–это угол между двумя химическими связями.Он отражает геометрию молекулы.
- •14.1.3 Типы химических связей Ковалентная связь –это связь между двумя атомами за счет образования общей электронной пары.
- •14.2 Состав и строение молекул
- •15 Типы кристаллических решеток
- •16.1 Общая характеристика s-элементов первой и второй групп
- •16.2 Свойства воды
- •16.2.1 Строение молекулы воды
- •16.2.2 Физические свойства воды
- •16.2.3 Химические свойства воды
- •16.3 Жесткость воды
- •18 Комплексные соединения
- •18.1 Состав комплексных соединений
- •18.2 Реакции с участием комплексных соединений
- •19.8.1 Элементы триады железа
- •19.8.2 Платиновые металлы
- •20 Органические соединения
- •20.1 Углеводороды
- •20.2 Кислородсодержащие соединения
- •20.3 Амины и аминокислоты
- •21 Полимеры
- •21.1 Классификации полимеров
- •21.2 Полимеризационные полимеры
- •21.3 Поликонденсационные полимеры
- •21.4 Структура и состояние полимеров
- •22 Рабочие вещества низкотемпературной техники
- •22.2 Хладагенты органического происхождения
- •Список использованных источников
3.3.2 Сильные и слабые электролиты
По способности распадаться на ионы электролиты делятся на сильные и слабые. Для описания ряда свойств сильных и слабых электролитов применяются различные математические зависимости.
Сильные электролиты диссоциируют необратимо и практически полностью. В уравнении диссоциации ставят знак «®» (односторонний процесс). Примеры диссоциации основных классов неорганических соединений:
Ca(OH)2 ® Ca2+ + 2OH–,
H2SO4 ® 2H+ + SO42–,
Cr2(SO4)3 ® 2Cr3+ + 3SO42–.
Концентрации ионов в растворах сильных электролитов можно рассчитывать по уравнениям их диссоциации. Для точных расчетов необходимо находить активную (а) или проявляющую себя в действии концентрацию.
В соответствии с положением в периодической таблице элемента, образующего соответствующий электролит, к сильным электролитам относятся:
1) основания – I-группа, II-группа начиная с Са(ОН)2 и III-я ТlОН;
2) кислоты – V-группа НNО3, VI-группа Н2SО4 и Н2SеО4, VII-я НСl,
НСlО4, НСlО3 и соответствующие кислоты для брома и йода;
3) соли – все хорошо растворимые.
Остальные электролиты, за немногим исключением, относятся к слабым.
Слабые электролиты диссоциируют обратимо и ступенчато.
Для характеристики диссоциации слабых электролитов применяется степень диссоциации (α) и константа диссоциации (Кд).
Степень диссоциации электролита показывает, какая часть электролита распалась на ионы:
|
|
(3.15) |
Константа диссоциации выводится на основе закона действующих масс (рассматривается в главе 11). При диссоциации слабых электролитов устанавливается равновесие между ионами (продукты диссоциации) и исходными молекулами (или сложными ионами). Обратимость в уравнении диссоциации отражают знаком ««» – обратимый равновесный процесс. Например, для диссоциации водного раствора аммиака:
NH4ОH
«
NH4+
+ OH–
, Kд
=
 .
.
Константа диссоциации количественно характеризует силу электролита: чем меньше значение константы диссоциации, тем слабее электролит.
В случае многозарядных слабых электролитов диссоциация протекает ступенчато. Например, для ортофосфорной кислоты:
I-ступень
–
H3PO4
«
H+
+ H2PO4–
Кд1
=
7,11·10–3,

II-ступень
–
H2PO4–
«
H+
+ HPO42–
Кд2
=
6,34·10–8,

III-ступень
–
HPO42–
«
H+
+ PO43–
Кд3
=
1,26·10–12.

Из приведенных значений Kд видно, что каждая последующая ступень диссоциации примерно на пять порядков меньше.
В практических расчетах, не требующих высокой точности, достаточно учитывать диссоциацию по первой ступени.
Закон разбавления Оствальда устанавливает математическую связь между Кд, α и С для слабого электролита..
Вывод проведем на примере диссоциации уксусной кислоты:
СH3СООН « H+ + СН3СОО–.
Обозначим:
С – исходная концентрация кислоты,
αС – равновесные концентрации ионов,
(1– α)С = Сравн. – равновесная концентрация кислоты.
Подставив эти обозначения в выражение константы диссоциации, получим следующее уравнение:
|
Кд
= |
(3.16) |
Если
α << 1, то в полученном уравнении можно
считать, что (1 – α)
»
1. Тогда: Kд
=
 2С
, отсюда
2С
, отсюда
|
|
(3.17) |
Так как степень диссоциации обратно пропорциональна корню квадратному из концентрации, то с разбавлением раствора степень диссоциации растет. Эта зависимость называется законом разбавления Оствальда.
Для расчета равновесных концентраций ионов в растворах слабой кислоты и слабого основания (при условии С/Кд =>100) применяют следующие формулы:
[H+]
=
 ,
[ОH-]
=
,
[ОH-]
=
 (3.15,
3.18)
(3.15,
3.18)

 ..
..
 .
.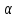 =
= .
.