
- •Часть II. «Витамины и ферменты»
- •Введение
- •Классификация и номенклатура
- •Определение активности ферментов
- •Единицы ферментативной активности
- •Общие свойства ферментов
- •Специфичность действия ферментов
- •Влияние температуры и рН на активность ферментов
- •Активирование и ингибирование ферментов
- •Гидролазы
- •Глюкозидазы
- •Выделение– и– амилаз солода.
- •Определение декстринирующей способности–амилазы
- •Влияние температуры на осахаривающую способность–амилазы
- •Определение активности амилолитических ферментов
- •Определение активности амилазы (сывороточная амилаза крови)
- •Протеазы
- •Гидролитическое расщепление казеина под действием пепсина.
- •Определение активности протеаз по методу Ансона
- •Определение активности протеолитических ферментов
- •Определение протеолитической способности (пс)
- •Определение протеолитической активности молокосвертывающих препаратов
- •Эстеразы
- •Гидролитическое расщепление жира под действием липазы
- •Определение активности липазы
- •Ер на воздушно–сухое вещество
- •Определение сахаров по Бертрану
- •Список использованных источников
- •Часть II."Витамины и ферменты". Раздел I."Ферменты".
Глюкозидазы
Выделение– и– амилаз солода.
Амилазы гидролизуют различные соединения: амилозу, амилопектин, гликоген, олигосахариды и родственные им вещества, построенные из остатков –D–глюкопиранозы и содержащие в молекулах 1,4 –1,6 гликозидные связи.
Активные центры амилаз образованы радикалами гистидина, аспарагиновой и глутаминовой кислот, а также тирозина. Последнему приписывают функцию связывания субстрата, а первым трем – каталитическую функцию. Предполагают следующий механизм распада гликозидных связей 1,4 – 1,6 при участии амилаз (см. рисунок 3 (I стадия)).
На второй стадии в активный центр фермента входит молекула воды, присоединения ОН групп, которой обеспечивает распад возникшей сложно–эфирной связи и высвобождение радикала дикарбоновой аминокислоты; протон воды присоединяется к депротонированному на 1–ой стадии радикалу гистидина (см. рисунок 4 (II стадия)).
В результате восстанавливается структура активного центра фермента, и он готов к осуществлению следующего каталитического акта в гидролизе гликозидной связи.
Рисунок 3 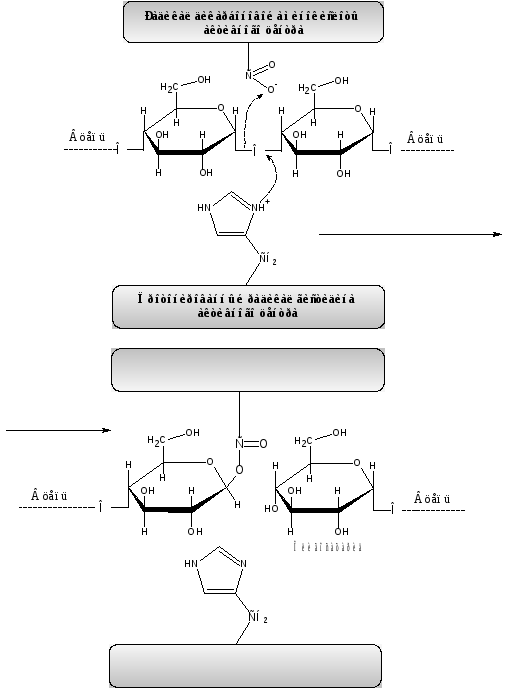 –
Механизм действия амилаз (1-я стадия)
–
Механизм действия амилаз (1-я стадия)
Рисунок 4 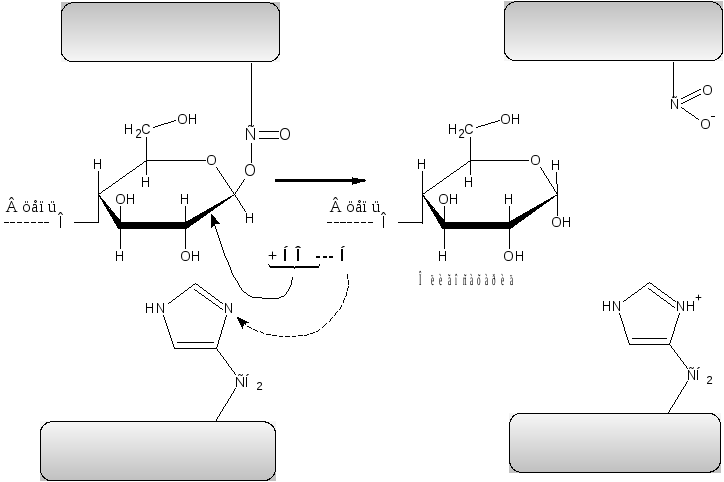 –
Механизм действия амилаз (2-я стадия)
–
Механизм действия амилаз (2-я стадия)
Предполагают, что не только амилазы, но и все другие гликозидазы действуют в соответствии с приведенным ниже механизмом.
Известны три вида амилаз, различающихся по распространению в природе, по ряду свойств и главным образом по конечным продуктам ферментативного действия.
–Амилаза (–1,4–глюкан–4–глюканогидролаза) – фермент гидролизует внут-ренние –1,4– глюкозидные связи в субстратах, приводя в конечном итоге к образованию мальтозы, некоторого количества глюкозы и различных низкомолекулярных олигосахаридов с разветвленной цепью.
–Амилаза (–1,4–глюканмальтогидролаза) и глюкоамилаза (–1,4–глюкан глюкогидролаза) в отличие от –амилазы гидролизуют наружные нередуцирующие концы цепей полисахаридов, последовательно отщепляя соответственно мальтозные и глюкозные остатки. Действие –амилазы и глюкоамилазы прекращается, как правило, вблизи первой точки ветвления полисахарида, образованного –1,6– глюкозидной связью. Поэтому, помимо мальтозы и глюкозы, под действием –амилаз и глюкоамилаз образуются декстрины (олигосахариды) высокой молекулярной массы.
Ход работы. 20 г измельченного солода помещают в мерную колбу на 100 мл, доводят до метки дистиллированной водой и переносят в фарфоровый стакан. Затем массу размешивают 15 минут, оставляют на 2 часа в холодильнике, перемешивают, отжимают через ткань и центрифугируют. Вытяжка из солода содержит –и – амилазы.
Выделение –амилазы
10 мл солодовой вытяжки нагревают в пробирке при 70 С в течение 15 минут, после чего раствор охлаждают и используют для исследования активности фермента. –амилаза при этой температуре инактивируется.
Выделение –амилазы
15 мл солодовой вытяжки вносят в стакан, добавляют 3 мл 0,1 н. раствора соляной кислоты и 12 мл воды до общего объема 30 мл (рН при этом должно быть 3,3) и оставляют в холодильнике на15 мин. Затем к раствору добавляют 6 мл 0,15 М раствора фосфорнокислого натрия (двухзамещенного) с целью доведения рН среды до 6,0. Раствор берут для определения осахаривающей способности –амилазы, так как – амилаза в кислой среде инактивирована.
