
2. Описание метода измерения γ и используемой аппаратуры.
Поскольку удельная теплоёмкость при постоянном объёме CV равна (7):
![]()
где i– число степеней свободы молекул газа,R- молярная газовая постоянная, а удельная теплоёмкость при постоянном давленииCpравна (8):
![]() ,
,
то теоретическое значение
![]() равно (9):
равно (9):
![]() .
.
Для одноатомного газа (He, Ar) число
степеней свободыi=3, поэтому![]() .
Для двухатомных газов (N2,
O2)i=5,
.
Для двухатомных газов (N2,
O2)i=5,![]() .
Для многоатомных газов (CH4)i=6, поэтому
.
Для многоатомных газов (CH4)i=6, поэтому![]() .
Это теоретические расчетные значения
γ. Показательγвходит в уравнение
Пуассона (10)
.
Это теоретические расчетные значения
γ. Показательγвходит в уравнение
Пуассона (10)![]() ,
поэтому нам необходимо измерить параметры
какого-либо адиабатического процесса
для того, чтобы определитьγэкспериментально, опытным путем. В
настоящей работе определяетсяγдля воздуха (смесьN2 иO2 с
малыми примесями иных газов), т.е. воздух
в основном двухатомный газ. Для нихi=5
и расчетное γ=1,4.
,
поэтому нам необходимо измерить параметры
какого-либо адиабатического процесса
для того, чтобы определитьγэкспериментально, опытным путем. В
настоящей работе определяетсяγдля воздуха (смесьN2 иO2 с
малыми примесями иных газов), т.е. воздух
в основном двухатомный газ. Для нихi=5
и расчетное γ=1,4.
Н а
рисунке 2 изображен измерительный стенд.
а
рисунке 2 изображен измерительный стенд.
Р
7

В него входят: 1 – баллон, в который электронасосом может нагнетаться воздух, давление которого измеряется манометром 2 со шкалой 3. Кнопкой 6 включается насос, питание насоса включается кнопкой 5. Кран 4 соединяет баллон с атмосферой. Стенд позволяет измерить давление газа в баллоне, которое изменяется в результате прохождения тепловых процессов в объёме газа. Проходящие процессы графически изображены на рисунке 3 в координатах Pи V.
В стеклянный баллон 1 (рисунок 2) при помощи насоса 7 накачивают воздух, создавая этим внутри баллона давление выше атмосферного. Это давление измеряется манометром 2. Начальное состояние газа на рис. 3 отображается точкой 1. Давление при этом равно P1удельный объём равенV1, температураt1равна температуре воздуха в лаборатории.
(P1;
V1; t1)
P
P1 1
изотерма
3
(P3;
V2; t1)





P3

изохора

адиабата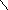

P2 2
(P2;
V2; t2)

V
V1
V2
Рисунок 3 -
Быстрое расширение газа можно рассматривать как адиабатическое (без обмена теплом с окружающей средой, теплообмен не успевает произойти). Поэтому, если открыть кран 4 на короткое время, в течение которого давление внутри баллона снизится до атмосферного и снова закрыть его, газ в баллоне адиабатически перейдет в новое состояние 2, характеризуемое давлением P2, удельным объёмом V2и температуройt2(точка 2 на рисунке 3). Кривая 1-2, по которой меняютсяP,V,t- адиабата, описываемая уравнением Пуассона(22)
![]()
Температура газа t2 в конце адиабатического расширения будет меньше, чемt1, т.к. совершается работа расширения газа (23) за счет его внутренней энергии (21), что и приводит к снижению температуры. Параметры начального и конечного состояния газа связанны уравнением Пуассона
![]() ,
(24)
,
(24)
Вследствие теплопроводности стенок баллона газ будет нагреваться до температуры окружающего воздуха t1.Это происходит за 4-5 минут. Поскольку при этом кран 4 закрыт,V2остается неизменным, давление из-за нагрева повысится доP3 (изохорически, т.к.V=const).
Новое состояние газа характеризуется параметрами (P3, V2, t1) – точка 3 на
рисунке 3. Обратите внимание, температура состояния 3 и 1 – одинаковые, это температура воздуха в лаборатории. Поэтому, в соответствии с законом Бойля-Мариотта, для газа при одной и той же температуре P иVсвязаны соотношениемPV=const, откуда
![]() ,
(25)
,
(25)
Точка 3 лежит на изотерме 3-1, по которой изменится состояние газа в баллоне до первоначального, исходного 1, если мы откроем кран 4. Эта операция не входит в наши измерения.
Таким образом, мы замерили давление P1после накачки,P2после кратковременного открытия и закрытия крана иP3 после нагрева закрытого баллона до температуры окружающего воздухаt1
Теперь произведем некоторые чисто алгебраические операции с соотношением (25), чтобы избавиться от неизвестных V1, V2. Возведем (25) в степень γ и разделим почленно на уравнение (24)
![]() ;
→
;
→ ;
→
;
→ ;
→
;
→ ,
(26)
,
(26)
Прологарифмуем уравнение (26)
 ,
(27)
,
(27)
Формула (27) показывает, как по измеренным P1, P2, P3 мы можем рассчитать γ.
Но условия эксперимента позволяют упростить расчетную формулу (27) следующим образом. Обозначим давление в баллоне через P1, а разность уровней жидкости в манометре черезH, тогда
![]() ,
(28)
,
(28)
где P2– атмосферное давление;
b- коэффициент перехода от разности уровней манометра к разности давлений (т.е. цена деления шкалы манометра в единицах давления).
Обозначим через h разность уровней манометра после того, как мы открыли и закрыли кран 4 и выждали 4-5 минут для нагрева газа в баллоне до температуры окружающего воздухаt1(т.е. до параметров точки 3 рис. 3). Тогда
![]() ,
(29)
,
(29)
где P3- давление газа в баллоне в точке 3;
P2– атмосферное давление;
b– коэффициент перехода от разности уровней к давлению;
h- разность уровней манометра в точке 3.
Из (28)
![]() (30) и подставляя его в (29) получим
(30) и подставляя его в (29) получим
![]() ,
(31)
,
(31)
И, наконец, подставляя выражение P2 из (30) иP3из (31) в основную формулу для γ (27), получим
 ,
(32)
,
(32)
Величины
![]() и
и![]() много меньше единицы, поэтому можно
воспользоваться формулой
много меньше единицы, поэтому можно
воспользоваться формулой![]() ,
справедливой для малыххс точностью
до нескольких процентов. Заменяя
логарифмы в (32) на -
,
справедливой для малыххс точностью
до нескольких процентов. Заменяя
логарифмы в (32) на -![]() и -
и -![]() ,
получим
,
получим
 ,
(33)
,
(33)
Формула (33) и будет расчетной в наших измерениях γ.
