- •11.Основные законы гидродинамики.Уравнение неразрывности струи
- •26.Торема гаусса и применение
- •27.Электрическое поле заряженной плоскости плоскость
- •28.Электрическое поле заряженной сферы сфера
- •29.Электрическое поле заряженной нити
- •30.Диэлектрики в электрическом поле .Явление поляризации диэлектриков
- •31.Постоянный электрический ток.Закон Ома и Джоуля-Ленца
- •32.Правило Киргофа
- •33.Магнитное поле.Понятие о магнитной индукции.ЗаконБио-саввара –лапаса
- •34.Магнитное поле прямого тока.Магнитное поля кругового тока.
- •35.Понятие магнитного потока.Сила Ампера
- •36.Закон полного тока
- •37.Уравнение Максвелла
- •§1.3. Второе уравнение Максвелла.
- •§1.4. Третье уравнение Максвелла. Закон сохранения заряда.
- •§1.5. Четвертое уравнение Максвелла.
- •38.Волны и их виды.Уравнение плоской волны.Энергия волны
- •39.Звуковые волны их характеристики.
- •40.Явление интерференции.Усл. Макс и мин
- •41.Примеры интерференции света.Меьод Юнга, в тонких пленках, кольца Ньютона
- •43.Дифракция света.Зоны Френеля
- •43.Дифракционная решетка.Угловая и линейная дисперсия.Разрешающая способность
- •44.Явление поляризации свтеа.ЗаконыБрюстера, Малюса
- •45.Двойноелучеприломление света
- •46.Тепловое излучение тела.Законыкиргофа, стефана-больцмана и вина
- •47.Ультрафиолетовая катастрофа, формула планка, квантовая природа излучения
- •48.Основы голографии.Получ. Голографич. Изображ. И их воспроизв.
- •49.Внешний фотоэффект.Уравн. Энштейна для фотоэфекта.Многофотонныйвнешн. Эффект.
- •50.Внутренний фотоэффект
- •51.Рентгеновские лучи, методы получения.Эффекткомптона.Давление света
- •52.Атом резерфорда –бора.Энергия атома водорода и водородоподобных атомов
- •53.Спектры излучения и поглощения атома водорода
- •54.Корпускулярно-волновой дуализм.Гипотеза де-бройля
- •55.Соотношение неопределенностей
- •56.Уравнение шреденгера.Волновая функция и ее физ. Смысл
- •57.Квантование энергии электрона в потенциальной яме.
- •58.Квантовые генераторы.Принцип работы
- •59.Основы зонной теории вещ-ва-проводники, диэлектрики полупрводники
- •60.Собственная и примесная проводимость полупроводников
- •61.Пи-н переход.Свой-ва
- •62.Полупроводниковый диод.Транзистор.Принцип работы
- •63.Строение ядра атома.Деффектмассы,энергия связи
- •64.Явление радиоактивности.З.Радиоактивного распада
- •65.Алфа бетта гамма распады
- •66.Ядерная реакция.Энергия ядерных реакций
52.Атом резерфорда –бора.Энергия атома водорода и водородоподобных атомов
Планетарная модель атома Бора-Резерфорда. В 1911 году[6] Эрнест Резерфорд, проделав ряд экспериментов, пришёл к выводу, что атом представляет собой подобие планетной системы, в которой электроны движутся по орбитам вокруг расположенного в центре атома тяжёлого положительно заряженного ядра («модель атома Резерфорда»). Однако такое описание атома вошло в противоречие склассической электродинамикой. Дело в том, что, согласно классической электродинамике, электрон при движении сцентростремительным ускорениемдолжен излучатьэлектромагнитные волны, а, следовательно, терятьэнергию. Расчёты показывали, что время, за которое электрон в таком атоме упадёт на ядро, совершенно ничтожно. Для объяснения стабильности атомовНильсу Борупришлось ввестипостулаты, которые сводились к тому, что электрон в атоме, находясь в некоторых специальных энергетических состояниях, не излучает энергию («модель атома Бора-Резерфорда»). Постулаты Бора показали, что для описания атома классическая механика неприменима. Дальнейшее изучение излучения атома привело к созданиюквантовой механики, которая позволила объяснить подавляющее большинство наблюдаемых фактов.
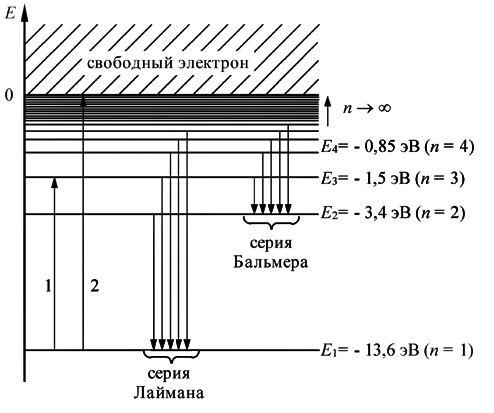
энергетический спектр электрона в атоме водорода. В области положительных энергий энергетический спектр свободного электрона является сплошным спектром. В области отрицательных значений полной энергии энергетический спектр связанного с атомом электрона становится дискретным. Для наглядности на рис. 5.5 каждому возможному значению энергии соответствует энергетический уровень. В стационарном состоянии электрон может находится на одном из этих дискретных энергетических уровней. Переход электрона с одного уровня на другой на этом рисунке может быть изображен соответствующей стрелкой, начало и конец которой указывают энергетические уровни, между которыми происходит переход.
|
|
|
Рис. 5.5. |
Обычно
атом находится в основном состоянии с
наименьшим значением энергии, равным ![]() .
В этом состоянии атома электрон движется
по первой стационарной орбите, имеющей
минимальный радиус, равный
.
В этом состоянии атома электрон движется
по первой стационарной орбите, имеющей
минимальный радиус, равный![]() .
.
Если атому сообщить дополнительную энергию, то он может перейти в возбужденное состояние (переход 1 на рис. 5.4). Электрон при этом переходит на орбиту большего радиуса. Возбуждение атомов может инициироваться различными способами, например, столкновением атомов газа в хаотическом тепловом движении, пропусканием через газ потока высокоэнергетических частиц (электронов, альфа-частиц и др.) и, наконец, поглощением атомами излучения.
Если энергия, переданная электрону будет достаточно велика, то электрон может преодолеть силу притяжения к ядру и оторваться от атома. Такой процесс называют ионизацией атома. Из рис. 5.4 видно, что минимальная энергия, необходимая для ионизации атома водорода (переход 2), равна
|
|
53.Спектры излучения и поглощения атома водорода
Спектр Излучения Атома Водорода
В нагретом до высокой температуры водороде можно наблюдать характерный линейчатый спектр. Все спектральные линии группируются в серии в зависимости от того, на какой энергетический уровень переходят электроны.
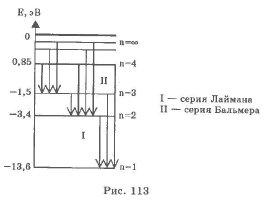
Переходы в первые возбужденные состояния на второй энергетический уровень с верхних уровней образуют серию Бальмера (n = 2), при переходе на первый энергетический уровень с n = 1 образуют серию Лаймана (