
Отчет по лабам
.docxЛабораторная работа №1
«Дифференциально-фотометрическое определение железа в виде роданидного комплекса»
Приготовили стандартные растворы железа в узком интервале значений концентраций.
Для этого: в шесть пробирок добавили соответственно 0,1; 0,3; 0,5; 0,7; 0,9 мл раствора содержащего 0,1 мг/мл железа. Все растворы подкисляем 1 мл азотной кислоты HNO3 (1:1), добавляем по 4 мл 10%-ного NH4CNS, доводим до метки водой и перемешиваем.
Затем измеряем оптическую плотность каждого раствора с помощью прибора ФЭК-56М. Его оптическая схема представлена на рис.1

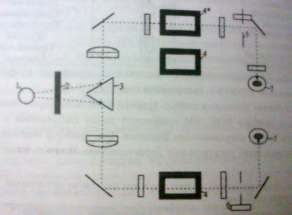
Рисунок 1 – Оптическая схема ФЭК-56М
Настройку фотоколориметра производим по раствору сравнения с наименьшей концентрацией. Результаты измерений заносим в таблицу 1.
Таблица 1 – Результаты измерений.
|
№ р-ра |
Концентрация С, мг/мл |
Оптическая плотность D |
Средняя оптическая плотность Dср. |
|
1 |
0,0006 |
0,172 |
0,172 |
|
0,171 |
|||
|
0,172 |
|||
|
2 |
0,001 |
0,373 |
0,374 |
|
0,373 |
|||
|
0,375 |
|||
|
3 |
0,0014 |
0,529 |
0,529 |
|
0,530 |
|||
|
0,529 |
|||
|
4 |
0,0018 |
0,735 |
0,734 |
|
0,734 |
|||
|
0,734 |
|||
|
задача |
|
0,110 |
0,110 |
|
0,109 |
|||
|
0,110 |
На основании полученных данных строим градуировочный (калибровочный) график зависимости D(C).
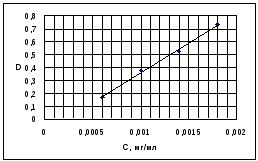
Рисунок 2 – градуировочный график
По графику определяем концентрацию задачи. Сзад= 0,0005 мг/мл
Лабораторная работа №2
«Фотометрическое определение фосфора в виде фосфорномолибденового комплекса»
Определение фосфора основано на реакции восстановления фосфорномолибденового комплекса до соединения, отвечающего формуле (MoO2*4MoO3)2*H3PO4 и окрашенного в синий цвет.
В мерных колбах вместимостью 50 мл готовим серию из пяти растворов. Для этого: В каждую колбу добавляем 0,1; 0,3; 0,5; 0,7; 0,9 мл стандартного раствора КH2PO4 с концентрацией 0,1 мг/мл приливают немного дистиллированной воды, затем по 2мл 2,5%-ного раствора молибдата аммония, снова добавляют немного воды, затем 6 капель дихлорида олова. Раствор дихлорида олова готовят так: 1,25 г SnСl2 растворяют в 50 мл 10%-ного раствора HCl. Уровень растворов в колбах доводят до метки дистиллированной водой и тщательно перемешивают. Через 15 минут после добавления дихлорида олова выполняем колориметрирование.
Результаты измерений заносим в таблицу 1.
Таблица 1 – Результаты измерений.
|
№ р-ра |
Концентрация С, мг/мл |
Оптическая плотность D |
Средняя оптическая плотность Dср. |
|
1 |
0,0002 |
0,363 |
0,361 |
|
0,362 |
|||
|
0,359 |
|||
|
2 |
0,0004 |
0,583 |
0,579 |
|
0,580 |
|||
|
0,575 |
|||
|
3 |
0,0006 |
0,770 |
0,767 |
|
0,766 |
|||
|
0,764 |
|||
|
4 |
0,0008 |
1,106 |
1,106 |
|
1,106 |
|||
|
1,106 |
|||
|
5 |
0,001 |
1,222 |
1,222 |
|
1,224 |
|||
|
1,221 |
|||
|
задача |
|
0,599 |
0,597 |
|
0,598 |
|||
|
0,595 |
На основании полученных данных строим градуировочный (калибровочный) график зависимости D(C).
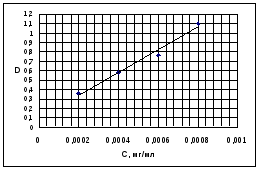
Рисунок 2 – градуировочный график
По графику определяем концентрацию задачи. Сзад= 0,00037 мг/мл
Лабораторная работа №3
«Спектрофотометрическое определение равновесных концентраций сопряженных кислотно-основных форм метилового оранжевого в растворе»
Равновесные концентрации сопряженных кислотно-основных форм веществ, имеющих различные спектральные характеристики, могут быть определены по методу Фирордта. В качестве объекта анализа выбран краситель метиловый оранжевый:
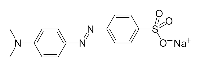
кислотная форма метилоранжа
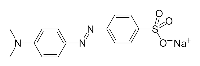
основная форма метилоранжа
Дан раствор H2SO4 c концентрацией С(H2SO4)=1 М, а нам нужно приготовить раствор с концентрацией С(H2SO4)=0,05 М
Рассчитаем, какой объем нам нужно взять для приготовления этого раствора в колбе на 50 мл по закону эквивалентов: V2=C2*V1/C2= 0,05*50/1 = 2,5 мл
Дан раствор NaOH c концентрацией С(NaOH)=0,01 М, а нам нужно приготовить раствор с концентрацией С(NaOH)=0,005 М
Рассчитаем, какой объем нам нужно взять для приготовления этого раствора в колбе на 50 мл по закону эквивалентов: V2=C2*V1/C2= 0,005*50/0,01 = 2,5 мл
Далее приготовим 5 рабочих растворов с концентрациями метилоранжа:
-
6*10-6
-
9*10-6
-
1,2*10-5
-
1,5*10-5
-
1,8*10-5
Рассчитаем, какой объем нам нужно взять для приготовления каждого раствора в колбе на 50 мл по закону эквивалентов соответственно: V2=C2*V1/C2
-
V=6*10-6*50/1,5*10-4=2 мл
-
V=9*10-6*50/1,5*10-4=3 мл
-
V=1,2*10-5*50/1,5*10-4=4 мл
-
V=1,5*10-5*50/1,5*10-4=5 мл
-
V=1,8*10-5*50/1,5*10-4=6 мл
В каждую колбу добавляем 2,5 мл H2SO4 и 2,5 мл NaOH и соответствующий объем метилоранжа доводим водой до метки и перемешиваем.
Далее измеряем спектр поглощения приготовленных растворов в диапазоне длин волн 390-560 нм. Измерения проводим на спектрофотометре Specol, его оптическая схема представлена на рисунке 1.
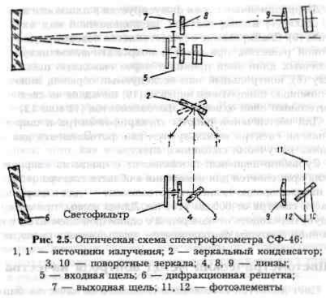
Рисунок 1 – оптическая схема спектрофотометра
Результаты измерений заносим в таблицу 1.
Таблица 1 – Результаты измерений.
|
λ,нм |
390 |
400 |
410 |
420 |
430 |
440 |
450 |
460 |
470 |
480 |
|
DHA |
0,016 |
0,017 |
0,031 |
0,058 |
0,099 |
0,158 |
0,237 |
0,342 |
0,461 |
0,578 |
|
DA |
0,218 |
0,261 |
0,307 |
0,347 |
0,383 |
0,413 |
0,433 |
0,452 |
0,450 |
0,423 |
|
DHA-DA |
-0,202 |
-0,244 |
-0,276 |
-0,289 |
-0,284 |
-0,255 |
-0,196 |
-0,110 |
0,011 |
0,155 |
|
λ,нм |
490 |
500 |
510 |
520 |
530 |
540 |
550 |
560 |
|
DHA |
0,688 |
0,783 |
0,807 |
0,775 |
0,733 |
0,653 |
0,435 |
0,223 |
|
DA |
0,369 |
0,297 |
0,218 |
0,146 |
0,086 |
0,043 |
0,020 |
0,004 |
|
DHA-DA |
0,319 |
0,486 |
0,589 |
0,629 |
0,647 |
0,592 |
0,415 |
0,219 |
По полученным данным строим спектр поглощения.
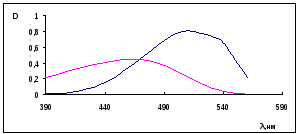
График 1 – спектр поглощения
1 - кислотная форма метилоранжа
2 - основная форма метилоранжа
Выбираем самую наибольшую и самую наименьшую разности при соответствующих длинах волн 530 и 420 нм. При соответствующих длинах волн измеряем оптические плотности растворов. Результаты измерений заносим в таблицу 2.
Таблица 2 – Результаты измерений
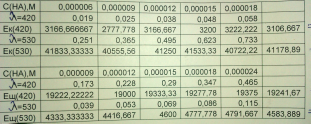
Все расчеты выполнены в программе Microsoft Excel по формулам:
ε=D/C ; ε=( ε1+ε2+ε3+ε4+ε5)/5
Задача: λ=420 D420=0,191
λ=530 D530=0,268
Cк=(Dз530 * εщ420 - Dз420 * εщ530)/( εщ420* εк530- εщ530* εк420) = 5,5*10-6 М
Сщ=(Dз420 * εк530 - Dз530 * εк420)/( εщ420* εк530- εщ530* εк420)= 9,0*10-6 М
С= Ск+Сщ=5,5*10-6+9,0*10-6=1,45*10-5 М
Лабораторная работа №4
«Определение константы кислотной диссоциации бромфенолового синего»
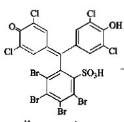
Бромфеноловый синий
Водные растворы бромфенолового синего меняют окраску с желтой на синюю при изменении pH с 3,8 до 5,4. Переход окраски обусловлен отщеплением второго протона от молекулы индикатора.
HA- ↔ A2-+H+
Полоса поглощения желтой формы располагается при 440 нм, а синей – при 630 нм. Исследуя спектры поглощения бромфенолового синего в диапазоне pH от 2 до 8, можно определить константу его кислотной диссоциации по второй ступени – Ка,2
В мерные колбы вместимостью 250 мл помещают по 100 мл буферной смеси и соответствующее количество NaOH для каждого pH. Определение объема NaOH производим по таблице 7.25 в методичке.
1) pH=1,81 VNaOH= 0 мл
2) pH=2,56 VNaOH= 15 мл
3) pH=4,10 VNaOH= 25 мл
4) pH=4,56 VNaOH= 30 мл
5) pH=5,33 VNaOH= 37,5 мл
6) pH=7,96 VNaOH= 60 мл
Далее для каждого приготовленного раствора измеряем pH на pH-метре
|
pHтеор |
pHпракт |
|
1,81 |
1,52 |
|
2,56 |
2,51 |
|
4,10 |
3,95 |
|
4,56 |
4,51 |
|
5,33 |
5,35 |
|
7,96 |
7,86 |
В мерных колбах готовим раствор, для этого в каждую из 6 колб наливаем 2 мл бромфенолового синего и наполняем до метки буферной смесью соответствующих pH. Берем самый кислый и самый щелочной растворы (1 и 6) и измеряем оптические плотностив диапазоне от 390 нм до 650 нм через 20 нм на спектрофотометре Specol. Его оптическая схема представлена в предыдущей лабораторной работе. Результаты измерений заносим в таблицу 1.
Таблица 1 – Результаты измерений
|
λ,нм |
D1 |
D2 |
|
390 |
0,168 |
0,086 |
|
410 |
0,253 |
0,024 |
|
430 |
0,312 |
0,011 |
|
450 |
0,293 |
0,02 |
|
470 |
0,22 |
0,042 |
|
490 |
0,13 |
0,081 |
|
510 |
0,06 |
0,152 |
|
530 |
0,019 |
0,269 |
|
550 |
0,002 |
0,433 |
|
570 |
0 |
0,636 |
|
590 |
0 |
0,928 |
|
610 |
0 |
0,465 |
|
630 |
0 |
0,07 |
|
650 |
0 |
0,004 |
На основании полученных данных строим спектр поглощения

График 1 – Спектр поглощения
-
самый кислый раствор из колбы 1
-
самый щелочной раствор из колбы 6
Далее выбираем самую большую оптическую плотность при соответствующей длине волны и измеряем оптические плотности всех растворов на этой длине волны. Результаты измерения заносим в таблицу 2.
Таблица 2 – Результаты измерений
|
λ,нм |
1 |
2 |
3 |
4 |
5 |
6 |
|
D |
0,001 |
0,053 |
0,495 |
0,728 |
0,87 |
0,928 |
На основании полученных данных строим график зависимости D(pH)

График 2 - график зависимости D(pH)
По графику определим:
D=(DHA+DA)/2 = (0,001+0,928)/2 = 0,46
При D = 0,46 pH=4,3
pKa=-lgKa
Капр=-lg4,3 = 10-4,3
Рассчитываем константу кислотности
Ка=(D-DHA/DA-D)* 10-pH
-
Ка=1,8*10-4
-
Ka=1,3*10-4
-
Ka=1,1*10-4
-
Ka=0,7*10-4
Kср=∑Ka,i/4= 1,2*10-4
Рассчитаем ошибку
δ=(|Ка,теор-Ка,ср|/ Ка,теор)*100%
δ=|10-4-10-4,3|/10-4=0,05 или 5%
Лабораторная работа №5
«Спектрофотометрическое определение фенольных гидроксильных групп в лигнине»
Метод основан на использовании известного в УФ спектроскопии свойства спектральных полос батохромно смещаться при ионизации фенольных гидроксильных групп. Различают 4 типа модельных соединений структурного звена лигнина, содержащих фенольную гидроксильную группу:
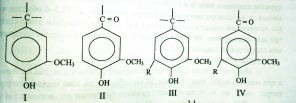
Данную работу выполняли в такой последовательности:
1) Брали навеску лигнина m=13,6 мг, растворили в 10 мл 0,1Н NaOH. Затем в три мерные колбы вместимостью 50 мл отобрали по 2 мл щелочного раствора; одну из колб заполнили до метки буферным раствором с pH 6, вторую – буферным раствором с pH 12,0, третью – NaOH (0,2 Н)
2) После тщательного перемешивания растворы заливали в кварцевые кюветы (толщина поглощающего слоя 1см) и фотометрировали с помощью спектрофотометра Specol, его оптическая схема представлена в л/р №3. Записывали спектр от 250 до 450 нм через каждые 10 нм. Результаты измерений представлены в таблице 1.
Таблица 1 – Результаты измерений
|
λ, нм |
D pH 12,0 |
D NaOH |
|
250 |
0,223 |
0,717 |
|
260 |
0,143 |
0,456 |
|
270 |
0,047 |
0,166 |
|
280 |
0,000 |
0,076 |
|
290 |
0,010 |
0,256 |
|
300 |
0,065 |
0,427 |
|
310 |
0,088 |
0,371 |
|
320 |
0,111 |
0,324 |
|
330 |
0,158 |
0,342 |
|
340 |
0,188 |
0,352 |
|
350 |
0,208 |
0,365 |
|
360 |
0,203 |
0,355 |
|
370 |
0,174 |
0,320 |
|
380 |
0,140 |
0,273 |
|
390 |
0,111 |
0,229 |
|
400 |
0,097 |
0,195 |
|
410 |
0,086 |
0,166 |
|
420 |
0,077 |
0,141 |
|
430 |
0,069 |
0,121 |
|
440 |
0,063 |
0,106 |
|
450 |
0,055 |
0,090 |
По полученным данным строим спектр поглощения, он представлен на графике 1.
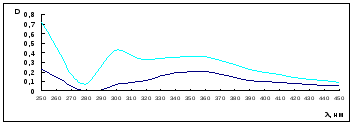
График 1 – Спектр поглощения
-
щелочной раствор лигнина
-
раствор лигнина с pH 12,0
Концентрация раствора лигнина (водного) составляет С1=1,36 мг/мл
Концентрация щелочного раствора лигнина по закону эквивалентов
С2=V1*C1/V2
С2=2*1,36/50=0,05мг/мл
Из таблицы выберем следующие значения оптической плотности и по ним рассчитаем соответствующие коэффициенты поглощения по формуле ∆ε=D/(c*l)
D1’=0,427 ∆ε1’=7,849
D1’’=0,365 ∆ε1’’=6,709
D2’=0,065 ∆ε2’=1,195
D2’’=0,208 ∆ε2’’=3,823
Далее эти цифры подставим в формулы и рассчитаем массовые доли OH-групп.
[OHI+III]=0,425∆ε1’ +0,101∆ε1’’
[OHI+III]= 0,425*7,849+0,101*6,709=4,014%
[OHII+IV]=0,081∆ε1’’
[OHII+IV]=0,081*6,709=0,543%
[OHI+II+III+IV]= 0,425∆ε1’+0,182∆ε1’’
[OHI+II+III+IV]= 0,425*7,849+0,182*6,709=4,557%
[OHI]=0,425∆ε2’
[OHI]=0,425*1,195=0,508%
[OHII]=0,081∆ε2’’
[OHII]=0,081*3,823=0,310%
[OHIII]= [OHI+III]-[OHI]=4,014-0,508=3,506%
[OHIV]= [OHII+IV]-[OHII]=0,543+0,310=0,233%
Лабораторная работа №6
«Проверка правила зеркальной симметрии спектров поглощения и флуоресценции родамина С»
Правило Левшина, называемое также правилом зеркальной симметрии, утверждает то, что нормированные спектры поглощения и флуоресценции, представленные в виде графиков ε=f(υ) и I/υ= f(υ), зеркально симметричны относительно прямой, перпендикулярной оси частот и проходящей через точку пересечения спектров υ0, причем для υ0 можно записать: υa+ υf=2 υ0 , где υa и υf - симметричные частоты поглощения и флуоресценции.

Структурная формула родамина С
Приготовим раствор родамина С с концентрацией 1,5*10-5моль/л из раствора с концентрацией 2*10-5 моль/л. По закону эквивалентов:
С1*V1=C2*V2
1,5*10-5*50 = 2*10-58*V
V=37,5 мл
Взяли колбу на 50 мл, налили 37,5 мл раствора родамина С и довели водой до метки и перемешали. Измерили интенсивность флуоресценции и оптическую плотность (в диапазоне длин волн 450 – 620 нм) на спектрофлуориметре, его оптическая схема представлена на рисунке 1.
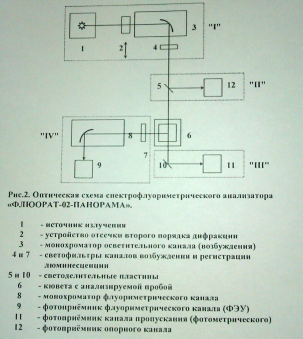
Рисунок 1 – Оптическая схема спектрофлуориметра
Результаты измерений занесли в таблицу 1.
Таблица 1 – Результаты измерений
|
λ, нм |
D |
J |
|
450 |
0,039 |
0,006 |
|
460 |
0,062 |
0,006 |
|
470 |
0,109 |
0,004 |
|
480 |
0,175 |
0,200 |
|
490 |
0,285 |
0,004 |
|
500 |
0,439 |
0,003 |
|
510 |
0,674 |
0,003 |
|
520 |
0,822 |
0,004 |
|
530 |
0,997 |
0,009 |
|
540 |
1,654 |
0,018 |
|
550 |
2,619 |
0,044 |
|
560 |
2,250 |
0,164 |
|
570 |
0,958 |
0,761 |
|
580 |
0,310 |
1,721 |
|
590 |
0,077 |
1,750 |
|
600 |
0,017 |
1,242 |
|
610 |
0,004 |
0,832 |
|
620 |
0,016 |
0,623 |
Используя полученные значения из таблицы 1 заполняем таблицу 2 по формулам: υ=с/λ; с=3*108м/с=3*1010см/с; ε=D/с; с=1,5*10-5моль/л
Таблица 2
|
λ*107,нм |
υ*10-12,см-1 |
υ4*1059,см-4 |
ε*105 |
ε/υ*10-12 |
J/υ4*10-59 |
|
450 |
666,7 |
1,98 |
0,03 |
4,50 |
0,0033 |
|
460 |
652,2 |
1,81 |
0,04 |
6,13 |
0,0030 |
|
470 |
638,3 |
1,66 |
0,07 |
10,97 |
0,0020 |
|
480 |
625,0 |
1,53 |
0,12 |
19,20 |
0,0010 |
|
490 |
612,2 |
1,40 |
0,17 |
27,77 |
0,0030 |
|
500 |
600,0 |
1,30 |
0,30 |
50,00 |
0,0023 |
|
510 |
588,2 |
1,19 |
0,45 |
76,50 |
0,0025 |
|
520 |
576,9 |
1,11 |
0,55 |
95,34 |
0,0036 |
|
530 |
566,0 |
1,03 |
0,66 |
116,61 |
0,0087 |
|
540 |
555,5 |
0,95 |
1,10 |
198,02 |
0,0189 |
|
550 |
545,4 |
0,88 |
1,75 |
321,10 |
0,0500 |
|
560 |
535,7 |
0,82 |
1,50 |
279,85 |
0,2000 |
|
570 |
526,3 |
0,76 |
0,64 |
121,60 |
1,0000 |
|
580 |
517,2 |
0,71 |
0,21 |
40,60 |
2,4200 |
|
590 |
508,5 |
0,67 |
0,05 |
9,83 |
2,6100 |
|
600 |
500,0 |
0,62 |
0,01 |
2,00 |
2,0000 |
|
610 |
491,8 |
0,59 |
0,00 |
0,61 |
1,4100 |
|
620 |
483,9 |
0,55 |
0,01 |
2,07 |
1,1300 |
