
- •Тема 1. Введение………………………………………………………………….4
- •Тема 1. Введение.
- •Тема 2. Физические основы горения.
- •2.1. Свойства газов.
- •2.2. Свойства газовых смесей.
- •3. Парциальные давление и объем.
- •2.3. Свойства жидкостей.
- •2.4. Свойства сжиженных газов.
- •2.5. Свойства твердых веществ.
- •Тема 3. Химические основы горения.
- •3.1. Химизм реакций горения.
- •3.2.Теплосодержание веществ.
- •3.3. Тепловой эффект реакции.
- •3.4. Кинетические основы газовых реакций.
- •3.5. Энергия активации реакции.
- •3.6. Катализ.
- •3.7. Адсорбция.
- •Тема 4. Виды горения.
- •4.1. Горение газообразных, жидких и твердых веществ.
- •4.2. Гомогенное и гетерогенное горение.
- •4.3. Диффузионное и кинетическое горение.
- •4.4. Нормальное горение.
- •4.5. Дефлаграционное (взрывное) горение.
- •4.6. Детонационное горение.
- •Тема 5. Показатели пожаровзрывоопасности веществ.
- •5.1. Общие показатели для горючих веществ и видов горения.
- •5.2. Показатели взрывопожароопасности газо-, паро- и пылевоздушных смесей.
- •5.3. Показатели пожароопасности твердых компактных и пыле- видных веществ.
- •Тема 6. Возникновение горения.
- •6.1. Тепловое самовоспламенение (тепловой взрыв).
- •6.2. Самовозгорание.
- •6.3. Цепное самовоспламенение (цепной взрыв).
- •6.4. Зажигание.
- •Тема 7. Распространение пламени.
- •7.1. Тепловая теория горения.
- •7.2. Горение в замкнутом объеме.
- •7.3. Движение газов при горении.
- •7.4. Факторы ускорения горения.
- •7.5. Условия возникновения взрыва.
- •Тема 8. Ударные волны и детонация.
- •8.1. Ударные волны в инертном газе.
- •8.2. Воспламенение при быстром сжатии.
- •8.3. Возникновение детонации.
- •8.4. Стационарный режим распространения детонации.
- •8.5. Определение скорости детонации.
- •8.6. Вырождение детонации.
- •Тема 9. Погасание пламени (прекращение горения).
- •9.1. Концентрационные пределы распространения пламени.
- •9.2.Общие закономерности для пределов распространения пламени.
- •9.3. Затухание пламени в узких каналах.
- •9.5. Закономерности для точки флегматизации.
- •9.6. Механизм флегматизации взрывоопасных смесей.
2.4. Свойства сжиженных газов.
Сжижение газов осуществляется путем охлаждения их ниже темпера-туры кипения. Промышленный метод сжижение газов основан на использо-вании положительного эффекта Джоуля-Томпсона, т.е. изменения темпера-туры газа при его дросселировании.
Дросселированием называется уменьшение давления газа при адиаба-тическом истечении через узкие отверстия (адиабатический процесс – это процесс, проходящий без потерь тепла во внешнюю среду).
При этом температура газа понижается по зависимости:
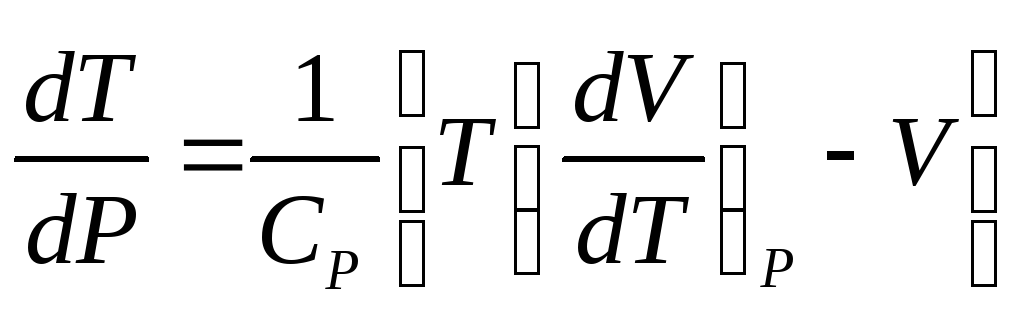 ,
(2.19)
,
(2.19)
Если
![]() ,
тоdT <
0 и газ охлаждается.
,
тоdT <
0 и газ охлаждается.
В промышленных условиях сильно сжатый и охлажденный до комнат-ной температуры газ подвергается неоднократному дросселированию и, со-ответственно, охлаждению до тех пор, пока не начинается сжижение газа. Охлаждение и сжижение происходят за счет работы расширения газа.
Примеры учета этих свойств жидкостей и газов в области пожаровзры-вобезопасности:
1. Быстрый выпуск сжиженного газа из баллона может привести к пе-ремерзанию запорного вентиля с последующей аварией.
2. В углекислотных огнетушителях выбрасываемый сжиженный угле-кислый газ распыляется, резко испаряется и охлаждается при этом до снего-образных частиц с температурой до – 700С.
3. Наиболее эффективными огнетушащими веществами являются лег-коиспаряющиеся жидкости, которые резко охлаждают зону горения.
2.5. Свойства твердых веществ.
Сильный нагрев твердого тела приводит к плавлению и переходу в жидкое состояние, а затем при испарении – в газ. Ряд твердых веществ может непосредственно из твердой фазы перейти в газообразное. Такой процесс на-зывается сублимацией, или возгонкой.
Фазовые превращения определяются изменением температуры и давле-ния. Для объяснения фазовых переходов используется диаграмма состояния, показанная на рис. 6, на которой дается зависимость между температурой фа-зового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих поле диаграммы на три области, соответ-ствующие условиям существования твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз. Кривые на диаграмме называются кривыми фазового равновесия. Каждая точка на них соответствует условиям равновесия двух сосуществую-щих фаз: КП – твердого тела и жидкости, КИ – жидкости и газа, КС – твердо-го тела и газа. Точка К – критическая точка.
Точка, в которой пересекаются все кривые и которая, следовательно, определяет условия ТТР и РТР одновременного равновесного состояния трех фаз, называется тройной точкой (mТР). Каждое вещество имеет только одну тройную точку.
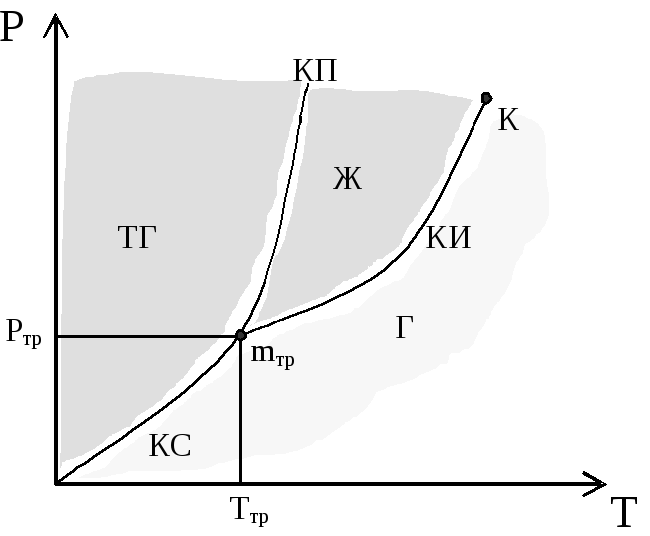
Рис. 6. Диаграмма состояния фаз в системе твердое тело – жидкость – газ.
Диаграмма состояния позволяет судить, в каком состоянии находится вещество при определенных Р и Т, а также какие фазовые переходы могут протекать при том или ином процессе.
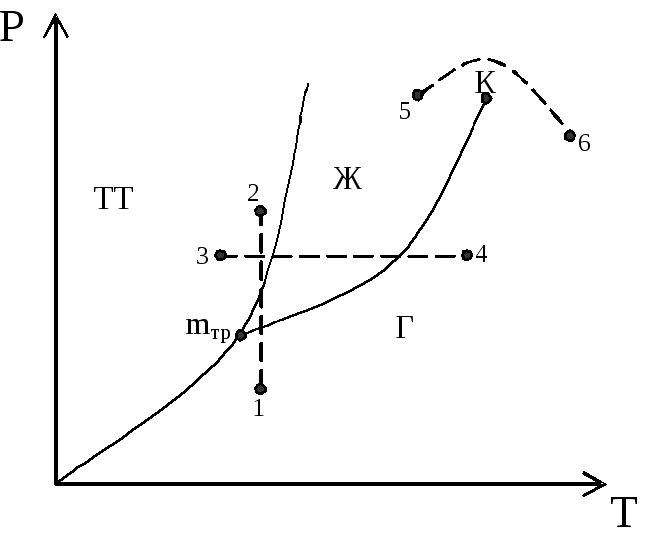
Рис. 7. Фазовые переходы в систе-
ме твердое тело – жидкость – газ.
Например (рис. 7): если вещество находится в точке 1, то при изотер-мическом сжатии оно проходит состояния жидкости и кристаллического (ли-ния 1-2); если вещество находится в т. 3, то при изобарном нагреве (линия 3-4), оно проходит состояния: твердое - жидкое и газ.
Из диаграммы видно, что кривая испарения заканчивается в критиче-ской точке К. Благодаря этому возможен непрерывный переход вещества из жидкого состояния в газообразное и обратно в обход точки К (переход 5-6) без пересечения кривой испарения, т.е. такой переход не сопровождается фа-зовыми превращениями.
Таким
образом, плавление однокомпонентного
вещества происходит при постоянной для
данного давления температуре плавления.
Количество теплоты, необходимое для
расплавления единицы массы твердого
тела, на-зывается удельной теплотой
плавления (![]() ).
При повышении давления для большинства
веществ температура плавления повышается.
При конденсации паров и кристаллизации
т.е. при Т<TИСП
и Т<ТПЛ,
теплота выделяется из ве-щества. Диаграмма
состояния в координатах температура-время
при P=const такова (рис. 8).
).
При повышении давления для большинства
веществ температура плавления повышается.
При конденсации паров и кристаллизации
т.е. при Т<TИСП
и Т<ТПЛ,
теплота выделяется из ве-щества. Диаграмма
состояния в координатах температура-время
при P=const такова (рис. 8).
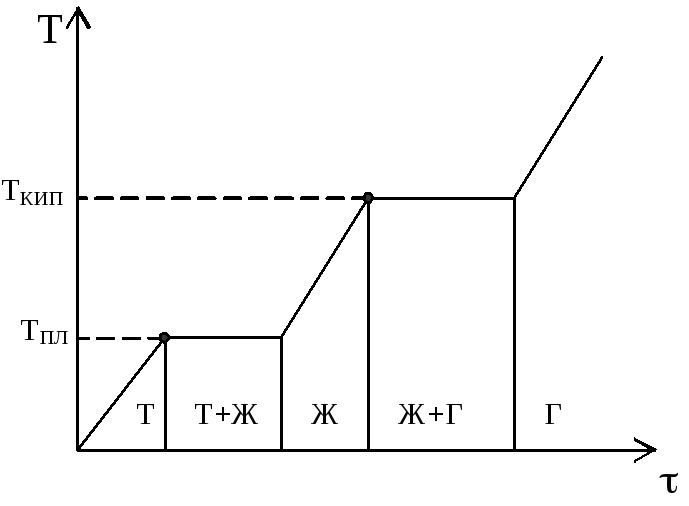
Рис. 8. Термограмма состояния вещества.
Испарение и плавление твердых тел сопровождается поглощением теп-лоты испарения или плавления, затрачиваемой на преодоление связей между частицами и на отрыв частиц от поверхности кристаллов или жидкости.
![]() .
.
Температуры плавления твердых тел и кипения жидкостей различны и объясняются разными энергиями связей между атомами и молекулами ве-ществ.
Рассмотренные физические свойства веществ учитываются при разра-ботке, выборе и оценке эффективности огнетушащих средств и материалов.
