
- •Введение
- •1 Получение карбонильных соединений каталитическим дегидрированием спиртов
- •3.1 Теоретические основы процесса дегидрирования спиртов
- •2 Экспериментальная часть
- •2.1 Характеристика сырья и материалов
- •2.2 Проведение контактирования
- •3 Методики анализов
- •3.1 Определение спиртов методом ацетилирования
- •3.2 Потенциометрический метод титрования. Определение карбонильных соединений на основе реакции оксимирования
- •3.2.1 Теоретические основы метода
- •3.2.2 Ход анализа
- •3.3 Определение сложных эфиров методом омыления
- •4 Материальный баланс процесса дегидрирования н-бутилового спирта
- •5 Расчёт безразмерных характеристик процесса дегидрирования н‑бутилового спирта. Результаты и их обсуждение
- •1 − Трехгорлая колба (реактор); 2 − штатив; 3 − водяная баня;
- •4 − Мешалка; 5 − термометр; 6 − электродвигатель;
- •7 − Обратный холодильник;
- •3.2.4 Расчёт количества зубчиков для подачи н-бутилового спирта на микродозаторе Галкина
4 Материальный баланс процесса дегидрирования н-бутилового спирта
Материальный баланс процесса дегидрирования н‑бутилового спирта представлен в таблице 4.
После составления материального баланса необходимо рассчитать погрешности по массе и по молям, используя данные таблицы 4.
Расчет потерь по массе ведется по формуле (16):

где
 -
масса исходного вещества, г;
-
масса исходного вещества, г;
 - масса продукта,
полученного в потоке 2, г;
- масса продукта,
полученного в потоке 2, г;
 - масса продукта,
полученного в потоке 3, г.
- масса продукта,
полученного в потоке 3, г.
Расчет мольных потерь ведется по формуле (17):

где
 -
количество молей исходного вещества,
моль;
-
количество молей исходного вещества,
моль;
 -
количество молей спирта, получившегося
в потоке 2, моль;
-
количество молей спирта, получившегося
в потоке 2, моль;
 -
количество молей альдегида, получившегося
в потоке 2, моль;
-
количество молей альдегида, получившегося
в потоке 2, моль;
 -
количество молей эфира, получившегося
в потоке 2, моль.
-
количество молей эфира, получившегося
в потоке 2, моль.
Таким образом потери по массе составили:

а потери по молям:


5 Расчёт безразмерных характеристик процесса дегидрирования н‑бутилового спирта. Результаты и их обсуждение
Степень превращения н-бутанола:

Выходы продуктов реакции:


Селективность продуктов реакции по исходному спирту:


Итак, в ходе дегидрирования н-бутанола с целью получения бутаналя был получен необходимый продукт с выходом 21,61%, также в ходе побочной реакции выделился ее побочный продукт – бутиловый эфир масляной кислоты с выходом 4,33 %.
Получение гидропероксидов окислением алкилбензолов
1.1 Теоретическое обоснование процесса
Реакция окисления органических веществ относится к реакциям радикального цепного вырожденно-разветвленного окисления, состоящим из трех основных стадий:
Стадия зарождения цепи.
В общем случае зарождение цепи в отсутствие инициирующих добавок происходит при взаимодействии растворенного в системе кислорода с наиболее слабыми С-Н связями окисляющегося органического соединения по бимолекулярной
RH+O2 → R· + HO2·;
и тримолекулярной реакции
 .
.
В начальном периоде окисления скорость зарождения цепи мала, что может быть одной из причин длительных периодов индукции при окислении органических соединений [1].
Стадия продолжения цепи.
Ценная реакция окисления в жидкой фазе осуществляется как чередование двух элементарных актов:
k1
R· + O2 → RO2·,
k2
RO2· + RH → ROOH + R·.
Алкильный радикал R· очень быстро и практически без энергии активации реагирует с кислородом, превращаясь в перекисный радикал RO2·.
Возникающие перекисные радикалы с увеличением глубины процесса начинают взаимодействовать не только с исходным углеводородом, но и с продуктами его превращения. В результате этого возникают новые свободные радикалы с другой активностью, что ведет к изменению механизма процессов [1].
Гидропероксид способен подвергаться распаду на радикалы (вырожденное разветвление), причем с большей скоростью, чем идет разрыв связи С-Н в углеводородах. Предполагают, что в начале процесса, когда концентрация гидропероксида мала, он распадается по мономолекулярному механизму
k3
ROOH → RO· + ·ОН − 146,65 кДж/моль.
С увеличением концентрации гидропероксида в реакционной смеси возрастает вероятность бимолекулярных реакций с исходным углеводородом
ROOH + RH → RO2· + Н2О + R·.
Ассоциация гидропероксида с гидропероксидом, спиртом, кетоном и исходной кислотой приводит к образованию комплексов, более быстро распадающихся на свободные радикалы, чем исходный гидропероксид, что играет важную роль в окислении органических соединений [1].
Стадия обрыва цепи.
Гибель свободных радикалов в цепных жидкофазных реакциях происходит в результате взаимодействия двух радикалов (квадратичный обрыв цепи) с образованием молекулярных продуктов
k4
R· + R → Pt1;
k5
R· + RO2· → Pt2;
k6
RO2· + RO2· → Pt3.
Реакция радикально − цепного окисления очень чувствительна к добавкам ингибиторов − веществ, тормозящих окисление, обрывая цепи по реакции с перекисными радикалами. К таким ингибиторам относятся фенолы и ароматические амины.
Катализ окисления солями переходных металлов. При окислении органических соединений в качестве катализаторов обычно используют органические соли кобальта, марганца, железа и других переходных металлов. Катализаторы ускоряют окисление и сокращают период индукции. Они позволяют проводить окисление при более низкой температуре, тем самым уменьшая количество нежелательных продуктов.
При окислении алкилбензолов влияние ароматического кольца сказывается как на повышение реакционной способности соседнего с ним атома углерода боковой цепи, так и на стабильности образующихся гидропероксидов. Реакция их образования протекает в жидкой фазе уже при температуре от 100 °С до 120 °С. Наиболее стабильны гидропероксиды треталкилбензолов, сравнительно устойчив и гидропероксид этилбензола.
Глубина окисления алкилбензола или концентрация гидропероксида в оксидате ограничивается развитием побочных реакций. В начале гидропероксид получается с выходом почти 100%, но затем выход постоянно падает, и все больше возрастает образование побочных продуктов. В связи с этим окисление ведут до степени превращения трет-алкилбензола: от 0,25 до 0,30 или до массовой доли гидропероксида в реакционной массе около 30 %. При получении гидропероксида этилбензола побочные реакции более существенны, поэтому глубину окисления поддерживают всего от 0,10 до 0,15 [1].
Цель работы: проведение каталитического окисления изопропилбензола и построение кривой накопления гидропероксида изопропилбензола.
1.2 Экспериментальная часть
1.2.1 Условия проведения процесса
Температура 110 °С.
Массовая доля соды 0,9 %.
Массовая доля резината марганца 0,2 %.
Объем изопропилбензола 20 мл.
Время контактирования 2 ч.
1.2.2 Характеристика сырья и материалов
Физико-химические свойства исходных веществ и продуктов реакции представлены в таблице 1 [2].
Таблица 1 − Физико-химические свойства исходных веществ и продуктов реакции
|
Вещество |
Молярная масса, г/моль |
Плотность, г/см3 |
Температура кипения, °С |
|
Изопропилбензол |
120,19 |
0,864 |
152,5 |
|
Гидропероксид изопропилбензола |
152,19 |
1,062 |
49,5-51 при 0,01 мм рт.ст. |
1.2.3 Методика эксперимента
Окисление проводится согласно методике [1 с.76-78] на лабораторной установке, представленной на рисунке 1.
Залить в реактор 20 см3 изопропилбензола, внести навески катализатора и добавок, ввести необходимое количество катализатора − гипериза из капельницы (осторожно, при попадании гипериза на плитку, может произойти вспышка и взрыв). Загрузка в реактор производится через боковой отвод, который затем закрывается пробкой.
Взвесить колбы с пробками для анализа на аналитических весах. Колбы должны быть чисто вымыты, высушены и подписаны.
Подставить предварительно нагретую до нужной температуры масленую баню под реактор и включить перемешивание.
Через пять минут, когда температура в реакторе достигает заданной, включить подачу кислорода. Скорость кислорода регулируется зажимом на линии реометра. Начало подачи кислорода считается началом опыта.
Через каждый час производить отбор проб на содержание гидроперекиси капилляром через боковой отвод при остановленной мешалке. Проба отбирается массой от 0,2 до 0,3 г в предварительно взвешенную колбу и взвешивается на аналитических весах. Анализ проводится в промежуток времени до следующего отбора.
Время реакции, скорость подачи кислорода и температуру бани отмечать в рабочем журнале каждые 30 минут, концентрацию гидропероксида каждый час. Время реакции в минутах считается от начала реакции.
Расчет загрузки катализатора.
Массовая доля резината марганца 0,2 %.
Массовая доля Na2C03 0,9 %.
Температура процесса 110 °С.
Масса изопропилбензола, загруженного в реактор определяется по формуле mипб = ρипб · Vипб, где ρипб − плотность изопропилбензола, г/см3; Vипб − объем изопропилбензола, см3.
Mипб = 0,864 · 20 = 17,28 г.
Масса катализатора резината марганца:
 г.
г.
Масса карбоната натрия:
 г.
г.
Таблица 2 − Ход эксперимента реакции каталитического окисления этилбензола
|
Время от начала опыта, мин |
Расход воздуха по реометру, дм3/мин |
Температура в реакторе, °С |
|
0 |
10,0 |
130 |
|
30 |
11,5 |
121 |
|
60 |
7,2 |
108 |
|
90 |
8,0 |
110 |
|
120 |
6,5 |
119 |
1.3 Обобщение и оценка результатов
1.3.1 Химизм процесса
C6H5-CH(CH3)2+ O2 → C6H5(CH3)2 СOOH.
1.3.2 Определение гидропероксида в оксидате
Определение органических гидропероксидов основано на реакции окисления ими йодистоводородной кислоты:
ROOH + 2KI + 2CH3COOH → ROH+I2 + 2CH3COOK + H20.
Выделившееся количество йода оттитровывается раствором гипосульфита натрия:
I2 + 2Na2S203 → Na2S406 + 2NaI.
В коническую колбу с пробкой берут пробу реакционной смеси от 0,2 до 0,3 г на аналитических весах, приливают 10 см3 ледяной уксусной кислоты и 1,5 см3 50 %-го раствора йодистого калия. После перемешивания содержимого колбу ставят в темное место. Через 15 минут содержимое колбы разбавляют 25 см3 дистиллированной воды. Выделившийся в результате реакции йод оттитровывают раствором с(Na2S203) = 0,1 моль/дм3 в присутствии раствора крахмала до обесцвечивания.
По окончании процесса.
Выключить холодильник, подачу кислорода. Вынуть плитку из под бани, а баню оставить под реактором, чтобы стекло масло с реактора.
Выключить воду на холодильник.
Остывший реактор снять с установки. Реакционную смесь, полученную при окислении углеводорода, слить в коническую колбу и взвесить на технических весах. Реактор и использованную посуду тщательно вымыть и высушить [1].
Расчет содержания гидропероксида в пробе ведут по формуле:
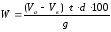 ,
,
где W − массовая доля гидропероксида, %;
Va − объем раствора тиосульфата натрия, пошедший на титрование пробы, см3;
Vв − объем раствора тиосульфата натрия, пошедший на титрование холостой пробы, см3 (0,1);
t − титр раствора тиосульфата натрия с концентрацией 0,1 моль/дм3 (0,939);
d − масса гидропероксида алкилбензола, соответствующая 1 см3 раствора с(Na2S203) = 0,1 моль/дм3, г/см3.
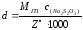 ,
,
где МГП − молярная масса гидропероксида, г/моль;
Z· − число эквивалентности, равное числу электронов, участвующих в реакции окисления − восстановления между гидропероксидом и ионами I -.
 г/см3;
г/см3;
 %;
%;
 %;
%;
 %;
%;
 %.
%.
Результаты эксперимента приведены в таблице 3.
Таблица 3 − Результаты эксперимента
|
№ пробы |
Масса навески, г |
Объем Na2S203, пошедший на титрование, см3 |
Массовая доля гидропероксида, % |
|
1 |
0,2048 |
4,2 |
14,3 |
|
2 |
0,1679 |
4,8 |
20,0 |
|
3 |
0,2146 |
6,8 |
22,4 |
|
4 |
0,2334 |
7,3 |
22,2 |
На рисунке 1 построена кривая накопления гидропероксида изопропилбензола.
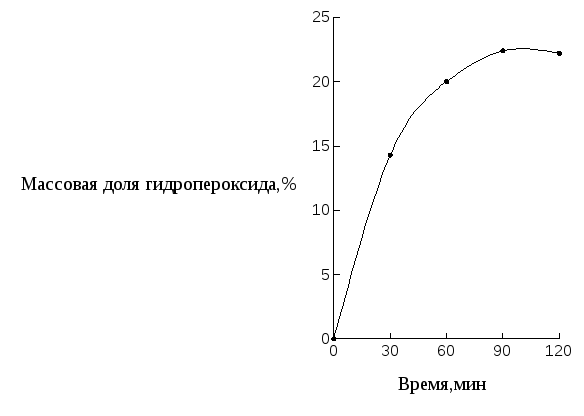
Рисунок 1 − Кривая накопления гидропероксида изопропилбензола
1.4 Выводы
1) Изучили процесс каталитического окисления ИПБ в присутствии катализатора резината марганца и добавки Na2C03 при температуре реакции 110 °С.
2) За 2 часа реакции содержание гидропероксида изопропилбензола в оксидате достигло 22,2 %.
3) Построили кривую накопления гидропероксида изопропилбензола. Данная кривая представлена на рисунке 1.
2 Получение фенола и ацетона кислотным разложением гидропероксида изопропилбензола
2.1 Теоретическое обоснование к процессу
Механизм реакции кислотного разложения алкилароматических гидропероксидов:
H+
C6H5-C(CH3)2-OOH ↔ C6H5-C(CH3)2-OO+H2 ↔ C6H5-C(CH3)2-O+,
H2O
 C6H5-C(CH3)2-O+
→ C6H5-O-C+(CH3)2
→ C6H5-O-C(CH3)2
→
C6H5-C(CH3)2-O+
→ C6H5-O-C+(CH3)2
→ C6H5-O-C(CH3)2
→
+OH2
 OH
OH
 →
C6H5-O+-C(CH3)2
→ C6H5OH
+ (CH3)2CO
+ H+
→
C6H5-O+-C(CH3)2
→ C6H5OH
+ (CH3)2CO
+ H+
H
Для разложения гидропероксидов могут быть использованы и гетерогенные катализаторы: кислые глины, кремнийцирконовые катиониты КУ-2, КУ-23.
Реакцию кислотного разложения гидропероксидов рекомендуется проводить при температуре от 30 °С до 70 °С, лучше от 45 °С до 55 °С, поскольку в этих условиях обеспечивается достаточно высокая скорость процесса и высокий выход целевых продуктов.
Реакция кислотного разложения гидропероксидов относится к экзотермическим процессам (тепловой эффект 308 кДж/моль), что делает необходимым интенсивный отвод тепла и исключение местных перегревов, которые способствуют развитию неблагоприятных побочных процессов. Поэтому разложение гидропероксидов проводят в разбавителях. На промышленных установках в качестве разбавителя используется реакционная масса, полученная при разложении, что приводит к увеличению длительности пребывания фенола в зоне реакции и снижению его выхода [1].
Цель работы: проведение разложения гидропероксида изопропилбензола (гипериза), определение ацетона и фенола в полученной реакционной массе, составление материального баланса и расчёт безразмерных характеристик процесса.
2.2 Экспериментальная часть
2.2.1 Условия проведения эксперимента
Температура 35-40 °С.
Массовая доля гидропероксида изопропилбензола 30,7 %.
Время реакции 0,5 ч.
2.2.2 Характеристика сырья и материалов
В таблице 4 представлены физико-химические свойства веществ [2].
Таблица 4 − Физико-химические свойства исходных веществ и продуктов реакции
|
Вещество |
Молярная масса, г/моль |
Плотность, г/см3 |
Температура кипения, °С |
|
Гипериз |
152,19 |
1,062 |
49,5-51 |
|
О-ксилол |
106,16 |
0,881 |
144,41 |
|
Фенол |
94,11 |
1,071 |
182,00 |
|
Ацетон |
58,08 |
0,792 |
56,20 |
2.2.3 Методика разложения гидропероксида изопропилбензола в присутствии серной кислоты

