
- •Введение
- •1 Получение карбонильных соединений каталитическим дегидрированием спиртов
- •3.1 Теоретические основы процесса дегидрирования спиртов
- •2 Экспериментальная часть
- •2.1 Характеристика сырья и материалов
- •2.2 Проведение контактирования
- •3 Методики анализов
- •3.1 Определение спиртов методом ацетилирования
- •3.2 Потенциометрический метод титрования. Определение карбонильных соединений на основе реакции оксимирования
- •3.2.1 Теоретические основы метода
- •3.2.2 Ход анализа
- •3.3 Определение сложных эфиров методом омыления
- •4 Материальный баланс процесса дегидрирования н-бутилового спирта
- •5 Расчёт безразмерных характеристик процесса дегидрирования н‑бутилового спирта. Результаты и их обсуждение
- •1 − Трехгорлая колба (реактор); 2 − штатив; 3 − водяная баня;
- •4 − Мешалка; 5 − термометр; 6 − электродвигатель;
- •7 − Обратный холодильник;
- •3.2.4 Расчёт количества зубчиков для подачи н-бутилового спирта на микродозаторе Галкина
1 − Трехгорлая колба (реактор); 2 − штатив; 3 − водяная баня;
4 − Мешалка; 5 − термометр; 6 − электродвигатель;
7 − Обратный холодильник;
Рисунок 2 − Схема установки кислотного разложения
гидропероксида изопропилбензола в присутствии серной кислоты
Реакция осуществляется в трехгорлой колбе, снабжённой мешалкой, обратным холодильником, капельной воронкой и термометром. Постоянная температура во время реакции от 35 до 40 °С поддерживается с помощью водяной бани. Разложению подвергается раствор гидропероксида в изопропилбензоле с массовой долей не более 30 % до остаточной массовой доли гидропероксида не более 1 %.
Вносим в реактор 20 см3 о-ксилола и 0,5 см3 серной кислоты, заливаем в капельную воронку реакционную массу. Включаем воду на обратный холодильник, помещаем колбу в предварительно нагретую до 35 °С водяную баню и включаем мешалку.
При достижении в колбе температуры 35 °С медленно прикапываем раствор гидропероксида из капельной воронки с тем, чтобы температура не превышала 40 °С.
Перед началом опыта и через 30 минут произвести отбор проб на содержание гидропероксида через боковой отвод при остановленной мешалке. Проба отбирается массой от 0,2 до 0,5 г в предварительно взвешенную на аналитических весах колбу [1].
2.3 Обобщение и оценка результатов
Масса исходной смеси 19,94 г.
Содержание гидропероксида в смеси 30,7 %.
Масса гидропероксида в исходной смеси:
mгип = 19,94·0,307 = 6,12 г.
Количество гидропероксида в исходной смеси:
 моль.
моль.
2.3.1 Определение ацетона в реакционной смеси
Реакционная смесь содержит ацетон и фенол. Так как ацетон мешает определению фенола бромированием, то предварительно он отгоняется с водяным паром из подщелоченной реакционной смеси.
Анализ проводится по методике [1 с. 35-36].
В круглодонную колбу на 250 см3 берут массу от 2,5 до 3,0 г реакционной смеси, приливают 25 см3 NaOH массовой долей 10 % и 120 см3 дистиллированной воды, и присоединяют к шариковому холодильнику. Коническую колбу на 150 см3 , содержащую 25 см3 раствора c(NH2OH·HCl) = 1 моль/дм3 и несколько капель индикатора бромфенолового синего, ставят под аллонж так, чтобы его конец опускался в жидкость. Содержимое круглодонной колбы нагревают до кипения и ведут отгонку ацетона с водяным паром в течение от 20 до 25 минут после начала кипения. По окончании отгонки содержимое приемника оттитровывают раствором с(КОН) = 0,1 моль/дм3 до изменения цвета от желтого до синего.
Предварительно оттитровывают холостую пробу без анализируемой реакционной смеси для определения кислотности исходного раствора гидроксиламина солянокислого.
Расчёт содержания ацетона ведут по формуле:
 ,
,
где W − массовая доля ацетона, %;
Vа − объём раствора NaOH с концентрацией c(NaOH) = 0,1 моль/дм3, пошедший на титрование анализируемой пробы, см3;
Vв − объём раствора NaOH с концентрацией c(NaOH) = 0,1 моль/дм3, пошедший на титрование холостой пробы, см3;
t − титр раствора NaOH с концентрацией c(NaOH) = 0,1 моль/дм3 (1,0123);
с − количество ацетона, соответствующее 1 см3 раствора NaOH с концентрацией c(NaOH) = 0,1 моль/дм3, г/см3 (0,0058);
g − масса анализируемой смеси, г.
Масса анализируемой смеси 2,58 г.
Объём раствора NaOH с концентрацией c(NaOH) = 0,1 моль/дм3, пошедший на титрование холостой пробы равен 0,4 см3.
Объём раствора NaOH с концентрацией c(NaOH) = 0,1 моль/дм3, пошедший на титрование анализируемой пробы равен 18,7 см3.
 %.
%.
Масса о-ксилола:
mо-кс = Vо-кс · ρо-кс = 20 · 0,881 = 17,62 г.
Масса ацетона:
 г.
г.
2.3.2 Определение фенола в реакционной смеси
Анализ проводится по методике [1 с. 36-38].
Определение фенола в подщелоченной реакционной смеси, оставшейся после отгонки ацетона, основано на реакции бромирования избытком брома. Бром получают при подкислении бромид-бромата калия:
5КВг + KBrO3 + 6НСI → ЗВг2 + 6КС1 + ЗН20 ;
СбН5-ОН + ЗВг2 → Br3-C6H2-ОН + ЗНВг .
Непрореагировавший бром определяется йодометрически:
Br2 + 2KI → 2KBr + I2 ;
I2 + 2Na2S203 → Na2S406 + 2NaI .
Остаток после отгонки ацетона охлаждается и количественно переносят в мерную колбу на 250 см3, содержимое колбы доводят дисиллированной водой до метки и перемешивают. Берут пипеткой 10 см3 этого раствора и помещают в коническую колбу на 250 см3, затем приливают 50 см3 водного раствора бромид-бромата калия и 6 см3 концентрированной соляной кислоты. Закрыв колбу пробкой, тщательно перемешивают ее содержимое и оставляют на 30 минут при комнатной температуре. После этого приливают 15 см3 раствора KI, снова энергично перемешивают и оттитровывают выделившийся йод раствором гипосульфита в присутствии раствора крахмала. В тех же условиях проводят холостой опыт, но вместо анализируемой фенольной воды берут такое же количество дистиллированной воды.
Расчёт содержания фенола ведут по формуле:
 ,
,
где W − массовая доля фенола, %;
Vа − объём раствора тиосульфата натрия, пошедший на титрование холостой пробы, см3;
Vв − объём раствора тиосульфата натрия, пошедший на титрование анализируемой пробы, см3;
t − титр раствора тиосульфата натрия (0,9607);
g − масса анализируемой смеси, взятой на анализ, г;
0,0016 − масса фенола, соответствующая 1 см3 раствора тиосульфата натрия, г/см3.
Масса анализируемой пробы 2,58 г.
Объём тиосульфата натрия, пошедший на титрование анализируемой пробы равен 23,0 см3.
Объём тиосульфата натрия, пошедший на титрование холостой пробы равен 29,5 см3.
 %.
%.
Масса фенола:
 г.
г.
2.3.3 Материальный баланс процесса
Таблица 5 − Материальный баланс процесса кислотного разложения гипериза при температуре 35 оС, катализатор H2S04
|
Соединение |
М, г/моль |
Взято |
Получено | |||
|
m, г |
моль |
m, г |
моль | |||
|
Гипериз |
152,19 |
6,12 |
0,040 |
- |
- | |
|
О-ксилол |
106,16 |
31,44 |
0,296 |
31,44 |
0,296 | |
|
Фенол |
94,11 |
- |
- |
3,04 |
0,0323 | |
|
Ацетон |
58,08 |
- |
- |
1,31 |
0,0226 | |
|
Потери |
- |
- |
- |
1,77 |
- | |
|
Всего |
- |
37,56 |
0,336 |
37,56 |
- | |
2.3.4 Расчёт безразмерных характеристик процесса
Степень превращения гипериза:
 %.
%.
Выход ацетона:
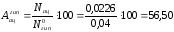 %.
%.
Выход фенола:
 %.
%.
Селективность:
 %;
%;
 %.
%.
Теоретические расходные коэффициенты:
 т
гипериза/т ацетона;
т
гипериза/т ацетона;
 т
гипериза/т фенола.
т
гипериза/т фенола.
Практические расходные коэффициенты:
 т
гипериза/т ацетона;
т
гипериза/т ацетона;
 т
гипериза/т фенола.
т
гипериза/т фенола.
2.4 Выводы
1) Изучили процесс кислотного разложения гипериза в присутствии серной кислоты.
2) Определили содержание ацетона и фенола в полученной реакционной смеси. Составили материальный баланс процесса, который представлен в таблице 5.
3) Конверсия гипериза составила 100,0 %, выход ацетона 56,50 %, выход фенола 80,75 %.
4) Рассчитали практические и теоретические расходные коэффициенты. Данные величины представлены в пункте 2.3.4.
3.4 Выводы:
1) Изучили реакцию каталитического дегидрирования н-пропилового спирта при t = 450 °С в присутствии катализатора К-24 при объемной скорости подачи 1,0 ч-1.
2) Составили материальный баланс процесса дегидрирования н-пропилового спирта. Материальный баланс представлен в таблице 9.
3)
Получили выход целевого продукта
пропаналя %,
а селективность
%,
а селективность
 %.
%.
Заключение
1) Изучили процесс каталитического окисления ИПБ в присутствии катализатора резината марганца и добавки Na2CО3 при температуре реакции 110 °С.
2) За 2 часа реакции содержание гидропероксида изопропилбензола в оксидате достигло 22,2 %.
3) Построили кривую накопления гидропероксида изопропитбензола. Данная кривая представлена на рисунке 1.
4) Изучили процесс кислотного разложения гипериза в присутствии серной кислоты.
5) Определили содержание ацетона и фенола в полученной реакционной смеси. Составили материальный баланс процесса, который представлен в таблице 5.
6) Конверсия гипериза составила 100 %, выход ацетона 56,5 %, выход фенола 80,75 %.
7) Рассчитали практические и теоретические расходные коэффициенты. Данные величины представлены в пункте 2.3.4.
8) Изучили реакцию каталитического дегидрирования н-пропилового спирта при t = 450 °С в присутствии катализатора К-24 при объемной скорости подачи 1,0 ч-1.
9) Составили материальный баланс процесса дегидрирования н-пропиловогоспирта. Материальный баланс представлен в таблице 9.
10)
Получили выход пропаналя %,
а селективность
%,
а селективность
 %.
%.
Список использованных источников
1 Тепеницина, Е. П. Химическая технология органических веществ. − − Ярославль.: ЯПИ, 1993. − 132 с.
2 Гороновский, Н. Т. Краткий справочник по химии / Н. Т. Гороновский, Ю. П. Назаренко, Е. Ф. Некряч. − Киев.: Наукова думка, 1974. − 992 с.
