
- •АЛКИНЫ
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины
- •Алкины

Алкины
Кислотность алкинов
Водород группы ≡С–Н имеет небольшой положительный заряд, поэтому можно говорить о его ”кислотности“.
Электроотрицательность Csp3 < Csp2 < N < Csp
Константы кислотности некоторых соединений
Вещество |
CH3COOH H2O C2H5OH |
HC≡CH |
NH3 |
H2C=CH2 CH4 |
||
pKa |
5,0 |
15,7 18,0 |
25,0 |
36,0 |
36,5 |
40,0 |
21

Алкины
Кислотность алкинов
Кислотные свойства ацетилена и других алкинов с концевой тройной связью могут проявляться в жидком аммиаке. При действии очень сильных оснований они образуют соли – ацетилениды, в которых связь металл-углерод ионная.
H3C C CH |
|
+ |
NH3 (ж) |
+ |
+ NH3 |
+ |
NaNH2 |
|
H3C C C Na |
||
Более сильная |
|
Более сильное |
Более слабое |
Более слабая |
|
кислота |
|
основание |
|
основание |
кислота |
22
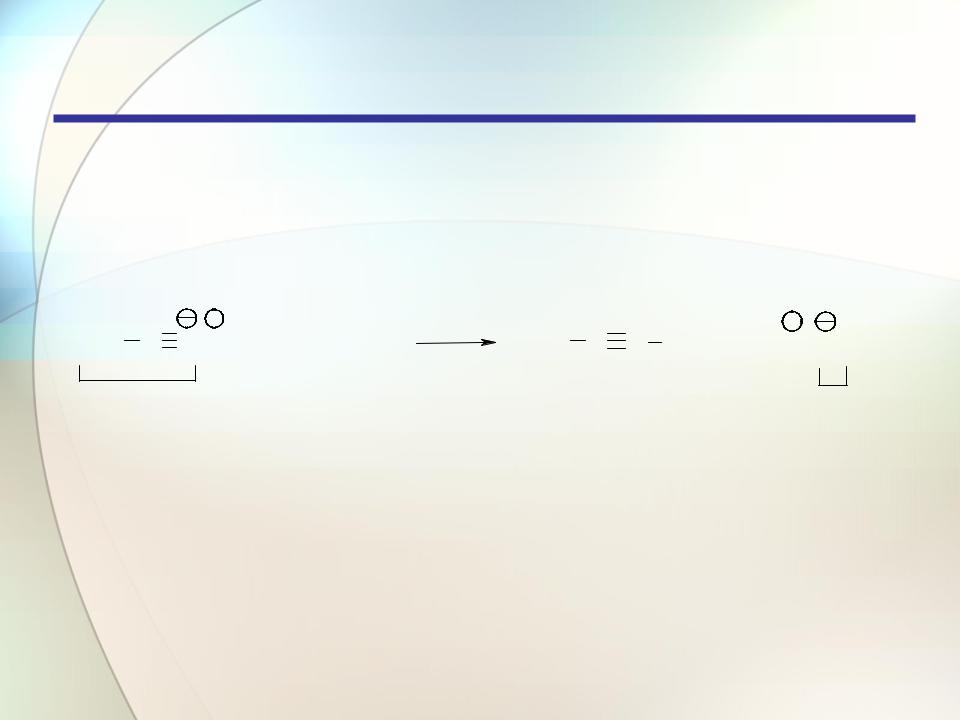
Алкины
Кислотность алкинов
Ацетилениды щелочных металлов гидролизуются водой.
+ |
+ H2O |
H3C C C H |
|
+ |
H3C C C Na |
+ |
NaOH |
||
Более сильное |
Более сильная |
Более слабая |
|
Более слабое |
основание |
кислота |
кислота |
|
основание |
23

Алкины
Кислотность алкинов
H C C H + 2Ag1+(NH3)2OH1-
C H + 2Ag1+(NH3)2OH1-  Ag C
Ag C C Ag + 2NH3 + H2O
C Ag + 2NH3 + H2O
Ацетиленид
серебра
H C |
|
C |
|
C |
|
H |
+ Cu1+(NH3)2OH1- |
|
H C |
|
C |
|
C |
|
Cu |
+2NH |
3 |
+ H O |
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|||||||||||||
3 |
|
|
|
|
|
|
|
|
3Пропинид |
|
2 |
|||||||
меди
Реакция Иоцича
R-C  C-H + C2H5MgBr
C-H + C2H5MgBr  C2H6 + R-C
C2H6 + R-C  C-MgBr
C-MgBr
24
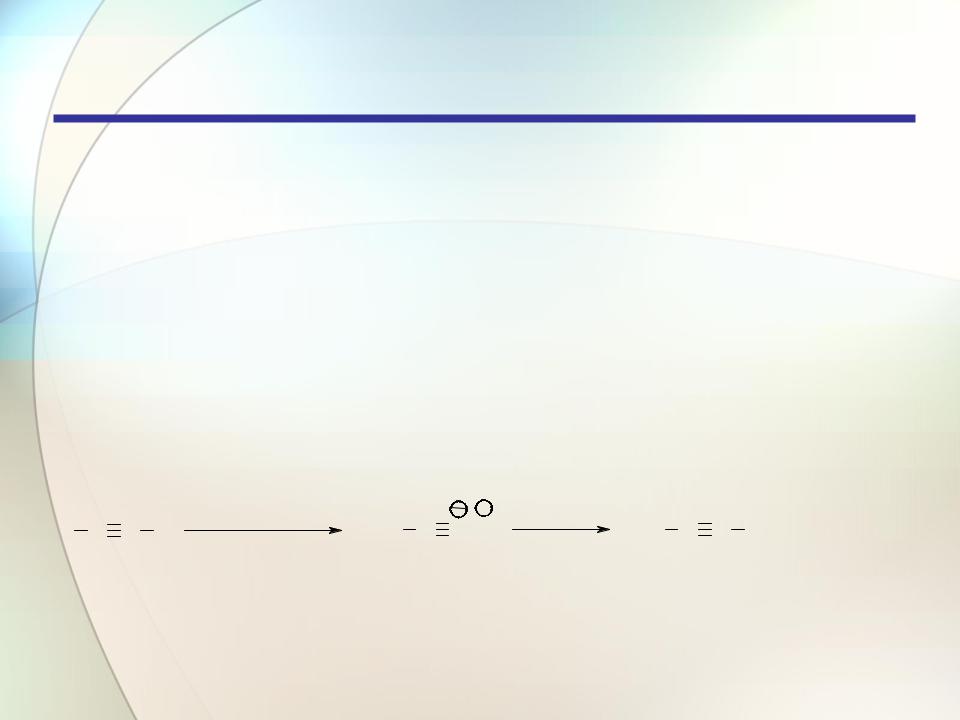
Алкины
Кислотность алкинов
Ацетилениды Ag и Cu – ковалентные соединения Ацетилениды щелочных металлов – ионные соединения
Соли алкинов сильные нуклеофилы. Их используют для получения алкинов сложного строения
H3C C C H |
NaNH2, NH3(ж) |
+ |
н- C4H9Br |
H3C |
C C C4H9-н +NaBr |
-NH3 |
H3C C C Na |
SN |
|||
|
Пропинид |
|
2-гептин |
||
|
|
натрия |
|
|
|
25
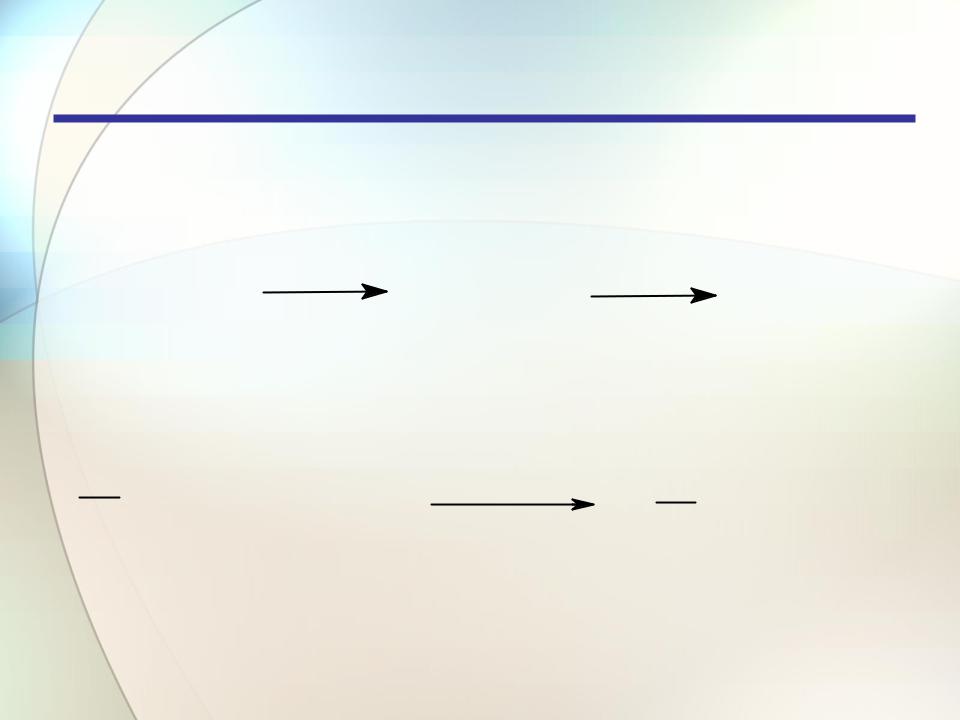
Алкины
Химические свойства
Гидрирование
|
|
|
H2 (Pt) |
|
|
|
H (Pt) |
|
|
|
HC |
|
CH |
|
H2C |
|
CH2 |
2 |
CH3 |
|
CH3 |
|
|
|
|
|
||||||
|
|
|
||||||||
|
|
|
|
|
||||||
|
|
|
|
|||||||
|
|
|
||||||||
ацетилен |
|
этилен |
|
этан |
||||||
R1 |
C |
|
C |
|
R2 + H2 |
|
Pd+Pb/K2CO3R1 |
CH |
|
CH |
|
R2 |
|
||||||||||||
|
|
|
|
|||||||||
|
|
|||||||||||
|
|
|
|
|
||||||||
|
|
|
|
26

Алкины
Реакции электрофильного присоединения AdE Галогенирование
Алкины, как и алкены, имеют доступные для атаки
-электроны и вступают в реакции электрофильного присоединения. Но из-за повышенной электроотрицательности sp-гибриди-зованных атомов углерода и укороченности связей поляризуемость
-электронов тройной связи С С уменьшена, поэтому
тройная углерод-углеродная связь по сравнению с двойной связью С С менее реакционноспособна в отношении
электрофильных реагентов.
27

Алкины
Реакции электрофильного присоединения AdE
Галогенирование
28

Алкины
Реакции электрофильного присоединения AdE Гидрогалогенирование
Правило Марковникова
29
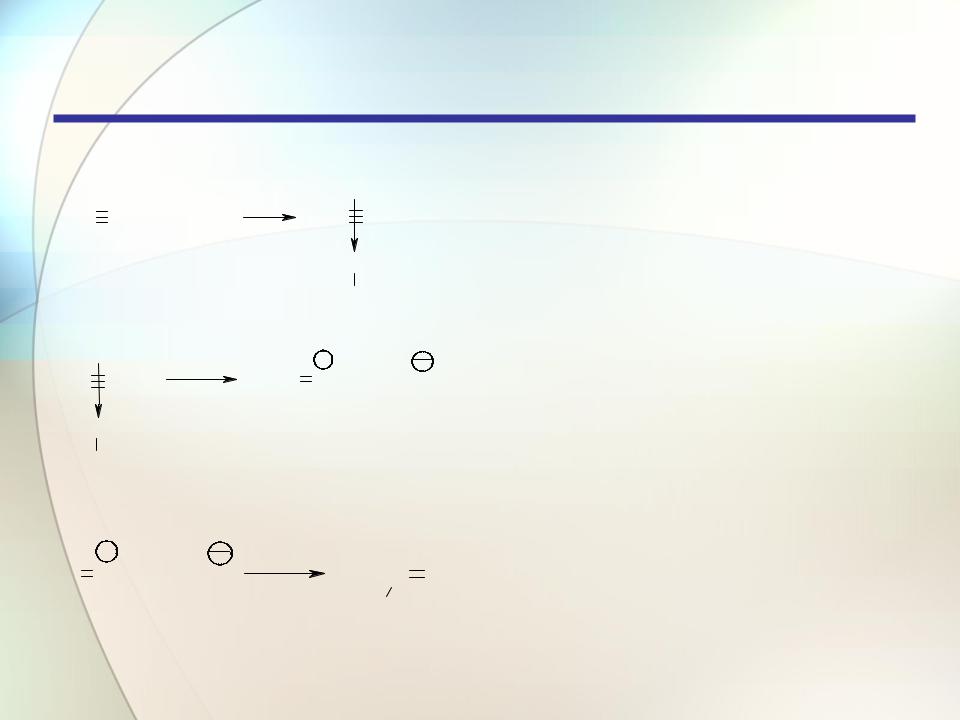
Алкины
Гидрогалогенирование
HC CH + HBr |
HC CH |
|
|
H |
Низкая устойчивость |
|
Br |
|
|
-êî ì ï ëåêñ |
винильного |
|
+ |
катиона – результат |
HC CH м едлен н о |
H2C CH + Br |
отсутствия факторов, |
H |
|
стабилизирующих его |
Br |
|
|
+ |
+ Br |
HC CH2 |
H2C CH |
||
|
|
Br |
30
