
1.1. Функциональные и аналитико-активные группы
Функциональными группами органических соединений называют реакционноспособные группы атомов (или отдельные атомы). Известно около ста функциональных групп. Различают функциональные группы (ФГ) содержащие кислород: гидроксильная -ОН, карбонильная >С=0, карбоксильная -СООН и др.; содержащие азот: аминогруппа, соответственно первичная -NH2, вторичная =NH, третичная =N-, нитрогруппа -NO2, нитрозогруппа -NO и др.; содержащие серу: сульфгидрильная-SH, сульфидная -S-, дисульфидная -S-S-, сульфоксидная >S=0 и др.; содержащие ненасыщенные углерод-углеродные связи: -СН=СН- и др.; прочие функциональные группы: винильная СН2=СН-, фенольная –C6H4OH и т. д. Функциональность органических соединений характеризуется строением и числом ФГ в молекуле.
Для аналитической химии наибольший интерес представляют протонодонорные группы (-СООН, -SO3H), протоноакцепторные (-NH2, =NH), хромофорные (-N=N-), комплексообразующие группы (содержат гетероатомы, т. е. атомы-доноры электронных пар; обычно это атомы N, О, Р, S, реже As, Se, Те). Такие функциональные группы называют функциональными аналитическими группами (ФАГ).
Например. 1) В молекуле диметилглиоксима (ОАР на ионы Ni2+)
![]()

Следовательно, благодаря наличию данной ФАГ в молекуле, диметилглиоксим является избирательным реагентом для осаждения ионов никеля.
2) ФАГ на ион кобальта является группировка атомов
![]()
присутствующая в 1-нитрозо-2-нафтоле, с помощью которого можно количественно осадить кобальт в присутствии никеля:

Если в молекуле ОАР присутствуют несколько ФГ, вводят понятие «аналитико-активной группы» (ААГ). ААГ является заместитель, влияющий на электронное строение ФАГ, реакционную способность которой рассматривают. Эффективность введенной ААГ зависит от ее электроотрицательности и положения в структуре ОАР по отношению к ФАГ. При введении в молекулу ОАР объемных ААГ в непосредственной близости от ФАГ могут проявиться и стереохимические затруднения. Механизм влияния ААГ объясняется изменением электронной плотности на донорных атомах ФАГ или изменением стереохимии реакции.
Например. 1) Если в качестве ААГ выступает винил СН2=СН-, то при наличии в структуре основной части молекулы ОАР двойных связей, возможно образование системы сопряженных связей.
2) ААГ является гидроксильная (-ОН) или аминогруппа (-NH2). В этом случае гетероатом (О или N) передаст одну атомную орбиталь с двумя электронами в общую р-электронпую систему молекулы ОАР.
1.2. Реакции, основанные на использовании органических аналитических реагентов
В качественном и количественном химическом анализе широко используются многие типы реакций с участием органических реагентов, содержащих различные ФАГ и ААГ.
Реакции осаждения. По сравнению с неорганическими осадителями ОАР имеют ряд преимуществ:
способствуют снижению предела обнаружения. Органический осадитель обладает большой молекулярной массой при относительно небольшом содержании осаждаемого неорганического иона, что приводит к уменьшению гравиметрического фактора. Гравиметрический фактор определяется отношением молекулярной либо атомарной, либо ионной массы определяемого вещества к молекулярной массе гравиметрической формы с соответствующими стехиометрическими коэффициентами;
регулируя рН можно порой достичь не только селективного, но и специфического осаждения ионов;
образуются негигроскопичные осадки. ОАР-осадители подразделяют на две группы.

Часто растворимость образовавшихся комплексных соединений зависит от рН среды.


2) Диметилглиоксим (реактив Чугаева) в кислой среде осаждает только ионы Pd2+; в аммиачной среде с ионами Ni2+ образует осадок розового цвета, а с ионами Fe2+ — соединение темно-красного цвета; при рН 11 осаждает ионы Bi3+.
Вторую группу составляют солеобразующие реагенты, при участии которых выпадают в осадок малорастворимые комплексы с ионной связью (между неорганическим ионом и ОАР). Это тетрафенилборат натрия NaB (C6H5)4 — реагент на ионы NH4+, K+, Rb+ Cs+; бензидин, осаждающий сульфат-ионы в кислой среде в виде:

Реакции образования окрашенных комплексов. Важной характеристикой комплексообразующих ОАР является избирательность реакций. Количественно избирательность реакций оценивается отношением констант устойчивости комплексов соответствующих металлов. Устойчивость комплексов металлов с органическими лигандами, в свою очередь, зависит от природы металла и донорных атомов лигандов. В химическом анализе используют не только осаждение окрашенных комплексов, но и образование окрашенных комплексных соединений в результате адсорбции реагента на поверхности осадка. За счет комплексообразования изменяется электронная структура ФАГ органического реагента, что влечет за собой изменение области поглощения света.

Данная реакция позволяет определить в присутствии ионов стронция 0,25мкг ионов бария.

Усиление интенсивности окраски в присутствии хромофорных групп возможно при наличии так называемых ауксохромных групп атомов (-ОН-, -NH2, -0-CH3 и др.).
Окислительно-восстановительные
реакции. Для
качественного и количественного
определения неорганических ионов-окислителей
(NО3-,
NО2-,
ClО3-,
MnО4-
и др.) в аналитической химии нередко
используют ОАР, обладающие
окислительно-восстановительными
свойствами. При комбинировании
окислительно-восстановительной пары
и определении возможности протекания
редокс-реакции пользуются значениями
стандартных окислительно-восстановительных
потенциалов ОАР (![]() )
и определяемых неорганических ионов
(
)
и определяемых неорганических ионов
(![]() ).
).
В ходе аналитической
реакции определяемый ион-окислитель
будет восстанавливаться, а ОАР окисляться
при условии, если (![]() )
> (
)
> (![]() ), в противном случае ОАР будет
восстанавливаться.
), в противном случае ОАР будет
восстанавливаться.
Например. Бесцветный дифениламин (C6H5)2NH в кислой среде окисляется ионами NО3- до хиноидного соединения темно-синего цвета:

Аналогично с дифениламином реагируют и другие ионы-окислители.
Реакции, характерные только для органических реагентов. В аналитической химии, в зависимости от цели исследования, находят применение разные типы реакций.
Например. 1) Определение ионов NО2- в дождевой воде (в грозовых рязря-дах происходит превращение свободного азота в нитрит-анионы) основано на проведении реакции диазотирования с нитрит-ионами с последующим применением реакции сочетания, в результате которой из соли диазония получается интенсивно окрашенное соединение:
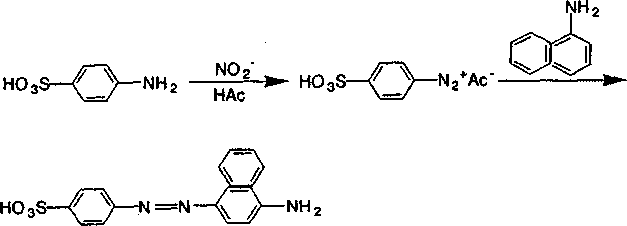
2) Качественной реакцией на ацетат-ионы является реакция этерификации.
В присутствии серной кислоты уксусная кислота и ее соли под действием спиртов образуют сложные эфиры с характерным запахом эссенций.
