
- •Билеты по химии
- •11.Классификация химических реакций в неорганической химии
- •14.Обратимость химических реакций
- •15. Электролитическая диссоциация
- •Вопрос 17: Обратимые и необратимые химические реакции.
- •Вопрос 18: Реакции ионного обмена______________________
- •Вопрос 19: Сущность окислительно-восстановительных реакций.
- •Вопрос 20: Составление окислительно-восстановительных реакций методом электронного___________.
- •Вопрос 21: Гидролиз солей.
- •Вопрос 22:
- •Неорганические вещества, содержащие углерод:
- •Вопрос 25:
- •Вопрос 28: Металлы, их положение в периодической системе химических элементов д.И. Менделеева, строение их атомов, металлические связи. Общие химические свойства металлов.
- •I. Реакции с неметаллами
- •II. Реакции с кислотами
- •III. Взаимодействие с водой
- •Вопрос 29: Кислород. Физические свойства, распространение кислорода в природе. Физиологическое значение кислорода. Его роль в жизни и применение.
- •31) Классификация органических соединений.
- •32) Основные положения теории химического строения а.М.Бутлерова. Химическое строение как порядок соединения и взаимного влияния атомов в молекулах. Основные направления развития данной теории.
- •33) Изомерия органических соединений, ее виды.
- •34) Предельные углеводороды. Гомологический ряд, химические свойства алканов.
- •35) Применение и способы получения алканов.
- •36) Механизм реакции замещения на примере предельных углеводородов. Практическое значение предельных углеводородов.
- •37) Нефть, ее свойства и состав. Продукты фракционной перегонки нефти. Охрана окружающей среды при нефтепереработке и транспортировке нефтепродуктов.
- •38) Циклопарафины, их химическое состояние, свойства, нахождение в природе, практическое значение.
- •39) Непредельные углеводороды ряда этилена, общая формула и химические свойства. Применение этиленовых углеводородов в медицине.
- •40) Механизм реакции присоединения на примере непредельных углеводородов ряда этилена. Правило Марковникова. Применение этиленовых углеводородов в органическом синтезе.
- •Вопрос 41
- •Вопрос 42
- •Вопрос 43
- •Вопрос 44
- •Вопрос 46
- •Вопрос 48
- •Лабораторные методы получения альдегидов Окислительные методы
- •Восстановительные методы
- •Синтез ароматических альдегидов
- •Вопрос 49
40) Механизм реакции присоединения на примере непредельных углеводородов ряда этилена. Правило Марковникова. Применение этиленовых углеводородов в органическом синтезе.
Рассмотрим этот механизм на примере реакции присоединения бромоводорода к молекуле этилена.

Несмотря на то, что реакция гидробромирования описывается очень простым равнением, ее механизм включает несколько стадий.
Стадия 1. На первой стадии молекула галогеноводорода образует с π-электронным облаком двойной связи неустойчивую систему – «π-комплекс» за счет частичной передачи π-электронной плотности на атом водорода, несущий частичный положительный заряд.

Стадия 2. Связь водород-галоген разрывается с образованием электрофильной частицы Н+, и нуклеофильной частицы Br-. Освободившийся электрофил Н+ присоединяется к алкену за счет электронной пары двойной связи, образуя σ-комплекс – карбокатион.

Стадия 3. На этой стадии к положительно заряженному карбокатиону присоединяется отрицательно заряженный нуклеофил с образованием конечного продукта реакции.

Правило Марковникова — в органической химии правило, используемое для предсказания региоселективности реакции присоединения протонных кислот и воды к несимметричным алкенам и алкинам. Наиболее часто данное правило формулируют следующим образом: при присоединении протонных кислот и воды к несимметричным алкенам и алкинам атом водорода присоединяется к наиболее гидрогенизированному атому углерода. Впервые правило было предложено русским химиком В. В. Марковниковым в 1869 году
.

Реакция протекает в две стадии. На первой, медленной стадии происходит присоединение протона H+ к двойной связи: при этом протон может связываться с одним из двух атомов углерода, образующих двойную связь. Образующиеся карбокатионы И1 и И2 имеют различную энергию (устойчивость), поскольку положительный заряд в них делокализуется с разной эффективностью. По этой причине вторичный карбокатион И2 является более устойчивым, и соответствующий ему бромид П2 образуется в большем количестве.
При
более строгом рассмотрении необходимо
сравнивать устойчивости не интермедиатов,
а двух альтернативных переходных
состояний на стадии образования
карбокатионов, то есть энергии активации
двух параллельных процессов. Для
некоторых реакций различие этих величин
достигает 25—30 кДж/моль.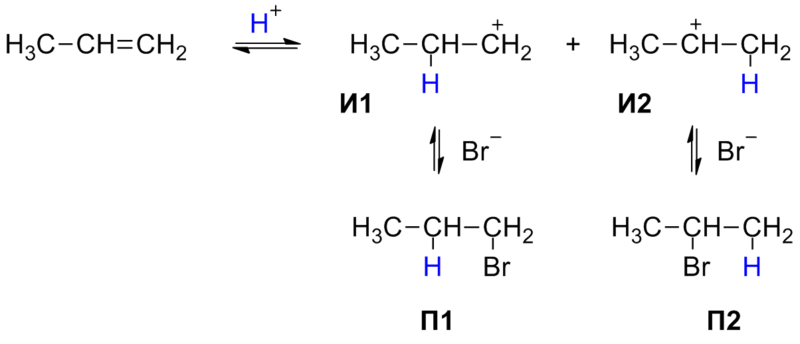
Благодаря высокой химической активности углеводороды ряда этилена являются ценным сырьем для синтеза многих органических веществ.
Вопрос 41
Алкадиены — класс углеводородов, содержащих две двойных связи углерод-углерод
В зависимости от взаимного расположения двойных связей, диены подразделяются на три группы:
сопряженные диены, в которых двойные связи разделены одинарной (1,3-диены)
аллены с кумулированными двойными связями (1,2-диены)
диены с изолированными двойными связями, в которых двойные связи разделены несколькими одинарными.
Обычно к диенам относят ациклические и циклические образующие гомологические ряды общих формул и соответственно, ациклические диены являются структурными изомерами алкинов.
Получение:
Синтез Лебедева:
2CH3-CH2-OH --Al2O3, ZnO, t--> CH2=CH-CH=CH2 + 2H2O + H2
Формально эту реакцию можно представить как дегидратацию двух молекул этилового спирта с одновременным межмолекулярным дегидрированием.
Элиминирование галогенопроизводных алканов спиртовым раствором щёлочи:
CH2Br-CH2-CH2-CH2Br + KOH → CH2=CH-CH=CH2 + 2KBr + 2H2O
Применение:
Для синтеза каучуков. В результате реакции полимеризации соответствующих мономеров.
