
- •Введение
- •Теоретическое введение
- •Лабораторная установка и метод измерений
- •Контрольные вопросы
- •Теоретическое введение
- •Контрольные вопросы
- •Теоретическое введение
- •Контрольные вопросы
- •Теоретическое введение
- •Описание установки и метода измерений
- •Порядок выполнения работы:
- •Контрольные вопросы
- •Теоретическое введение
- •Описание установки и метода измерений
- •Контрольные вопросы
- •Теоретическое ведение
- •Контрольные вопросы
- •Литература
- •Содержание
Описание установки и метода измерений
Схема установки изображена на рисунке 1

Рисунок 1
При подготовке к работе следует познакомиться с элементами вакуумной техники. Т.к. для точного измерения массы воздуха пришлось бы полностью выкачать его из колбы, что невозможно (даже при давлении порядка 10-6 мм рт.ст.), которое дают высоковакуумные насосы, в каждом см3 остается более 1010 молекул газа пользуются следующим методом: определяют давление Р, объем V, температуру Т некоторой массы газа mв колбе. Это состояние определяется уравнением Менделеева-Клапейрона
![]() (2)
(2)
Затем не изменяя температуру (изотермически), откачивают часть газа из колбы. При этом масса газа становится равной m2, давление Р2. Уравнение такого состояния можно записать в виде
![]() (3)
(3)
Вычитая почленно уравнение (3) из уравнения (2), получим формулу
![]() (4)
(4)
которая позволяет вычислить молярную массу, если известны изменение массы, (а не сама масса), изменение давления, температуры и объема газа.
Порядок выполнения работы:
измеряют атмосферное давление Р1и комнатную температуру Т;
взвешивая колбу при открытом зажиме, определяю массу m1колбы и воздуха в ней при давлении Р1;
присоединяют колбу к насосу и откачивают воздух до давления Р2;
закрывают кран, отсоединяют колбу от установки и взвешивают ее, определяя массу m2колбы и воздуха в ней при давлении Р2;
по формуле
 вычисляют молярную массу
вычисляют молярную массу ;
;пункты 2-5 повторяют не менее 3-х раз;
результаты измерений заносят в таблицу;
Таблица 1.
|
№ |
Р1 |
Т |
М1 |
М2 |
|
V |
|
|
( |
|
|
|
1 2 3 |
|
|
|
|
|
|
|
|
|
|
|
|
ср |
|
|
|
|
|
|
|
|
|
|
|
абсолютную и относительную погрешности находят по формулам


где n– число измерений
окончательный результат записывают в виде:
![]()
Контрольные вопросы
1 Какой газ называется идеальным?
2 Записать уравнение Менделеева-Клапейрона.
3 В чем заключается физический смысл универсальной газовой постоянной R?
4 Что показывает молярная масса газа?
5 Что показывает отношение
![]() ?
?
6 Что выражает число Авагадро?
Лабораторная работа №28 Определение постоянной Больцмана
Цель работы: экспериментальное определение постоянной Больцмана К.
Оборудование: сосуд,U– образный манометр, шприц, распыляемая в воздухе жидкость.
Теоретическое ведение
Молекулярно-кинетическая теория утверждает, что давление идеального газа в сосуде равно 2/3 средней кинетической энергии молекул, содержащихся в единице объеме
 (1)
(1)
где Р – давление газа; n– число молекул в единице объема;m0– масса одной молекулы; <![]() >
– средняя квадратичная скорость
молекулы.
>
– средняя квадратичная скорость
молекулы.
Умножая обе части уравнения на молярный
объем газа
![]() ,
получаем
,
получаем
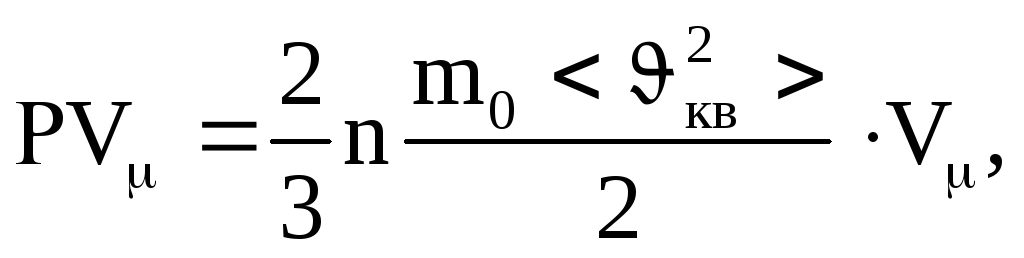 ,
,
где
![]() – число молекул газа в одном моле и
называется числом Авагадро. Таким
образом
– число молекул газа в одном моле и
называется числом Авагадро. Таким
образом
 (2)
(2)
С другой стороны, уравнение состояния идеального газа для одного моля записывается в виде
![]() (3)
(3)
Приравнивая правые части (2) и (3), получаем
 (4)
(4)
Обозначим К=![]() ;
тогда
;
тогда
 (5)
(5)
С учетом (5) уравнение (1) принимает вид
![]() (6)
(6)
Обратим внимание на особенности уравнения (6). Из него следует, что давление газа не зависит от рода газа, а лишь от его концентрации n. Поэтому его можно применять в равной степени и к чистым газам, и к смесям химически чистых газов (паров).
В случае смеси газов под Р понимают
сумму давлений, создаваемых отдельными
газами в данном объеме, т.е.
![]() ,
где Рi– парциальное
давление;i– компонента
смеси газов.
,
где Рi– парциальное
давление;i– компонента
смеси газов.
Зная давление Р, концентрацию и температуру газа Т, можно определить коэффициент КБ, который и называется постоянной Больцмана.
Для экспериментального определения
КБв работе используется сосуд,
в который впрыскивает легко испаряемая
жидкость. Пары этой жидкости создают
дополнительное давление![]() в сосуде, которое измеряется водным
манометром. Уравнение (6) для испарившейся
жидкости в сосуде запишется в виде
в сосуде, которое измеряется водным
манометром. Уравнение (6) для испарившейся
жидкости в сосуде запишется в виде
![]() (7)
(7)
где N– число молекул испарившейся жидкости;VC– объем сосуда.
Nопределим по формуле
![]() (8)
(8)
где
![]() –
масса испарившейся жидкости;
–
масса испарившейся жидкости;![]() –
ее плотность;V– объем
впрыснутой жидкости; М – молярная масса
впрыснутой жидкости.
–
ее плотность;V– объем
впрыснутой жидкости; М – молярная масса
впрыснутой жидкости.
С учетом (8) уравнение (7) приводится к виду
![]() (9)
(9)
Из формулы (9) получаем расчетную формулу для К
![]() (10)
(10)
Выполнение работы:
подсоединить сосуд к водному манометру и проверить его герметичность;
записать температуру окружающей среды;
набрать в шприц от 0,5 до 1,5 мл ацетона и впрыснуть его в сосуд через соответствующее отверстие. До конца опыта шприц не вынимать из отверстия;
определить объем испаряемой жидкости по формуле:
 гдеV0– объем
ацетона в шприце,
гдеV0– объем
ацетона в шприце, ;
;подождать пока показания по манометре не будут изменяться, и сделать отсчет в миллиметрах водного столба. Избыточное давление записать в паскалях, т.е.
 где
где – плотность воды;g–
ускорение свободного падения;h– высота водного столба;
– плотность воды;g–
ускорение свободного падения;h– высота водного столба;повторить опыт еще два раза;
по формуле (10) подсчитать К и найти его среднее значение. При расчетах использовать М=58,08 г/моль,
 кг/м3,VС=22,5
л.
кг/м3,VС=22,5
л.
Таблица 1
|
№ |
|
VC,м3 |
V,м3 |
|
h, м |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
ср |
|
|
|
|
|
|
|
|
определить случайную погрешность КБпо формуле:
![]()
где
![]() – приборные погрешности при измеренииVC,V,T,h.
– приборные погрешности при измеренииVC,V,T,h.
окончательный результат записать в виде:
![]()
