
- •Расчёт количества кокса для восстановления оксидов руды при их окусковании
- •1.Цель и задачи курсовой работы
- •2.Структура и содержание расчётно-пояснительной записки
- •3. Содержание отдельных разделов курсовой работы Введение
- •Общая часть
- •Расчётная часть
- •4. Расчет количества кокса для восстановления оксидов руды
- •Расчет состава шихты для агломерации.
- •Задание для курсовой работы.
- •7. Список используемых источников.
- •Приложение а.
Расчётная часть
В расчётной части работы приводится в соответствии с индивидуальным заданием расчёт количества кокса для восстановления оксидов руды из различных рудных компонентов и восстановителей.Составляется материальный баланс.
В естественных условиях в природе металлы могут существовать лишь в окислённом состоянии, т.е. в виде рудных минералов. Поэтому, чтобы получить металл или сплав металлов нужно осуществить процесс отнятия кислорода у оксида, другими словами, осуществить восстановление оксидов металла с помощью восстановителя, вещества, которое имеет большее средство к кислороду, чем восстанавливаемый металл. Наиболее распространёнными восстановителями являются газы CO, H2, CH4 и твёрдый углеродсодержащий материал, например, кокс.
Способность к восстановлению – восстанавливаемость у разных руд различна. Наивысшей восстановимостью обладают обычно бурые железняки и сидериты. За ними в порядке уменьшения восстановимости следуют гидрогематит, гематит и магнетит.
В реальных процессах восстановление с достаточной скоростью может протекать только при высоких температурах. Источником тепла служат экзотермические реакции горения топлива, например, кокса.
Таким образом, кокс в восстановительных процессах выполняет двойную функцию: как источник тепла и как восстановитель. Отсюда и необходимость расчёта количества кокса для восстановления оксидов руды и для сжигания.
Для осуществления химической реакции необходим контакт участвующих в реакции веществ. С этой точки зрения реакции восстановления с участием твёрдого восстановителя (кокса) называют прямым восстановлением, напимер, прямое восстановление оксида Fe2O3 углеродом при прямом непосредственном их контакте происходит по реакции
3Fe2O3+C=2Fe3O4+CO
Этот процесс осложняется из-за возможности протекания как параллельных, так и последовательных реакций взаимодействия оксидов с оксидом углерода, образующимся при неполном восстановлении оксидов и при реакции горения твёрдого углерода
2C+O2=2CO
Восстановление с помощью газов – восстановителей называют косвенным восстановлением.
Природное сырье имеет сложный состав кроме: полезных компонентов оно содержит породные составляющие, различные примеси. Распределение этих компонентов в кусках весьма неоднородно. Для повышения извлечения полезного компонента рудный материал приходится дробить и измельчать до довольно мелких фракций. В результате обогащения такого материала получают концентрат крупностью несколько миллиметров, который непосредственно использовать нельзя. Нужна предварительная его подготовка, в частности, окускование. Окускование – это процесс укрепнения мелкодисперсного материала.
В настоящее время существует несколько способов окускования мелкого материала: окатывание, брикетирование, агломерация.
4. Расчет количества кокса для восстановления оксидов руды
Принимаем состав железной руды.
Таблица 1.
|
Компонент |
Fe2O3 |
Feоб |
CaO |
MgO |
SIO2 |
Al2O3 |
P2O5 |
S |
|
% масс |
83,0 |
59,1 |
5,05 |
0,85 |
9,60 |
1,30 |
0,16 |
0,04 |
Принимаем состав кокса.
Содержание углерода в горючей массе кокса Cdaf = 86%
Зала в сухой массе кокса Ad =11,5%
Летучие кокса в горючей массе кокса Vdaf =2,5%
Влага рабочая кокса Wr =10%
Здесь индекс «daf» указывает горючую массу кокса, индекс «d» относится к сухой массе кокса и индекс «r» относится к рабочей массе кокса.
Элементы шихты в соответствии с законом распределяются между продуктами восстановления, т.е. между металлом, шлаком и газом. Если оксид металла восстанавливается, то образующийся металл переходит в металлическую фазу [Me]. Если по термодинамическим условиям оксид металла не восстанавливается. Или восстанавливается не полностью, он остается в шлаковой фазе (Meo). Так как процессы окускования осуществляются при высокой т-ре, то восстановленный металл может испарятся, т.е. может переходить в газовую фазу {Meo}. Обычно коэффициенты перехода элементов в металл, шлак и газ устанавливается экспериментальным путем.
Принимаем следующие коэффициенты распределения элементов.
Таблица 2.- Распределение элементов между фазами
|
Элемент |
Переход элемента в | ||
|
Металл |
шлак |
газ | |
|
Fe |
1,00 |
0,0 |
0,0 |
|
марганец |
0,55 |
0,45 |
0,0 |
|
P |
1,0 |
0,0 |
0,0 |
|
Si |
0,10 |
0,9 |
0,0 |
|
Al |
0,0 |
1,0 |
0,0 |
|
Ca |
0,0 |
1,0 |
0,0 |
|
Mg |
0,0 |
1,0 |
0,0 |
Примечание. Оксиды CaO, SiO2, Al2O3 трудно восстановимы, поэтому они практически не восстанавливаются и остаются в исходной шихте в виде оксидов либо в твердом, либо в жидком состоянии.
Оксид железа может восстанавливаться частично, образуя по правилу Байкова фазы Fe3O4 и FeO.все оксиды железа вступают во взаимодействие с другими оксидами и могут образовывать соединение, которые имеют температуру плавления, меньше чем чистые оксиды. М-р,
2FeO * SiO2 (фаялит) с т-рой плавления 1205 оС,
CaO * 2Fe2O3 (феррит кальция) с т-рой плавления 1230 оС,
CaOx *FeO2-x *SiO2 (железокальциевый оливин) с т-рой плавления 1130 оС.
Эти соединения при высоких температурах окускования (до 1500 оС) будут находится в жидком состоянии, способствуя образованию спеков.
Составляем материальный баланс. Расчет обычно ведется на 100г руды.
По данным химического анализа (таблица 1) общее содержание железа состовляет 59,1%. Часть этого железа находится в виде Fe2O3 (83,0%). Необходимо проверить есть ли железо в виде Fe3O4 и FeO. Для этого сначала пересчитаем содержание Feоб в оксид Fe2O3. 1г-моля Fe2O3 содержит 2г-атома железа, т.е. в 160г Fe2O3 содержится 112г железа. Из пропорции получим
160г Fe2O3 – 112г Fe
X - 59,1
Отсюда
x=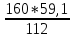 =83,0г
Fe2O3
=83,0г
Fe2O3
Вывод: все железо находится в виде Fe2O3 (% масса Fe3O4=0)
Определяем количество восстановителя (кокса) на восстановления Fe2O3. В соответствии с реакцией восстановления Fe2O3+ 3С=2Fe+3Co составляем пропорцию 1г- моль Fe2O3- 3г атома углерода
или 160г Fe2O3- 3*12=36г углерода
83г Fe2O3-Xг углерода.
В этом расчете коэффициент распределения принят 1,0 , однако при окусковании, например, агломерации железа из оксидов восстанавливается не полностью, а лишь частично степень металлизации может достигать 10-15%. Примем эту величину равной 10%. Это значит, что из 83, 0г Fe2O3 восстановиться лишь 8,3г железа. Для этого нужно 1,8675г углерода. Будем считать, что остальные 90% Fe2O3 (83,0*0,9=744г Fe2O3) будет восстанавливаться до FeO по реакции
Fe2O3+C=2 FeO+CO
Необходимое для этого кол-во углерода определяем также из пропорции:
1г-моль Fe2O3 (160г) потребует 1г- атом С(12г).
744г Fe2O3 -----------XгC.
Отсюда
XгC
=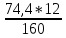 =5,58г
=5,58г
Кремнезем (SiO2) будет восстанавливаться также не полностью. Примем его коэффициент распределения равным 0,1 (см таблицу 2). Для его восстановления понадобиться углерода:
SiO2+2C= Si+2CO
1г-моль SiO2 потребует 2 г- атома С.
Или 28+32=60г SiO2 -----------2*12=24г С
9,6*0,1г SiO2----------Xг C
Отсюда
Xг
С =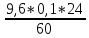 =0,384г
С,
=0,384г
С,
В этом выражение 9,6=%SiO2 (или 9,6г SiO2 d 100г руды).
В соответствие с таблицей 2 фосфор восстанавливается полностью на 100%, но так как его содержание невелико (0,16г), то расчет углерода но его восстановление можно не производить, а учесть его кол-во путем некоторого увеличения конечного результата расчета.
Всего потребуется углерода на восстановление оксидов руды
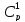 =CFe2O3
+
CSiO2
=
1,8675+5,58+0,384=7,832г.
=CFe2O3
+
CSiO2
=
1,8675+5,58+0,384=7,832г.
В качестве источника углерода используют кокс. Он представляет собой твердый пористы остаток термической переработки спекающихся каменных углей при т- ре 950-1200 оС без доступа воздуха. Кроме того, в коксе содержатся так называемые летучие компоненты или просто «летучие» летучие соединения остаточных содержаний водорода и кислорода с частью углерода (кол-во которых может достигать нескольких процентов). При нагревании до высоких температур при окусковании влага и летучие, в виде CO3, CO, и H2, выделяются из кокса и состав кокса поэтому изменяется. Изменяется и относительное содержание золы в рабочей массе кокса и содержание углерода. Поэтому необходимо предварительно рассчитать кол-во углерода в рабочей массе кокса. В этом случае расчет ведется на 100г кокса. В приложение 1 приводятся формулы пересчета содержания компонентов при изменения одной формы кокса в другую. Используем формулу:
Cr=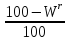 *
*
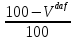 *
*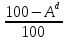 *100
*100
Cr=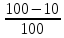 *
*
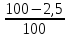 *
* * 100 =77,6%
* 100 =77,6%
Рассчитываем количество золы в рабочей массе кокса
Ar
=Ad
*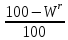 * 100 = 11,5
* 100 = 11,5
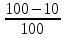 * 100 = 10,35%
* 100 = 10,35%
Таким образом, состав кокса будет следующим:
- влага рабочая Wr = 10,0%
- зала рабочая Ar = 10, 35%
- углерод в рабочей массе Cr = 77,6%
∑=97,95%. Невязка – 0,05%.
Зола кокса содержит оксиды Fe2O3 и SiO2, которые будут восстанавливаться, для чего также потребует углерод. Количество углерода, необходимое для восстановления оксидов золы Fe2O3 и SiO2, определяется аналогично п:п 4.2 и 4.3 с учетом массы золы 10,35г в 100г кокса.
CFe2O3
=
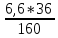 *
*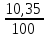 = 0,15г С
= 0,15г С
CSiO2
=
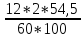 * 10,35 =2,25г
* 10,35 =2,25г
Всего на восстановление золы потребуется углерода Сзолы = 0,15+2,25=2,40г
В 100г кокса углерода будет 77,6% из этого кол-ва 2,40г пойдет на восстановление золы кокса, а оставшаяся часть 77,6-2,4 = 75,2г пойдет на восстановление оксидов руды.
Рассчитаем количество кокса, в котором содержится 75,2г углерода.
Xk
=
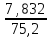 * 100 =10,42г кокса.
* 100 =10,42г кокса.
