
Содержание
Теоритические основы
Электроды в потенциометрии
Металлические электроды
Мембранные электроды
Стеклянный электрод
Стандартный водородный электрод
Методы определения концентрации в потенциометрии
Методики лабораторных исследований
1.Теоретические основы
Классификация физико-химических методов анализа
Общее число физико-химических методов довольно велико, оно составляет несколько десятков. Наибольшее практическое значение среди них имеют следующие методы:
1) электрохимические – основаны на измерении электрической проводимости, потенциалов, силы тока и других электрохимических или электрофизических параметров анализируемой системы;
2) спектральные – основаны на измерении различных эффектов взаимодействия вещества с электромагнитным излучением и какого-либо спектрального параметра (длины волны, частоты колебаний, энергии). Эта группа методов является наиболее обширной и важной по практическому значению;
3) хроматографические (разделения и анализа) – основаны на процессах адсорбции (абсорбции) и десорбции определяемого вещества. Широко используются и незаменимы при разделении близких по свойствам компонентов сложных смесей (аминокислот, моносахаридов, жирных кислот и др.). Аналитическим параметром в данном случае является положение хроматографического пика на хроматограмме.
Параметр, который измеряют инструментально и по которому в дальнейшем проводят анализ, называется аналитическим сигналом- это качественная характеристика метода. Количественной характеристикой является интенсивность аналитического сигнала.
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Важнейшее место среди физико-химических методов анализа занимает группа электрохимических методов. Их отличает доступность, специфичность – возможность определять концентрацию отдельных ионов в присутствии многих других. Электрохимические методы анализа включают в себя методы исследования и анализа, основанные на явлениях, которые протекают на электродах, находящихся в контакте с анализируемым раствором, а также в межэлектродном пространстве электрохимической ячейки.
Электрохимические методы можно классифицировать следующим образом:
– методы без протекания электродной реакции (кондуктометрия
при низких и высоких частотах);
– методы, основанные на протекании электродных реакций в отсутствии тока (потенциометрия) или под током (кулонометрия, полярография).
Во всех случаях аналитическим сигналом является измеряемый электрический (сила тока, напряжение) или электрохимический (электропроводимость раствора, поляризация электродов) параметр.
Электрохимические методы анализа позволяют определять концентрации веществ в широком интервале (от 1 до 1 · 10 –9 моль/л), могут быть легко автоматизированы и использованы для контроля качества пищевых продуктов.[4]
Потенциометрические методы.
Потенциометрические методы основаны на измерении э.д.с. обратимых электрохимических цепей, когда рабочий (индикаторный) электрод имеет потенциал, близкий к равновесному.
Потенциометрический анализ проводят в потенциометрической ячейке, помещенных в исследуемый раствор. Во внешней электрической цепи электроды подключены к измерительному прибору – потенциометру, измеряющему разность потенциалов электродов ячейки или потенциал индикаторного электрода относительно потенциала электрода сравнения, который в данных условиях является величиной постоянной ( Eср = const), тогда как потенциал индикаторного электрода таковой величиной не является (Eинд ≠const). Эта разность носит название электродвижущей силы (ЭДС) потенциометрической ячейки:
ЭДС = Eср –Eинд. (1)
Потенциал индикаторного электрода связан уравнением Нернста с концентрацией (активностью) определяемого иона:
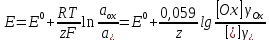 (1)
(1)
Второй электрод - сравнения, его потенциал должен оставаться постоянным независимо от протекания каких-либо реакций в анализируемом растворе, воспроизводимым и устойчивым во времени. Чаще всего в качестве электродов сравнения применяют электроды второго рода: хлорсеребряный и каломельный.
Требования к индикаторным электродам:
Обратимость относительно определяемого иона
быстро устанавливаться потенциал
электрод не должен влиять на состав
должен быть устойчив по отношению к веществам находящимся в растворе
должен быть не поляризуемым, то есть его потенциал не должен изменяться при протекании тока
должен иметь простую конструкцию
Требования к электродам сравнения:
должен иметь постоянный потенциал независимо от протекания реакции в растворе
потенциал должен быть устойчив во времени
иметь низкое сопротивление.
В зависимости от принципа действия различают электронно -обменные (металлические) и ионно-обменные(мембранные).
Потенциометрические методы анализа подразделяют на прямую потенциометрию и потенциометрическое титрование.
Прямая потенциометрия
Методы прямой потенциометрии (ионометрии) основаны на непосредственном применении уравнения Нернста для нахождения активности или концентрации участника электродной реакции по экспериментально измеренной э.д.с. цепи или потенциалу электрода. Ионометрия интенсивно развивается в связи с успехами в конструировании и улучшении качества ионоселективных электродов (ИСЭ), позволяющих проводить быстро и точно определение концентрации или активности ионов.
Точность метода составляет 2–10 %.
Потенциометрическое
титрование
- это объемно-аналитический метод, в
котором точку эквивалентности определяют
по резкому изменению (скачку) потенциала
вблизи точки эквивалентности. Кривые
потенциометрического титрования могут
быть представлены в интегральном(рис
1.1) и дифференциальном(рис. 1.2) виде.

Определение точки эквивалентности по дифференциальным кривым значительно точнее, чем по простой зависимости Е = f(V).
Современные установки потенциометрического титрования представляют собой автотитраторы, в качестве измерителя э.д.с. применяются высокоомные милливольтметры (рН-метры, ионометры). Схема установки для автоматического титрования (типа БАТ-15) представлена на рис.2
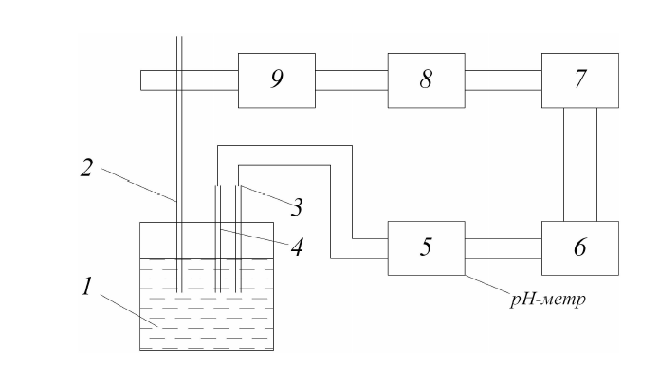
рис 2
В емкость с анализируемым раствором 1 вводится дозирующая трубка 2 для 7 подачи титранта, индикаторный электрод 4 и электрод сравнения 3 (хлорсеребрянный). Подача титранта регулируется клапаном 9. Напряжение Ех, пропорциональное э.д.с. системы, с выхода рН-метра 5 подается на вход БАТ, где сравнивается с заранее заданным напряжением Е0 на задатчике конечной точки титрования 6. Разность заданной и экспериментально наблюдаемой величины Ех - Е0 через усилитель 7 подается на бесконтактное реле 8, которое управляет работой электромагнитного клапана 9, открывающего или закрывающего подачу титранта. При EХ = Е0 клапан прекращает подачу титранта. Объем рабочего раствора отсчитывают по бюретке. Точность метода составляет 0,1–0,5%.
В потенциометрическом титровании используют все типы аналитических реакций, которые отвечают следующим требованиям:
- высокой скорости химической реакции;
-протеканию реакции стехиометрически, до конца;
-возможности выбора индикаторного электрода.
Существует некомпенсационный метод потенциометрического титрования. В данном методе измеряют не э.д.с., а ток, возникающий в гальваническом элементе. В начальный момент титрования э.д.с. элемента компенсируют внешней э.д.с., и ток в цепи отсутствует. В процессе титрования компенсация нарушается, в цепи возникает ток, причем в области точки эквивалентности ток резко возрастает пропорционально скачку э.д.с. в этой области.
К преимуществам потенциометрического титрования можно отнести:
высокая точность
возможность проводить определения в более разбавленных растворах, чем это позволяют проводить визуальные индикаторные методы
высокую чувствительность метода, которая не уступает, а в области малых концентраций и превосходит чувствительность объемного метода титрования.
возможность анализа мутных и окрашенных растворов, а также растворов, которые разлагают индикаторы
возможность определения концентрации как одного, так и нескольких компонентов при их совместном присутствии в растворе
возможность применения неводных растворителей, что позволяет найти содержание веществ нерастворимых или разлагающихся в воде
возможность автоматизации процесса
В качестве недостатков следует отметить:
необходимость получения большого числа экспериментальных точек в процессе титрования.
долгое установление потенциала после добавления титранта. [2]
