
- •Введение
- •Кинетика гомогенных реакций в растворах
- •Экспериментальные методы определения скорости реакции и ее порядка
- •Зависимость скорости реакции от температуры. Определение энергии активации.
- •Работа1. Исследование кинетики гидролиза уксусного ангидрида
- •Цель работы
- •Приборы и материалы
- •Последовательность проведения эксперимента
- •Обработка результатов:
- •Работа 2. Взаимодействие пероксида водорода с бихроматом калия Цель работы
- •Приборы и реактивы
- •Последовательность проведения эксперимента
- •Обработка результатов
- •Работа 3. Исследование кинетики взаимодействия кристаллического фиолетового со щелочью
Обработка результатов:
Форма представления результатов эксперимента представлена в табл. 2:
Таблица 2
|
Время, cек |
Электропроводность103, См/см |
103 |
ln(-) |
|
0.017 |
0.61341347 |
1,5895954 |
-6.9318615 |
|
12.022 |
0.63979443 |
|
-6.9592581 |
|
24.059 |
0.66719003 |
|
-6.9885257 |
|
36.293 |
0.69560029 |
|
-7.0198102 |
|
и т.д. |
|
|
|
Внимание ! Количество цифр после запятой, записанных в файле данных не соответствует реальной точности измерений)
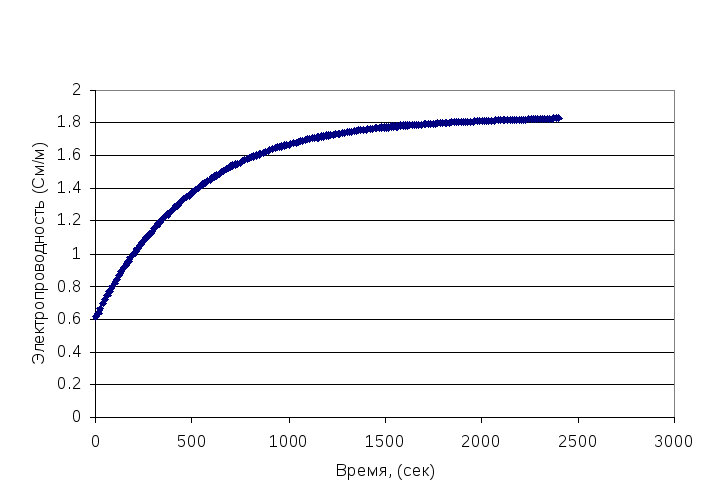
При достаточно длительном времени (~ 50 минут) электропроводность раствора перестает изменяться. Эту удельную электропроводность принимаем за График зависимости электропроводности раствора от времени представлен на рис. 1.2.
В программе “Linda” или в программе “Exell” построить график зависимости ln(-) от времени и определить по тангенсу угла наклона прямой к оси абсцисс константу скорости реакции гидратации уксусного ангидрида. Зависимость ln(-) от времени представлена на рис.1.3
В рассмотренном примере константа скорости реакции гидролиза уксусного ангидрида при температуре 18 0С составила 0.0016 сек-1.
Рассчитать константы скоростей реакции гидролиза уксусного ангидрида при других температурах и рассчитать энергию активации (Еа 75кДж/моль).
Р

Рис. 1.3 График зависимости ln(-) от времени.
Работа 2. Взаимодействие пероксида водорода с бихроматом калия Цель работы
Ознакомление с методикой кинетических исследований, изучение кинетической кривой, выбор формально-кинетической модели и определение константы скорости реакции разложения пероксида водорода
Взаимодействие пероксида водорода с бихроматом калия в кислой среде описывается уравнением:
K2Cr207 + H2O2 +4H2SO4= K2 SO4+ Cr2 (SO4)3+5H2O+2O2
При избытке пероксида водорода, эта реакция идет как необратимая реакция первого порядка. Поскольку концентрация пероксида в данном случае значительно больше концентрации бихромата калия, то убыль пероксида водорода мала и ее содержание в растворе можно считать постоянной величиной. Скорость реакции, следовательно, будет зависеть только от концентрации бихромата калия. В этом случае выражение для константы скорости имеет вид:
k
=
 1.18,
1.18,
где С0, С – соответственно, начальная и текущая концентрации бихромата калия
Эту реакцию удобно исследовать с помощью измерений давления выделяющегося кислорода, применяя датчик давления фирмы “Vernier”Чувствительным элементом датчика давления служит мембрана из пьезокварца. При изгибе мембраны под действием выделяющегося газа в кристалле пьезокварца возникает электрический сигнал, передаваемый затем в аналого-цифровой преобразователь (интерфейс). Там электрический сигнал преобразуется в коды компьютера и поступает на экран монитора.
Концентрация бихромата калия при этом пропорциональна разности давлений в системе в данный момент времени и когда реакция прошла полностью и давление в системе перестает изменяться. Тогда формула для расчета константы скорости приобретает вид:
k
=
![]() 1.19
1.19
где
![]() - давление в системе, когда реакция
прошла полностью;
- давление в системе, когда реакция
прошла полностью;
![]() -
давление в системе в момент начала
реакции;
-
давление в системе в момент начала
реакции;
![]() -
давление в системе в данный момент
времени.
-
давление в системе в данный момент
времени.
