
Fizika_Ekzamen_vip
.pdf30)Уравнение состояния идеального газа.
Состояние данной массы газа полностью определено, если известны его давление, температура и объем. Эти величины называют параметрами состояния газа. Уравнение, связывающее параметры состояния, называют уравнением состояния.
Для произвольной массы газа состояние газа описывается уравнением Менделеева—
Клапейрона:
PV = ν RT
где R — универсальная газовая постоянная (R=8,31Дж/(моль*К)).
Физический смысл универсальной газовой постоянной в том, что она показывает, какую работу совершает один моль идеального газа при изобарном расширении при нагревании на 1 К.
Уравнение Менделеева—Клапейрона показывает, что возможно одновременное изменение трех параметров, характеризующих состояние идеального газа. Однако многие процессы в газах, происходящие в природе и осуществляемые в технике, можно рассматривать приближенно как процессы, в которых изменяются лишь два параметра.
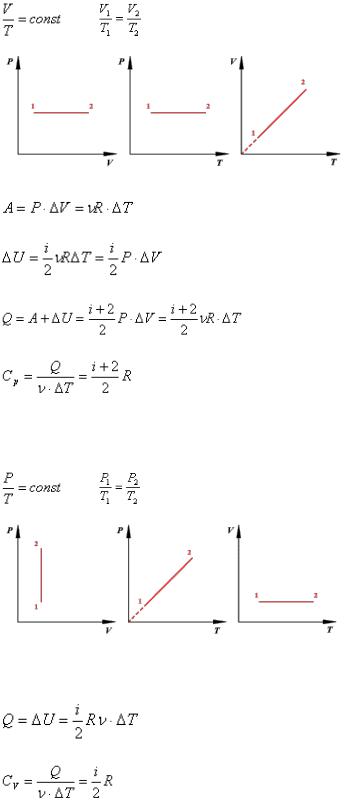
31)Изохорный, изобарный и изотермический процессы.
Изопроцессы — равновесные процессы, в которых один из основных параметров сохраняется.
ИЗОБАРНЫЙ ПРОЦЕСС
Для изобарного процесса в идеальном газе справедлив закон Гей-Люссака: при постоянном давлении объем данной массы газа прямо пропорционален его термодинамической температуре:
A |
или A |
. |
A
Работа газа при изобарном расширении:
A .
Изменение внутренней энергии:
A
Количество полученного тепла в соответствии с первым началом термодинамики:
A |
. |
Молярная теплоемкость при изобарном процессе: |
|
A |
. |
ИЗОХОРНЫЙ ПРОЦЕСС |
|
Изохорный процесс в идеальном газе описывается законом Шарля:
при постоянном объеме давление данной массы газа прямо пропорционально его термодинамической температуре:
A или A .
A
Работа газа при изохорном процессе равна нулю: A=0.
Все полученное тепло идет на изменение внутренней энергии в соответствии с первым началом термодинамики:
A .
Молярная теплоемкость при изохорном процессе:
A |
. |
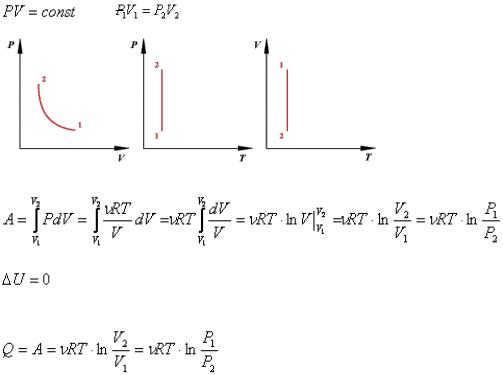
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
Изотермический процесс в идеальном газе подчиняется закону Бойля - Мариотта:
для данной массы газа при неизменной температуре произведение значений давления и объема есть величина постоянная:
A |
или A |
. |
A
Работа газа при изотермическом расширении:
A . Изменение внутренней энергии при изотермическом процессе равно нулю:
A.
Все полученное тепло идет на совершение работы в соответствии с первым началом термодинамики:
A |
. |
32)Внутренняя энергия и работа идеального газа, первый закон термодинамики.
Для идеального газа принебрегают потенциальной энергией, поэтому внутренняя энергия представляет собой сумму кинетических энергий теплового движения.
U = NEтепл. |
(1) = N i kT = ν i kNAT = i ν RT = i mRT |
|||
|
2 |
2 |
2 |
2 M |
ν = N = m NA M
k = R NA
= i mRT
U
2 M
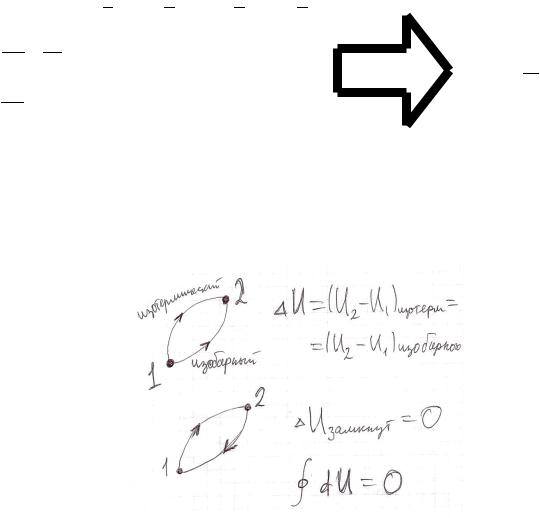
Внутренняя энергия газа - функция состояния, т.е. она зависит только от начального и конечного положения процесса и не зависит от вида процесса.
Изменение внутренней энергии по замкнутому контуру равно нулю.
Первый закон термодинамики.
Теплота, полученная неизолированной системой расходуется на изменение внутренней энергии и работу системы против внешних сил.
Qполуч = U + A
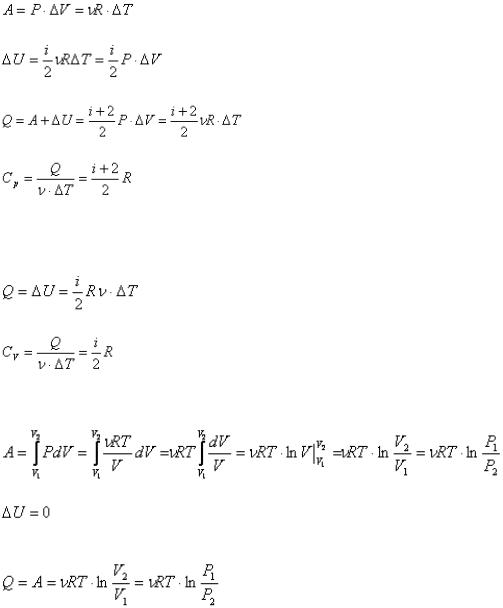
33)Первый закон термодинамики при изохорном, изобарном и изотермическом процессах.
ИЗОБАРНЫЙ ПРОЦЕСС
Работа газа при изобарном расширении:
A .
Изменение внутренней энергии:
A
Количество полученного тепла в соответствии с первым началом термодинамики:
A |
. |
Молярная теплоемкость при изобарном процессе: |
|
A |
. |
ИЗОХОРНЫЙ ПРОЦЕСС
Работа газа при изохорном процессе равна нулю: A=0.
Все полученное тепло идет на изменение внутренней энергии в соответствии с первым
началом термодинамики:
A .
Молярная теплоемкость при изохорном процессе:
A .
ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС
Работа газа при изотермическом расширении:
A . Изменение внутренней энергии при изотермическом процессе равно нулю:
A.
Все полученное тепло идет на совершение работы в соответствии с первым началом
термодинамики:
A |
. |
34)Внутренняя энергия и теплоемкость идеального газа.
Для идеального газа принебрегают потенциальной энергией, поэтому внутренняя энергия представляет собой сумму кинетических энергий теплового движения.
U = NEтепл. |
(1) = N i kT = ν i kNAT = i ν RT = i mRT |
|||
|
2 |
2 |
2 |
2 M |
ν = N = m NA M
k = R NA
= i mRT
U
2 M
Внутренняя энергия газа - функция состояния, т.е. она зависит только от начального и конечного положения процесса и не зависит от вида процесса.
Изменение внутренней энергии по замкнутому контуру равно нулю.


35)Работа идеального газа при изохорном, изобарном и изотермическом процессах.

36)Теплоемкости CP и CV. Уравнение Майера.
Теплоемкость вещества - физическая величина, равная отношению теплоты, сообщаемой телу к изменению температуры тела.
C* = δQ dT
Теплоемкость зависит от массы вещества, его химического строения, а также от вида процесса.
Молярная теплоемкость — количество теплоты, необходимое для нагревания 1 моль вещества на 1 К.
Удельная теплоемкость — это количество теплоты, необходимое для нагревания 1 кг вещества на 1 К.
Cм = Cν*
cуд = C* m
Связь между молярной теплоемкостью при постоянном давлении и объеме:
C |
|
= i + 2 |
R |
P = const |
Q = U + A |
||
|
|
|
|
|
P |
||
|
MP |
= |
i |
2 → CP = CV + R |
V = const |
QV = U |
|
CMV |
2 |
R |
|
|
QP > QV |
||
|
|
|
|
|
|
||
где γ — показатель адиабаты (коэффициент Пуассона).
CP = CV + R
Это уравнение Майера для одного моля газа.
Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе.
Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж.

37)МКТ теплоемкости. Теплоемкость и степени свободы.
МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ ТЕПЛОЕМКОСТИ ГАЗОВ Как показано в молекулярно-кинетической теории на каждую поступательную или
вращательную степень свободы каждой микрочастицы приходится энергия равная
A |
= |
1 |
kT |
(закон равномерного распределения энергии по степеням свободы). |
E(1) |
2 |
|
||
|
|
|
|
Микрочастицы (молекулы, атомы), из которых состоит газ, могут совершать, в общем случае, три типа движений: поступательное, вращательное, колебательное.
• |
Одноатомный газ(He1) является М.Т., совершает только поступательное движение в |
|
трех направлениях i=3^E(1) = 3 kT |
|
2 |
• |
Двуатомный газ (О2) является твердым телом, но третье вращение недоступно для него, |
|
т.к. имеет форму штанги, а значит имеет i=3пост+2вращ=5 E(1) = 5 kT |
|
2 |
• |
Двуатомный газ с колебаниями (колебания происходят за счет потенциальной и |
|
кинетической энергии) i=3пост+2вращ+2колебат=7 E(1) = 7 kT |
|
2 |
• |
Трехатомный газ (СО2) твердое тело i=3пост+3вращ=6 E(1) = 6 kT |
2 |
|
• |
Трехатомный газ с колебаниями (колебания происходят за счет потенциальной и |
|
кинетической энергии) i=3пост+3вращ+3*2колебат=12 E(1) = 12 kT |
|
2 |
Про внутреннюю энергию можно найти в 32 билете.
