
- •Определение фармакологии как науки, ее место среди других медико-биологических наук. Цели и задачи фармакологии.
- •Основные понятия лекарствоведения. Лекарственное средство ( вещество ), лекарственная форма и лекарственный препарат. Основные этапы внедрения лекарственных средств в медицинскую практику.
- •Зависимость действия лекарственных веществ от дозы. Виды доз. Широта терапевтического действия. Терапевтический индекс. Понятие о терапевтическом коридоре.
- •4. Генетические факторы. Особое значение в реализации действия лекарственных средств имеют наследственные дефекты ферментов, принимающих участие в их метаболизме (ферментопатии).
- •Зависимость действия лекарственных средств от патологического состояния организма. Роль генетических факторов в проявлении фармакологического эффекта. Типы энзимопатий, идиосинкразия.
- •Действие лекарств при их повторном введении. Материальная и функциональная кумуляция, привыкание, тахифилаксия.
- •Взаимодействие лекарственных веществ. Синергизм, антагонизм. Лекарственная несовместимость.
- •Принципы дозирования и применения инсулина:
-
Определение фармакологии как науки, ее место среди других медико-биологических наук. Цели и задачи фармакологии.
Фармакология (греч. pharmakon – лекарство) – наука о взаимодействии лекарственных веществ с живыми системами.
Лекарствоведение помимо фармакологии включает в себя фармацию, состоящую из фармацевтической химии (науки о физико-химических свойствах лекарства), фармакогнозии (науки о лекарственных веществах растительного происхождения), технологии лекарственных форм (науки об изготовлении лекарственных препаратов) и организации фармации.
При изучении биологических свойств лекарств фармакология опирается на достижения в области химии (в настоящее время большинство лекарств – продукты химического синтеза), биологической химии, нормальной и патологической физиологии (использует их концепции для объяснения механизмов действия лекарств, а методики – для оценки эффектов, которые вызывает в организме лекарство).
Основная цель фармакологии – изыскание новых высокоэффективных и безопасных лекарственных средств.
Задачами фармакологии являются:
-
Изучение механизма действия и влияния лекарственных веществ на органы и системы организма.
-
Исследование нежелательных (побочных) и токсических реакций лекарственных веществ.
-
Установление показаний и противопоказаний к назначению лекарств.
-
Разработка схем рационального дозирования лекарств.
-
Основные понятия лекарствоведения. Лекарственное средство ( вещество ), лекарственная форма и лекарственный препарат. Основные этапы внедрения лекарственных средств в медицинскую практику.
Лекарственное средство (лекарство) – одно или несколько лекарственных веществ разрешенных в установленном порядке для практического применения с целью лечения, профилактики, диагностики заболеваний у человека и животных, а также для применения с целью контрацепции. Лекарственное вещество – индивидуально чистое химическое соединение.
Лекарственная форма – придаваемое лекарственному средству удобное для практического применения состояние, при котором достигается необходимый терапевтический эффект.
Лекарственный препарат – лекарственное вещество (средство) в приданной ему определенной лекарственной форме.


-
Источники получения лекарственных средств. Пути изыскания новых лекарственных средств.
Источниками получения лекарств могут быть:
-
Продукты химического синтеза. В настоящее время большинство лекарств получают именно этим путем. Различают несколько путей изыскания лекарств среди продуктов химического синтеза:
-
Фармакологический скрининг (англ. to screen – просеивать). Метод поиска веществ с определенным типом фармакологической активности среди множества химических соединений синтезированных химиками по специальному заказу. Впервые фармакологический скрининг применил немецкий ученый Домагк, который работал в химическом концерне IG-FI и проводил поиск антимикробных средств среди соединений, синтезированных для крашения тканей. У одного из этих красителей – красного стрептоцида и было обнаружено противомикробное действие. Так были открыты сульфаниламидные средства. Проведение скрининга – чрезвычайно трудоемкий и затратный процесс: для обнаружения одного лекарственного средства исследователю приходится тестировать несколько сотен или тысяч соединений. Так, Пауль Эрлих, при поиске противосифилитических средств изучил около 1000 органических соединений мышьяка и висмута и только 606-й препарат – сальварсан, оказался достаточно эффективным. В настоящее время, для проведения скрининга необходимо синтезировать не менее 10.000 исходных соединений, чтобы с большей долей уверенности полагать, что среди них имеется одно (!) потенциально эффективное лекарственное средство.
-
Молекулярное конструирование лекарств. Создание сканнирующей томографии и рентгенструктурного анализа, развитие компьтерных технологий позволили получать трехмерные изображения активных центров рецепторов и ферментов и подбирать к ним молекулы, конфигурация которых точно соответствует их форме. Молеуклярное конструирование не требует синтеза тысяч соединений и их тестирования. Исследователь сразу создает несколько молекул идеально подходящих к биологическому субстрату. Однако, по своей экономической стоимости данный метод не уступает скринингу. Методом молекулярного конструирования были получены ингибиторы нейраминидазы – новая группа противовирусных препаратов.
-
Воспроизведение биогенных веществ. Таким образом были получены медиаторные средства – адреналин, норадреналин, простагландины; средства с активностью гормонов гипофиза (окситоцин, вазопрессин), щитовидной железы, надпочечников.
-
Целенаправленная модификация молекул с уже известной активностью. Так, например, было установлено, что введение атомов фтора в молекулы лекарств, как правило повышает их активность. Путем фторирования кортизола были созданы мощные глюкокортикоидные препараты, при фторировании хинолонов были получены наиболее активные противомикробные средства – фторхинолоны.
-
Синтез фармакологически активных метаболитов. При изучении метаболизма транквилизатора диазепама было установлено, что в печени из него образуется вещество с транквилизирующей активностью – оксазепам. В настоящее время оксазепам синтезируется и выпускается как отдельное лекарственное средство.
-
Случайные находки («серендипитный» метод). Метод получил свое название по сказке Горация Уолпола «Три принцессы Серендипи». Эти сестры часто совершали удачные открытия и находили решения проблем сами специально не желая того. Примером «серендипитного» получения лекарства является создание пенициллина, которое произошло во многом благодаря тому, что A. Fleming случайно обратил внимание на то, что в заплесневелой чашке, забытой в термостате на Рождество, погибли микроорганизмы. Иногда случайные открытия совершаются в результате ошибки. Так например, ошибочно полагая, что противосудорожное действие фенитоина связано с тем, что он является антагонистом фолиевой кислоты, сотрудники концерна Glaxo Wellcome синтезировали ламотриджин – новое противосудорожное средство. Однако, оказалось что, во-первых, действие фенитоина не связано с фолиевой кислотой, а во-вторых, сам ламотриджин не вмешивается в обмен фолатов.
-
Компоненты растительного сырья. Многие растения содержат вещества, обладающие полезными фармакологическими свойствами, причем до настоящего времени продолжается открытие все новых и новых соединений. Широко известными примерами лекарственных средств, полученных из лекарственного растительного сырья являются морфин, выделенный из опийного мака (Papaver somniferum), атропин, полученный из красавки (Atropa belladonna).
-
Ткани животных. Из тканей животных получают некоторые гормональные препараты – инсулин из тканей поджелудочной железы свиней, эстрогены из мочи жеребцов, ФСГ из мочи женщин.
-
Продукты жизнедеятельности микроорганизмов. Ряд антибиотиков, средства для лечения атеросклероза из группы статинов получают из культуральной жидкости различных грибков и бактерий.
-
Минеральное сырье. Из попутных продуктов нефтеперегонки получают вазелин, используемый в качестве мазевой основы.
-
Рецепт как объект деятельности провизора. Структура рецепта. Формы рецептурных бланков. Постановление МЗ РБ № 99 « О правилах выписывания рецептов и отпуска населению лекарственных средств».
См ОЭФ
-
Правила выписывания в рецептах мягких лекарственных форм. Понятие о терапевтических трансдермальных системах.






-
Правила выписывания в рецептах лекарственных форм для инъекций и аэрозолей.




-
Правила выписывания в рецептах твердых лекарственных форм.








-
Правила выписывания в рецептах жидких лекарственных форм.














-
Особенности выписывания в рецептах ядовитых, наркотических и сильнодействующих средств. Анализ рецептурных прописей и их коррекция.
См ОЭФ
-
Пути введения лекарственных средств в организм. Их классификация. Характеристика энтеральных путей введения.
Все пути введения лекарственных средств в организм можно разделить на энтеральные и парентеральные. Энтеральные пути введения (enteros – кишечник) обеспечивают введение лекарственного средства в организм через слизистые оболочки желудочно-кишечного тракта. К энтеральным путям введения относят:
-
Оральное введение (внутрь, per os) – введение лекарства в организм путем проглатывания. При этом лекарство попадает вначале в желудок и кишечник, где в течение 30-40 мин происходит его всасывание в систему воротной вены. Далее с током крови лекарство поступает в печень, затем в нижнюю полую вену, правые отделы сердца и, наконец, малый круг кровообращения. Пройдя малый круг лекарство по легочным венам достигает левых отделов сердца и, с артериальной кровью, поступает к тканям и органам-мишеням. Этим путем чаще всего вводят твердые и жидкие лекарственные формы (таблетки, драже, капсулы, растворы, пастилки и др.).
|
Преимущества метода |
Недостатки метода |
|
|
-
Ректальный путь (per rectum) – введение лекарства через анальное отверстие в ампулу прямой кишки. Этим путем вводят мягкие лекарственные формы (суппозитории, мази) или растворы (при помощи микроклизмы). Всасывание вещества осуществляется в систему геморроидальных вен: верхней, средней и нижней. Из верхней геморроидальной вены вещество попадает в систему воротной вены и проходит через печень, после чего оно поступает в нижнюю полую вену. Из средней и нижней геморроидальных вен лекарство поступает сразу в систему нижней полой вены, минуя печень. Ректальный путь введения часто применяется у детей первых трех лет жизни.
-
Сублингвальное (под язык) и суббукальное (в полость между десной и щекой) введение. Таким способом вводят твердые лекарственные формы (таблетки, порошки), некоторые из жидких форм (растворы) и аэрозоли. При этих способах введения лекарственное средство всасывается в вены слизистой оболочки ротовой полости и далее последовательно поступает в верхнюю полую вену, правые отделы сердца и малый круг кровообращения. После этого лекарство доставляется в левые отделы сердца и с артериальной кровью поступает к органам мишеням.Преимущества метода
Недостатки метода
-
Часть лекарства избегает метаболизма в печени, сразу поступая в системный кровоток.
-
Можно использовать у пациентов с рвотой, стриктурами пищевода, массивными отеками, нарушением сознания.
-
На лекарство не действуют пищеварительные ферменты.
-
Психологический фактор: данный путь введения может не нравиться или чрезмерно нравиться пациенту.
-
Возможно раздражающее действие лекарства на слизистую оболочку прямой кишки.
-
Ограниченная поверхность абсорбции.
-
Непостоянная скорость всасывания и степень всасывания лекарственного средства. Зависимость абсорбции от наличия фекальных масс в кишке.
-
Требуется специальное обучение пациента технике введения.
-
|
Преимущества метода |
Недостатки метода |
|
|
-
Пути введения лекарственных средств в организм. Характеристика инъекционных путей введения.
Парентеральное введение – путь введения лекарственного средства, при котором оно поступает в организм минуя слизистые оболочки желудочно-кишечного тракта.
-
Инъекционное введение. При этом пути введения лекарство сразу попадает в системный кровоток, минуя притоки воротной вены и печень. К инъекционному введению относят все способы, при которых повреждается целостность покровных тканей. Они осуществляются при помощи шприца и иглы. Основное требование к данному пути введения – обеспечение стерильности лекарственного средства и асептического выполнения инъекции.
-
Внутривенное введение. При этом способе введения игла шприца прокалывает кожу, гиподерму, стенку вены и лекарство непосредственно вводится в системный кровоток (нижнюю или верхнюю полые вены). Лекарство может вводиться струйно медленно или быстро (болюсом), а также капельным способом. Таким образом вводят жидкие лекарственные формы, которые являются истинными растворами или лиофилизированные порошки (предварительно растворив их).
Преимущества метода
Недостатки метода
-
Непосредственное введение лекарства в кровь и практически мгновенное развитие эффекта.
-
Высокая точность дозирования.
-
Можно вводить вещества, которые обладают раздражающим действием или являются гипертоническими растворами (в количестве не более 20-40 мл).
-
Можно вводить вещества, которые разрушаются в ЖКТ.
-
Невозможно вводить масляные растворы, эмульсии и суспензии, если они не прошли специальной обработки.
-
Очень сложная техника манипуляции, которая требует специально обученного персонала.
-
В органах с хорошим кровоснабжением могут создаваться токсические концентрации вещества в первые минуты после введения.
-
Возможно инфицирование и воздушная эмболия при неправильной технике.
-
-
Внутримышечное введение. Данным путем вводят все виды жидких лекарственных форм и растворы порошков. Иглой шприца прокалывают кожу, гиподерму, фасцию мышцы и затем ее толщу, куда и впрыскивают лекарство. Абсорбция лекарства происходит в систему полых вен. Эффект развивается через 10-15 мин. Объем вводимого раствора не должен превышать 10 мл. При внутримышечном введении лекарство всасывается менее полно, по сравнению с внутривенным введением, но лучше, чем при пероральном применении (однако, могут быть исключения из этого правила – например, диазепам при внутримышечном введении всасывается менее полно, чем при введении внутрь).
Преимущества метода
Недостатки метода
-
Можно вводить масляные растворы и эмульсии, а также депо-препараты, которые обеспечивают сохранение эффекта несколько месяцев.
-
Сохраняется высокая точность дозирования.
-
Можно вводить раздражающие вещества, т.к. ткани мышц не содержат много рецепторов.
-
Требуется специально обученный персонал для выполнения инъекции.
-
Возможно повреждение сосудисто-нервных пучков при выполнении инъекции.
-
Невозможно удалить депо-препарат, если требуется прекращение лечения.
-
-
Подкожное введение. Данным путем вводят жидкие лекарственные формы любого вида и растворимые порошки. Игла шприца прокалывает кожу и входит в гиподерму, лекарственное вещество после введения всасывается сразу в систему полых вен. Эффект развивается через 15-20 мин. Объем раствора не должен превышать 1-2 мл.
Преимущества метода
Недостатки метода
-
Эффект сохраняется дольше, чем при внутривенном или внутримышечном введении этого же лекарства.
-
Можно вводить лекарства, которые разрушаются в ЖКТ.
-
Всасывание происходит достаточно медленно из-за низкой скорости кровотока. Если периферическое кровообращение нарушено, то эффект может не развиться вообще.
-
Нельзя вводить вещества, которые обладают раздражающим действием и сильные сосудосуживающие средства, т.к. они могут вызывать некроз.
-
Риск инфицирования раны.
-
Требуется специальное обучение пациента или помощь персонала.
-
-
Интратекальное введение – введение лекарственного вещества под оболочки мозга (субарахноидально или эпидурально). Выполняют путем инъекции вещества на уровне L4-L5 поясничных позвонков. При этом игла прокалывает кожу, гиподерму, межостистые и желтые связки отростков позвонков и подходит к оболочкам мозга. При эпидуральном введении лекарство поступает в пространство между костным каналом позвонков и тр=вердой оболочкой мозга. При субарахноидальном введении игла прокалывает твердую и паутинную оболочки мозга и лекарство вводится в пространство между тканями мозга и мягкой мозговой оболочкой. Объем вводимого лекарства не может превышать 3-4 мл. При этом необходимо удалить соответствующее количество ликвора. Вводят только истинные растворы.
-
Преимущества метода
Недостатки метода
-
Создается высокая концентрация лекарства в тканях мозга и ликворе.
-
Можно вводить средства, которые не проникают через ГЭБ.
-
Чрезвычайно сложная техника инъекции.
-
Риск травмы тканей мозга и перепадов внутричерепного давления.
-
Невозможно обеспечить введение неистинных растворов (суспензий, эмульсий).
-
-
Пути введения лекарственных средств в организм. Характеристика ингаляционного и трансдермального путей введения.
-
Ингаляционное введение – введение лекарственного вещества путем вдыхания его паров или мельчайших частиц. Данным путем вводят газы (закись азота), летучие жидкости, аэрозоли и порошки. Глубина введения аэрозолей зависит от величины частиц. Частицы диаметром более 60 мкм оседают в глотке и проглатываются в желудок. Частицы диаметром 40-20 мкм проникают в бронхиолы, а частицы диаметром 1 мкм достигают альвеол. Лекарство проходит через стенку альвеолы и бронхов и попадает в капиляр, затем с током крови поступает в левые отделы сердца и, по артериальным сосудам, доставляется к органам мишеням.
Преимущества метода
Недостатки метода
-
Быстрое развитие эффекта в связи с хорошим кровоснабжением и большой поверхностью абсорбции (150-200 м2).
-
В случае заболевания дыхательных путей лекарство доставляется непосредственно в очаг поражения и можно уменьшить вводимую дозу лекарства и, следовательно, вероятность развития нежелательных эффектов.
-
Необходимо использовать специальные ингаляторы для введения лекарственного вещества.
-
Требуется обучение пациента синхронизации дыхания и ингаляции лекарства.
-
Нельзя вводить лекарства, оказывающие раздражающее действие или вызывающие бронхоспазм.
-
-
Трансдермальное введение – аппликация на кожу лекарственного вещества для обеспечения его системного действия. Используют специальные мази, кремы или TTS (трансдермальные терапевтические системы – пластыри).
|
Преимущества метода |
Недостатки метода |
|
|
-
Всасывание лекарственных веществ. Факторы, влияющие на процессы абсорбции. Понятие о биодоступности.
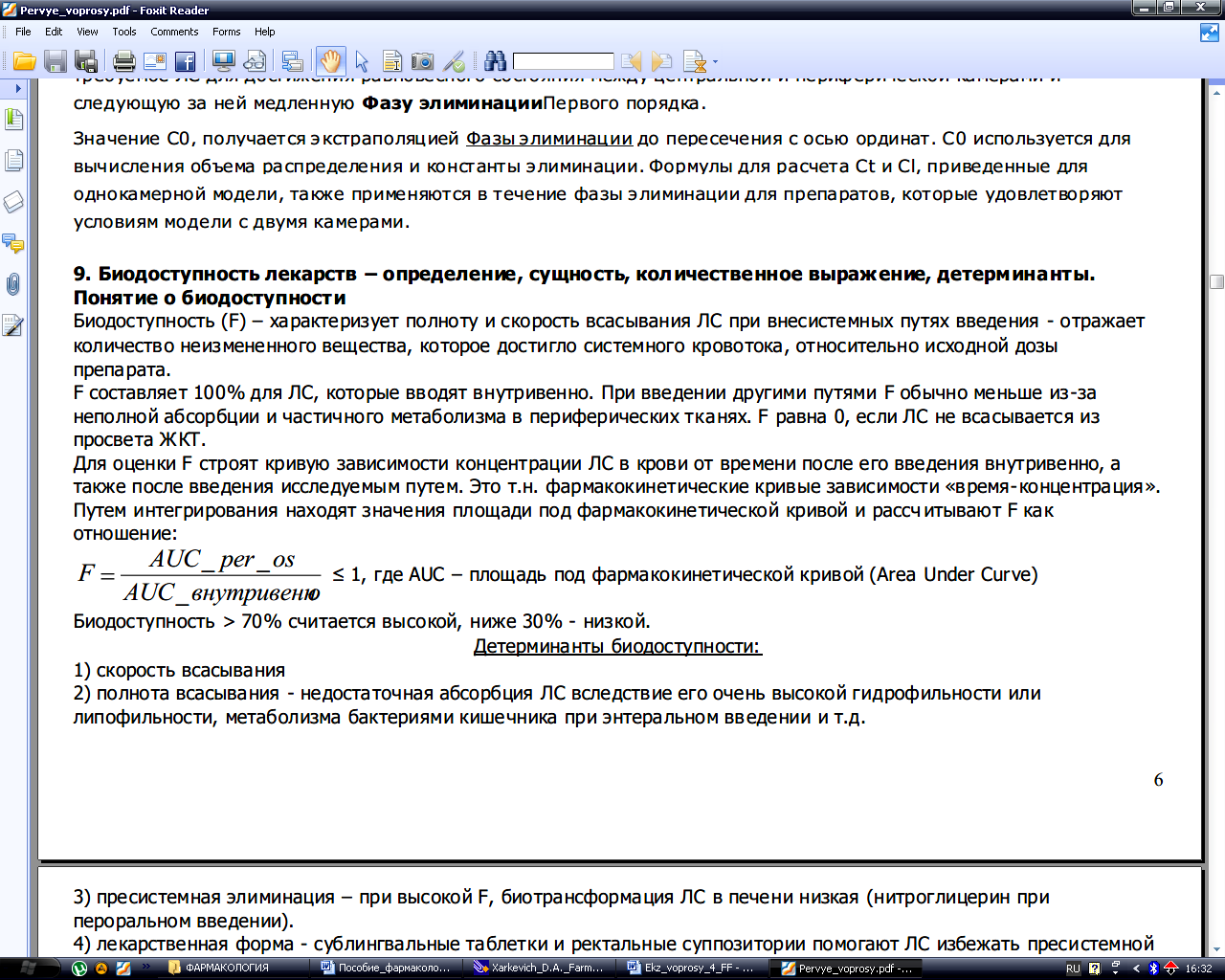
-
Распределение лекарств в организме. Факторы, влияющие на характер распределения. Значение связывания лекарственных веществ с белками плазмы крови. Роль гистогематических барьеров. Объем распределения.
Распределением лекарственных средств называют процесс его распространения по органам и тканям после того, как он поступит в системный кровоток. Именно распределение лекарств обеспечивает его попадание к клеткам-мишеням. Распределение лекарств зависит от следующих факторов:
-
Природы лекарственного вещества – чем меньше размеры молекулы и липофильнее лекарство, тем быстрее и равномернее его распределение.
-
Размеров органов – чем больше размер органа, тем больше лекарственного средства может поступить в него без существенного изменения градиента концентраций. Например, объем скелетных мышц очень велик, поэтому концентрация лекарства в них остается низкой даже после того, как произошла абсорбция значительного количества лекарства. Напротив, объем головного мозга ограничен и поступление в него даже небольшого количества лекарства сопровождается резким повышением его концентрации в ткани ЦНС и исчезновению градиента.
-
Кровоток в органе. В хорошо перфузируемых тканях (мозг, сердце, почки) терапевтическая концентрация вещества создается значительно раньше, чем в тканях плохо перфузируемых (жировая, костная). Если лекарственное средство быстро подвергается разрушению, то в плохо перфузируемых тканях его концентрация может так и не повысится.
-
Наличие гистогематических барьеров (ГГБ). ГГБ называют совокупность биологических мембран между стенкой капилляра и тканью, которую он кровоснабжает. Если ткань имеет плохо выраженный ГГБ, то лекарство легко проникает через него. Такая ситауция имеет место в печени, селезенке, красном костном мозге, где имеются капилляры синусоидного типа (т.е. капилляры, в стенке которых имеются отверстия – фенестры). Напротив, в ткани с плотными ГГБ распределение лекарств происходит весьма плохо и возможно лишь для высоколипофильных соединений. Наиболее мощными ГГБ в организме человека являются:
-
Гемато-энцефалический барьер – барьер между кровеносными капиллярами и тканью мозга. Покрывает всю мозговую ткань за исключением гипофиза и дна IV желудочка. При воспалении проницаемость барьера резко возрастает.
-
Гемато-офтальмический барьер – барьер между капиллярами и тканями глазного яблока;
-
Гемато-тиреоидный барьер – барьер между капиллярами и фолликулами щитовидной железы;
-
Гемато-плацентарный барьер – разделяет кровообращение матери и плода. Один из самых мощных барьеров. Практически не пропускает лекарственные вещества с Mr>600 Да вне зависимости от их липофильности. Проницаемость барьера повышается с 32-35 нед беременности. Это связано с его истончением.
-
Гемато-тестикулярный барьер – барьер, который разделяет кровеносные сосуды и ткани яичек.
-
Связывание лекарства с белками плазмы. Чем больше связанная фракция лекарства, тем хуже его распределение в ткани. Это связано с тем, что покидать капилляр могут лишь свободные молекулы.
-
Депонирование лекарства в тканях. Связывание лекарства с белками тканей способствует его накоплению в них, т.к. снижается концентрация свободного лекарства в периваскулярном пространстве и постоянно поддерживается высокий градиент концентраций между кровью и тканями.
Количественной характеристикой распределения лекарства является кажущийся объем распределения (Vd). Кажущийся объем распределения – это гипотетический объем жидкости, в котором может распределиться вся введенная доза лекарства, чтобы создалась концентрация, равная концентрации в плазме крови. Т.о. Vd равен отношению введенной дозы (общего количества лекарства в организме) к его концентрации в плазме крови:
![]() .
.
-
Биотрансформация лекарственных веществ, ее виды. Факторы, влияющие на скорость биотрансформации. Роль ферментов печени в метаболизме лекарственных веществ. Эффект первого прохождения. Понятие о «пролекарствах».
Биотрансформацией (метаболизмом) называют изменение структуры лекарств в результате их химической модификации. Основная направленность процессов метаболизма – перевод лекарств в гидрофильную форму, которая лишена фармакологической активности и способна легко выводиться из организма.
Метаболизм лекарств включает 2 фазы:
I фаза – несинтетические реакции метаболизма
Восстановление.
Гидролиз.
Окисление.
II фаза – синтетические реакции метаболизма
-
Реакции, в которых активируется конъюгирующее вещество:
-
Глюкуронизация;
-
Ацетилирование;
-
Сульфатирование;
-
Метилирование.
-
Реакции, в которых активируется ксенобиотик:
-
Глицилирование.
Индивидуальность скорости метаболизма лекарственных веществ в организме человека связана со следующими факторами:
-
Возрастом и полом.
-
Заболеваниями, влияющими на метаболизм лекарств.
-
Воздействием лекарственных веществ на системы метаболизма.
-
Генетические особенности организма.
Эффектом первого прохождения или пресистемным метаболизмом называют процесс биотрансформации лекарства, который приводит к его инактивации еще до того, как лекарство попадет в системный кровоток. В пресистемной элиминации при пероральном введении лекарства участвуют ферментативные системы кишечника, крови воротной вены и гепатоциты.
Пролекарства – это фармакологически неактивные вещества, которые при введении в организм, подвергаются метаболизму и приобретают фармакологическую активность.
-
Пути выведения лекарств из организма. Механизмы почечной экскреции. Факторы, влияющие на скорость экскреции. Круги циркуляции лекарственных веществ в организме.
Лекарственные вещества и их метаболиты выводятся из организма следующими путями:
-
через почки (с мочой);
-
через печень (с желчью);
-
через легкие (с выдыхаемым воздухом, мокротой);
-
через кожу и слизистые с секретами расположенных в них желез (сальные, потовые, слизистые, слюнные);
-
через молочные железы (с молоком).
Выведение через почки. Почечная экскреция – основной путь выведения для большинства лекарств. Она представляет собой совокупность 3 процессов – клубочковой фильтрации, проксимальной канальцевой секреции и дистальной канальцевой реабсорбции.
-
Фильтрация – процесс фильтрации лекарства протекает пассивно и зависит только от наличия градиента гидростатического давления между петлями сосудов клубочка и капсулой канальца, а также концентрации лекарственного средства. Процесс фильтрации протекает через специальные поры – фенестры, диаметр которых составляет 2-4 нм, что в 10 раз больше диаметра пор в обычных капиллярах. В связи с этим, процессу фильтрации в почках подвергаются лекарственные вещества с молекулярной массой не более 5.000-10.000 Да. Фильтруются только не связанные с белком молекулы лекарства, а скорость экскреции лекарства пропорциональна его несвязанной фракции (fu) и скорости фильтрации крови в клубочке (СФК=120 мл/мин): СЭ=fu´СФК.
-
Проксимальная секреция. Клетки проксимального отдела нефрона содержат особые белки-переносчики, которые имеют низкую субстратную специфичность и способны транспортировать вещества лишь на основании их принадлежности к классу слабых кислот или слабых оснований. В настоящее время установлено, что по меньшей мере имеется 2 типа белков-переносчиков: транспортеры слабых кислот и и транспортеры слабых оснований. Выделение лекарств путем секреции не зависит ни от заряда молекулы, ни от ее размера или связи с белками плазмы.
В клинической практике иногда используют вещества, которые блокируют систему проксимальной секреции лекарств, чтобы замедлить выведение лекарств и продлить их эффект. Например, пробенецид блокирует систему белков переносчиков для слабых кислот и замедляет элиминацию пенициллина, продлевая его терапевтический эффект.
-
Дистальная канальцевая реабсорбция. По мере продвижения лекарственного вещества по канальцу нефрона за счет концентрирования мочи уровень лекарственного вещества в ней повышается. Как только концентрация лекарства в моче превысит его уровень в окружающей нефрон ткани, начинается процесс обратной реабсорбции. Процесс реабсорбции протекает путем липидной диффузии, т.е. зависит от концентрационного градиента и липофильности молекул лекарства. Количественно он характеризуется уже рассмотренной выше зависимостью Henderson-Hasselbach и может регулироваться путем изменения рН мочи.
Выведение через печень. Экскреция лекарства с желчью протекает в основном в виде конъюгатов с глюкуроновой кислотой и включает 2 процесса – перенос лекарства из крови в гепатоцит с его последующей конъюгацией и затем выделение в просвет желчного капилляра. Перенос лекарства в гепатоцит осуществляется как путем фильтрации, так и при помощи активного транспорта переносчиками для слабых кислот и оснований (фактически аналогичными почечным переносчикам).
После конъюгации лекарства выделяется с током желчи в 12-перстную кишку. В дальнейшем, продвигаясь по кишечнику, конъюгат лекарства может подвергаться бактериальному гидролизу, с высвобождением активной формы лекарства, которая вновь способна всасываться и поступать в кровоток. Движение лекарства по циклической системе: кровоток → печень → желчные пути → кишечник → кровоток называется энтерогепатической циркуляцией лекарства. Благодаря такой циркуляции эффект лекарства сохраняется более длительное время. Печеночная элиминация и энтерогепатическая циркуляция характерны для дигоксина, морфина, хлорамфеникола.
Феномен энтерогепатической циркуляции используют для лечения отравлений. Например, при передозировке опиоидных анальгетиков (даже при условии их внутривенного введения), проводят промывание желудка и назначают активированный уголь. Эти мероприятия позволяют связать ту часть лекарства, которая проходит цикл энтерогепатической циркуляции и значительно понизить его концентрацию в организме.
Выведение через легкие. Через легкие выделяются, главным образом, пары летучих жидкостей и газов, которые применяются в анестезиологии. Кроме того, альвеолярным путем выводятся из организма спирт, соли брома и йода, камфара.
Выведение с грудным молоком. Этот путь элиминации не является, как правило, ведущим для лекарств (единственным исключением, пожалуй, следует считать соли ртути – грудное молоко является для соединений ртути основным путем элиминации). Элиминация веществ с молоком имеет важное значение при использовании у кормящих матерей лекарств, которые обладают потенциально токсичными для ребенка свойствами. В таких случаях следует отлучать ребенка от груди и переводить его на искусственное вскармливание.
Кожная элиминация лекарств может применяться с фармакотерапевтическими целями. Например, противогрибковое средство тербинафин концентрируется в сальных железах кожи и выводится с их секретом, создавая на коже фунгицидные концентрации лекарства.
-
Элиминирование лекарств. Кинетика элиминации. Клиренс, как основной показатель элиминирования лекарств. Понятие о периоде полувыведения.
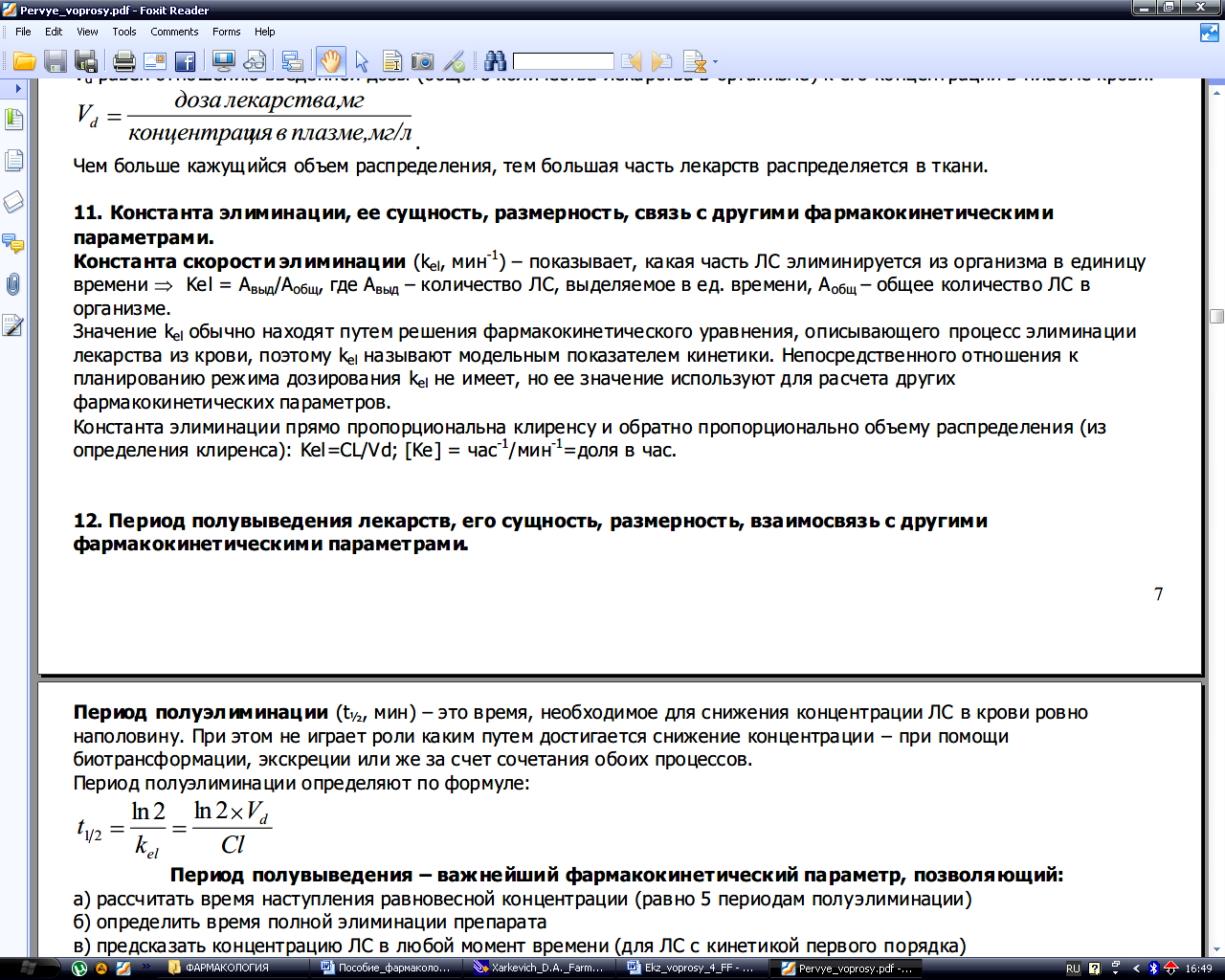


-
Понятие о фармакологическом эффекте. Механизм действия лекарственных средств. Первичная фармакологическая реакция. Природа и типы рецепторов. Определение понятий агонист, антагонист, частичный агонист и агонист-антагонист.

Агонисты или миметики (от греч. agonistes – соперник; mimeomai - подражать) – вещества, которые связываясь с рецепторами способны их активировать, что вызывает развитие ответа, характерного для данного типа рецепторов.
Антагонисты или блокаторы (от греч. antagonisma – соперничество, противоборство) – это лекарственные вещества, которые связываются с рецепторами, но не вызывают их активации (т.е. их внутренняя активность равна нулю).
Парциальные агонисты – это вещества, которые связываются с рецепторами и вызывают их активацию, однако, даже если они займут все рецепторы, эти вещества не способны вызвать максимальный ответ для данного типа рецепторов.
Инверсные агонисты – это вещества, которые связываются с рецепторами и вызывают эффект обратный тому, который возникает при действии обычного агониста.
-
Виды действия лекарств. Местное, рефлекторное и системное действие лекарств. Характеристика прямого, косвенного, избирательного, неизбирательного, обратимого и необратимого действия лекарственных средств.


-
Зависимость действия лекарственных веществ от их строения, физико-химических свойств, лекарственной формы, пути введения. Биоэквивалентность лекарственных препаратов.
Химическая структура лекарства определяет следующие особенности его действия:
-
Пространственную конфигурацию молекул лекарства и его способность активировать или блокировать рецепторы. Так, например, l-энантиомер пропранолола способен блокировать b1 и b2-адренорецепторы, тогда как его d-энантиомер в несколько раз более слабый адреноблокатор.
-
Тип биосубстрата, с которым вещество способно взаимодействовать. Например, стероидные молекулы с ароматизированным кольцом из класса С18-стероидов активируют эстрогеновые рецепторы, а при насыщении кольца приобретают способность стимулировать андрогеновые рецепторы.
-
Характер устанавливаемых с биосубстратом связей и продолжительность действия. Например, ацетилсалициловая кислота образует ковалентную связь с циклооксигеназой, ацетилирует активный центр фермента и необратимо лишает его активности. Напротив салицилат натрия образует с активным центром фермента ионную связь и лишь временно лишает его активности.
Физико-химические свойства лекарства. Данная группа свойств определяет, главным образом, кинетику лекарства и его концентрацию в области биологического субстрата. Ведущую роль здесь играет степень полярности молекулы вещества, сочетание липофильных и гидрофильных свойств. Все эти факторы были уже рассмотрены ранее.
Лекарственная форма. Лекарственная форма определяет скорость поступления лекарства в системный кровоток и продолжительность его действия. Так, в ряду водный раствор > суспензия > порошок > таблетка скорость поступления в кровоток падает. Данный эффект связан, отчасти, с площадью поверхности лекарственной формы – чем она больше, тем быстрее происходит всасывание, т.к. большая часть лекарства контактирует с биологической мембраной. Данную зависимость можно проиллюстрировать следующим примером: площадь поверхности куба с ребром 1 см составляет 6 см2, а если этот куб разделить на меньшие кубики с ребром 1 мм, то площадь поверхности составит 60 см2 при том же общем объеме.
Иногда размер частиц или вид лекарственной формы являются определяющими факторами для реализации фармакологического эффекта лекарства. Например, абсорбция гризеофульвина или солей лития возможна только в том случае, если они имеют вид мельчайших частиц, поэтому все лекарственные формы этих средств представляют собой микрокристаллические суспензии, таблетки или порошки.
Пути введения. Путь введения также определяет скорость поступления лекарства в системный кровоток. В ряду внутривенное > внутримышечное > подкожное введение скорость поступления лекарства в организм уменьшается и время развития эффекта лекарства замедляется. Иногда путь введения может определять характер действия лекарства. Например, раствор сульфата магнезии при пероральном введении оказывает послабляющее действие, при введении в мышцу он оказывает гипотензивный эффект, а при внутривенном введении – наркотическое действие.
Различают 3 вида эквивалентности:
-
Химическая (фармацевтическая) эквивалентность – означает, что 2 лекарственных препарата содержат одно и то же лекарственное вещество в равных количествах и в соответствии с действующими стандартами (фармакопейными статьями). При этом неактивные ингридиенты лекарственных препаратов могут различаться. Например, таблетки ренитека и энама по 10 мг являются химически эквивалентными, т.к. содержат по 10 мг эналаприла малеата (ингибитора АПФ).
-
Биоэквивалентность – означает, что два химически эквивалентных лекарственных препарата различных производителей при введении в организм человека в равных дозах и по одинаковой схеме всасываются и поступают в системный кровоток в равной степени, т.е. обладают сопоставимыми показателями биодоступности. Доказательство биоэквивалентности генерического лекарственного препарата его брендовому аналогу – необходимое условие регистрации любого генерического препарата.
-
Терапевтическая эквивалентность. Данное понятие означает, что 2 лекарственных препарата, содержащих одно и то же лекарственное средство, которые применяют в равных дозах и по одинаковой схеме вызывают сопоставимый терапевтический эффект. Терапевтическая эквивалентность не зависит от биоэквивалентности лекарственных препаратов.
