
- •Одесский национальный политехнический университет
- •Часть первая теоретические основы химической технологии
- •Раздел 1. Понятие химическая технология и химического производство
- •Раздел 2. Основные закономерности химической технологии
- •Раздел 1
- •Определение технологии как науки. Механическая и химическая технология
- •1.2. Содержание и структура курса "общая химическая технология", его роль в химико-технологическом образовании
- •1.10. Методы химической технологии
- •Раздел 2 основные закономерности химической технологии
- •2.1.4. Взаимосвязь между показателями хтп
- •2.2. Гомогенные химико-технологические процессы
- •2.3. Гетерогенные (некаталитические) химико-технологические процессы
- •2.4. Каталитические химико-технологические процессы
- •1. Достаточно высокой активностью относительно реакции
- •2. Минимальной продолжительностью контактирования
- •4. Стойкостью к действию контактных ядов.
- •6. Большой удельной поверхностью.
2.2. Гомогенные химико-технологические процессы
Гомогенными называются процессы, которые происходят в однородной среде - жидкости или газообразной смеси, в которой поверхность раздела между отдельными ее частями или компонентами отсутствуюет. Гомогенные процессы в промышленности встречаются довольно редко. В самом деле гомогенную систему получить тяжело. Любое вещество содержит следы разных примесей, которые находятся в другой фазе. Так, даже в 1 мл дистиллированной воды содержится от 20000 до 30000 частичек пыли.
В гомогенных процессах реакции происходят в объеме, как правило, значительно быстрее чем в гетерогенных. Осуществление и управление технологическими гомогенными процессами значительно проще и легче, поэтому многие промышленные гетерогенные процессы стараются перевести в гомогенные
В промышленности для реализации гомогенных химико-технологических процессов довольно часто осуществляют операции, которые предшествуют химическому взаимодействию, а именно: поглощение газов жидкостями или конденсацию паров, растворение или плавление твердых материалов. В обеих случаях получают жидкофазные системы. Вследствие выпаривания жидкостей или выделения из них в газовую фазу полезных компонентов получают гомогенные газофазные системы. Примером процесса, который реализуется как жидкофазный, может быть получение этанола: во время процесса сернокислотной гидратации этилена сначала серная кислота абсорбирует этилен, а уже потом гомогенно в жидкой фазе образуется этилсерная кислота, которая в дальнейшем гидролизуется с выделением целевого продукта - этанола:
![]()
Гомогенные процессы в газовой фазе широко используют в технологии неорганических и органических веществ, например, в производстве серной, азотной и соляной кислот, хлорирование и нитрование органических соединений и т.п.. Для реализации гомогенного газофазного процесса в технологии органических веществ сконденсированное органическое соединение сначала испаряют, а потом в газовой фазе осуществляют его взаимодействие с определенным реагентом: хлором, оксидом серы (IV), кислородом (воздухом), оксидами азота и т.п..
Гомогенные жидкофазные процессы в промышленности используют значительно чаще. К гомогенным жидкофазным процессам принадлежат реакции нейтрализации и обмена в технологии минеральных солей, а в технологии органических веществ - получение простых и сложных эфиров, полимеризация в растворах и расплавах, щелочное плавление бензосульфокислот в производстве фенола, отдельные стадии сернокислотной гидратации этилена в производстве этилового спирта и прочие.
В гомогенной среде (газо- и жидкофазной) много процессов происходит по цепному механизму: окисление, полимеризация, пиролиз углеводородов, синтез хлористого водорода и т.п.
2.2.1. Скорость гомогенных процессов
Для обоснованного выбора оптимальных условий осуществления химико-технологического процесса нужно владеть информацией о скорости реакции в зависимости от ряда факторов, т.е. знать кинетику процесса. Химическая кинетика изучает закономерности хода термодинамически возможных реакций во времени и их механизм. Скорость химической реакции определяется изменением концентрации определенного компонента в реакционной системе за единицу времени в единице объема.
Гомогенные процессы преимущественно происходят в кинетической области, т.е. скорость процесса определяется скоростью химической реакции. Поэтому все закономерности, характерные для химической реакции, есть общими для всего жидкофазного или газофазного процесса. Скорость химических реакций в жидкой фазе, как правило, на несколько порядков выше, чем в газах (при той же температуре), но скорость диффузии в жидкостях значительно меньше, чем в газах из за их высокой вязкости. Так, коэффициент диффузии в газах составляет 0,1...1, а в жидкостях-
10-4…10-5см2/с.
В зависимости от механизма, все реакции разделяют по молекулярности на: мономолекулярные, бимолекулярные, тримолекулярные. Молекулярность реакции определяется количеством молекул, которые принимают участие в каждом элементарном акте реакции. Она не равняется сумме стехиометрических коэффициентов перед реагентами в уравнении реакции, а определяется изучением механизма.
К
мономолекулярным принадлежат реакции
внутримолекулярных перегруппировок
![]() (изомеризация,
инверсия и т.п.) и реакции разложения
(изомеризация,
инверсия и т.п.) и реакции разложения
![]() .
Примерами мономолекулярных реакций
является плазмохимическая диссоциация
сероводорода; дегидратация этанола,
разложение оксида азота (V):
.
Примерами мономолекулярных реакций
является плазмохимическая диссоциация
сероводорода; дегидратация этанола,
разложение оксида азота (V):

Бимолекулярные - это реакции в элементарном акте которых принимают участие две молекулы. Эти реакции встречаются чаще всего. К бимолекулярным принадлежат такие реакции:
-
присоединение:
![]() или
или
![]() ,
например,
,
например,
![]()
-разложение:
![]() , или
, или![]() например,
например,
![]()
-замещения
(обмена)
![]() или
или![]()
например,
![]()
Тримолекулярные реакции происходят вследствие взаимодействия между тремя молекулами. Такие реакции встречаются сравнительно редко, по обыкновению они происходят постадийно. К тримолекулярным реакциям принадлежат:
—
присоединение:
![]() ,
,![]() ,
например,
,
например,
![]()
-обмена:
![]() ,
например,
,
например,
![]()
-
рекомбинации:
![]() .
.
Реакций большей молекулярности не бывает, поскольку вероятность одновременной встречи большего количества реагирующих молекул очень мала.
Согласно закону действующих масс - при постоянной температуре скорость химических реакций прямо пропорциональная концентрации реагирующих веществ - и для химической реакции
![]()
будет иметь такой вид:
![]() (2.47)
(2.47)
![]() (2.48)
(2.48)
![]() (2.49)
(2.49)
![]() (2.50)
(2.50)
где
![]() - скорости
реакций соответственно за веществами
A,
B,
R,
S;
CA
,CB
,CR
,CS-
концентрации исходных веществ и продуктов
реакции; kA,
kB,
kR,
kS
-константы
скорости реакций по веществам,
соответственно А,
В, R,
S.
- скорости
реакций соответственно за веществами
A,
B,
R,
S;
CA
,CB
,CR
,CS-
концентрации исходных веществ и продуктов
реакции; kA,
kB,
kR,
kS
-константы
скорости реакций по веществам,
соответственно А,
В, R,
S.
В вышеприведенных формулах концентрации веществ записываются в показателях степеней, которые отвечают стехиометрическим коэффициентам в уравнении этой реакции. Это справедливо для идеального случая. Для реальных процессов в большинстве случаев показатели степеней отличаются от стехиометрических коэффициентов и их определяют исключительно экспериментально. В связи с этим введено понятия - порядок реакции (n). Порядок реакции - это сумма показателей степеней при концентрациях реагирующих веществ в кинетическом уравнении реакции. Учитывая это, кинетические уравнения реакции будут иметь вид
![]() (2.51)
(2.51)
![]() (2.52)
(2.52)
![]() (2.53)
(2.53)
![]() (2.54)
(2.54)
где
![]() -
неизвестные
показатели степеней за концентраций
реагирующих веществ, соответственно
А,
В, R,
S,
-
неизвестные
показатели степеней за концентраций
реагирующих веществ, соответственно
А,
В, R,
S,
Сумма
![]() -
это порядок прямой реакции, а сумма
-
это порядок прямой реакции, а сумма![]() - порядок обратимойреакции.
- порядок обратимойреакции.
Различают реакции нулевого, первого, второго, третьего и дробного порядков.
В реакциях нулевого порядка скорость не зависит от концентрации реагента и равняется константе скорости.
![]() (2.55)
(2.55)
Скорость реакции первого порядка можно описать таким уравнением:
![]() (2.56)
(2.56)
или после интегрирования
![]() (2.57)
(2.57)
где СА,0 - начальная концентрация вещества А, кмоль/м3 ; СА,Х— уменьшение
концентрации вещества А (или же увеличение концентрации продуктов) за время реакции τ, кмоль/м3 ; к - константа скорости реакции, с-1, мин-1, ч-1; ω -скорость реакции, кмоль/ч м3.
Скорость реакции второго порядка опишется такими уравнениями:
![]() (2.58)
(2.58)
где СВХ - уменьшение концентрации реагента В; к — константа скорости реакции,
кмоль-1·ч-1·м3
ипи
![]() (2.59)
(2.59)
Если исходные вещества реагируют в эквимолекулярных количествах (СА,0=СВ,0 ) то уравнение (2.58) приобретает вид
![]() (2.60)
(2.60)
или
![]() (2.61)
(2.61)
Скорость реакции третьего порядка, если СА,0 =СВ,0 =СС,0- будет иметь вид
![]() (2.62)
(2.62)
или
![]() (2.63)
(2.63)
Если
концентрация одной из исходных
веществ не равняется концентрациям
двух других (СА,0
![]() СВ,0
=СС,0),
то уравнение скорости этой реакции
будет иметь вид
СВ,0
=СС,0),
то уравнение скорости этой реакции
будет иметь вид
![]() (2.64)
(2.64)
или
![]() (2.65)
(2.65)
Из уравнений (2.55 - 2.65) видно, что каждому типу реакций отвечает свое выражение для определения константы скорости.
Для технологических расчетов скорость реакции выгоднее выражать через степень превращения основных исходных реагентов хА. Тогда скорость реакции первого порядка запишется
![]() (2.66)
(2.66)
или после интегрирования
![]() (2.67)
(2.67)
Скорость реакции второго порядка запишется (для реагентов, взятых в эквимолекулярных количествах)
![]() (2.68)
(2.68)
и соответственно
![]() (2.69)
(2.69)
Скорость реакции третьего порядка запишется (для реагентов, которые реагируют в эквимолярных количествах)
![]() (2.70)
(2.70)
На практике довольно часто встречаются реакции дробового порядка, в которых сумма показателей степеней в кинетическом уравнении не равняется целому числу. Преимущественно такими реакциями есть сложные многостадийные или каталитические, отдельные стадии хода которых лимитируют скорость всего процесса. Например, скорость тримолекулярного процесса
![]()
описывается кинетическим уравнением
![]()
т.е. общий порядок прямой реакции равняется 1,8.
2.2.2. Влияние разных факторов на скорость гомогенного ХТП
Экономическая
эффективность любого химического
производства определяется
основными технологическими показателями
- производительностью и интенсивностью.
Эти показатели зависят от скорости
гомогенной химической реакции, которая
происходит
на молекулярном уровне (на микроуровне).
Рассмотрим способы увеличения
скорости химической реакции![]() ,
которая
описывается уравнением
,
которая
описывается уравнением
![]() (2.71)
(2.71)
где п - порядок реакции.
Константа скорости к определяется по уравнению Аррениуса
![]() (2.71)
(2.71)
где к0 - предэкспоненциальный множитель; Е - энергия активации реагирующих веществ, Дж/моль; Т- температура, К; R- газовая постоянная.
Подставив уравнение (2.72) в (2.71), получим
![]() (2.71)
(2.71)
Из приведенного уравнения видно, что скорость реакции зависит, прежде всего, от температуры и концентрации реагентов. Для газофазных процессов увеличение концентрации реагирующих веществ достигается повышением давления. Ускорение реакции достигается также уменьшением энергии активации, т.е. применением катализатора. Итак, на скорость гомогенных химических процессов влияют температура, концентрации реагирующих веществ, давление и катализатор
![]() (2.74)
(2.74)
Однако то, насколько существенно влияет тот или иной параметр на скорость гомогенной реакции, зависит от фазового состояния реакционной среды. В частности, скорость жидкофазных некаталитических процессов зависит лишь от температуры и концентрации реагентов
![]() (2.75)
(2.75)
Давление практически не влияет на скорость жидкофазного процесса, поскольку жидкости принадлежат к средам, которые не сжимаются.
В отличие от жидкофазных процессов скорость гомогенных газофазных реакций существенным образом зависит, кроме температуры и концентрации реагентов, еще и от давления в системе. Поэтому скорость гомогенного газофазного некаталитического ХТП выражается такой функциональной зависимостью:
![]() (2.76)
(2.76)
Скорость каталитического гомогенного процесса зависит, очевидно, еще и от активности катализатора, поэтому функциональные зависимости для разных процессов есть такими:
-для газофазного:
![]() (2.71)
(2.71)
-для жидкофазного:
![]() (2.71)
(2.71)
2.2.1.1. Влияние температуры
Из уравнение (2.72) видно, что повышение температуры однозначно приводит к росту константы скорости реакции. Константу скорости к2 при некоторой температуре Т2 можно определить из уравнение Аррениуса, если известны энергия активации (Е) и константа скорости к1 при температуре Т1. Для этого запишем выражение уравнения Аррениуса для двух температур:
![]() (2.79)
(2.79)
![]() (2.80)
(2.80)
Из них найдем значение предэкспоненциального множителя:
![]() (2.81)
(2.81)
![]() (2.82)
(2.82)
Приравняв значения к0, найдем значение к2:
![]() (2.83)
(2.83)
Однако увеличение температуры не всегда однозначно ускоряет химический процесс. Рассмотрим влияние температуры на скорости реакций разных типов.
Для
простой необратимой реакции![]() ,
независимо
от ее теплового эффекта,
повышение температуры приводит к
увеличению скорости процесса по
экспонентному закону (рис. 2.3), а зависимость
выхода продукта от температуры имеет
S-
подобный характер (рис.
2.4).
,
независимо
от ее теплового эффекта,
повышение температуры приводит к
увеличению скорости процесса по
экспонентному закону (рис. 2.3), а зависимость
выхода продукта от температуры имеет
S-
подобный характер (рис.
2.4).

Рис. 2.3. Зависимость скорости реакции от температуры для простой
необратимой
реакции
![]()
В этом случае действует эмпирическое правило Вант-Гоффа. Согласно нему с повышением температуры на 10 градусов скорость реакции возрастает в 2...4 раза
![]() (2.84)
(2.84)
где γ - температурный коэффициент скорости реакции; кТ+10 , кТ - константы скорости реакции при температурах соответственно (Т+10) иТ.

Рис.
2.4. Зависимость степени превращения от
температуры для простой необратимой
реакции
![]()
Но это правило приближенно может использоваться лишь в интервале средних температур 283...473 К и при энергии активации в пределах 60...120 кДж/моль. Температурный коэффициент γ уменьшается со снижением энергии активации и повышением температуры, приближаясь к единице при высоких температурах.

![]() (2.85)
(2.85)
Рис. 2.5. Зависимость логарифма константы скорости реакции от обратной температуры
Определив
экспериментально величины константы
скорости конкретной
реакции хотя бы при трех температурах,
строят график в координатах
![]() ,
который имеет вид прямой (рис. 2.5). При
этом
,
который имеет вид прямой (рис. 2.5). При
этом
![]() (2.86)
(2.86)
По влиянию температуры на скорость процесса можно также определить значение коэффициентов диффузии в разных средах.
Для газов температурную зависимость коэффициента диффузии DГ можно выразить такой упрощенной формулой
![]() (2.87)
(2.87)
где β - эмпирический коэффициент, который зависит от молекулярной массы диффундирующих веществ; Р - общее давление газа в системе; а- показатель степени, а= 1,5...2,0.
Для растворов коэффициент диффузии равняется
![]() (2.88)
(2.88)
где![]() -
эмпирический коэффициент; μ - динамический
коэффициент вязкости среды.
-
эмпирический коэффициент; μ - динамический
коэффициент вязкости среды.
В
случае протекания обратимого
экзотермического процесса
![]() с повышением температуры уменьшается
значение константы равновесия, т.е.
понижается равновесный выход продукта,
и при некотором повышении температуры
кинетика процесса начинает противоречить
его термодинамике.
с повышением температуры уменьшается
значение константы равновесия, т.е.
понижается равновесный выход продукта,
и при некотором повышении температуры
кинетика процесса начинает противоречить
его термодинамике.
Скорость
простой обратимой реакции
![]() опишется такими уравнениями:
опишется такими уравнениями:
![]() (2.89)
(2.89)
где к1 и к2- константы скорости соответственно прямой и обратимой реакций.
Выразим константу скорости обратимой реакции к2 через константу равновесия КС и константу скорости прямой реакции к1 а текущую концентрацию исходного реагента СА и продукта СR через начальную концентрацию исходного реагента СA,0 и степень превращения хА:
![]()
Тогда
 (2.90)
(2.90)
Из
полученного уравнения видно, что
для хА
=
const
с
увеличением температуры скорость, с
одной стороны, возрастает вследствие
увеличения значения одного из членов
произведения
![]() в
уравнении
(2.90), а с другой - уменьшается, так как
значение константы равновесия Кс
с
повышением температуры падает. Итак, с
увеличением температуры скорость
процесса сначала возрастает, достигая
максимального
значения. Потом по мере приближения к
равновесному состоянию она уменьшается
вследствие того, что начинает преобладать
скорость обратимой реакции.
Т.е. зависимость скорости от температуры
имеет экстремум (рис. 2.6, а). Значение
температуры, которое отвечает точке
экстремума, называется оптимальной
температурой Топт.
Итак,
оптимальной называют температуру, при
которой достигается максимальная
скорость процесса. Линия, которая
проходит через эти
экстремумы, называется линией оптимальных
температур (ЛОТ) (рис. 2.6, бы, кривая
АВ).
Применяя
ЛОТ, можно регулировать ход технологического
процесса так, чтобы достичь максимальной
степени превращения.
в
уравнении
(2.90), а с другой - уменьшается, так как
значение константы равновесия Кс
с
повышением температуры падает. Итак, с
увеличением температуры скорость
процесса сначала возрастает, достигая
максимального
значения. Потом по мере приближения к
равновесному состоянию она уменьшается
вследствие того, что начинает преобладать
скорость обратимой реакции.
Т.е. зависимость скорости от температуры
имеет экстремум (рис. 2.6, а). Значение
температуры, которое отвечает точке
экстремума, называется оптимальной
температурой Топт.
Итак,
оптимальной называют температуру, при
которой достигается максимальная
скорость процесса. Линия, которая
проходит через эти
экстремумы, называется линией оптимальных
температур (ЛОТ) (рис. 2.6, бы, кривая
АВ).
Применяя
ЛОТ, можно регулировать ход технологического
процесса так, чтобы достичь максимальной
степени превращения.
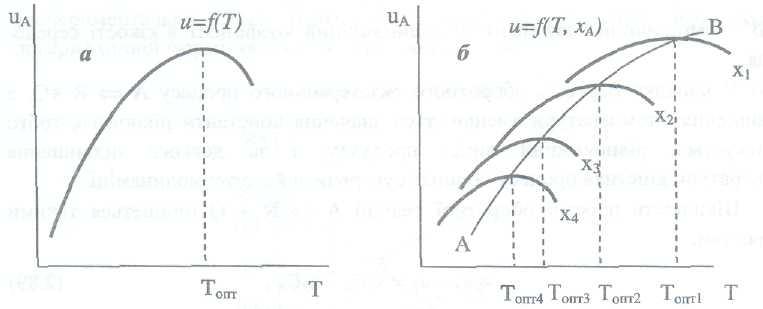
Рис.
2.6. Зависимость скорости простой обратимой
экзотермической реакции
![]() от
температуры (хї<х2<хз<х4)
от
температуры (хї<х2<хз<х4)
Зависимость степени превращения от температуры в обратимой экзотермический реакции также имеет экстремальный вид (рис. 2.7,а). На начальных стадиях процесса степень превращения закономерно возрастает, так как скорость прямой реакции увеличивается (рис. 2.7,а). Но до некоторой температуры Тi при которой начинает увеличиваться скорость обратной реакции. Вследствие этого часть образованного продукта превращается в исходное вещество - прирост степени превращения при этом уменьшается. Дальнейший ход процесса приводит к еще большему повышению температуры и соответственному ускорению обратной реакции - система приближается к состоянию равновесия, которое характеризуется равновесной кривой х* .


Рис.
2.7. Зависимость степени превращения от
температуры для
простой обратимой экзотермической
реакции
![]()
![]()
Если процесс продолжить, то температура приобретает значения, при которых равновесие смещается в левую сторону, а степень превращения уменьшается. Кривая АВ, которая проходит через максимумы (рис. 2.7,6), отображает зависимость степени превращения от температуры и называется линией оптимальных температур или линией оптимальной температурной последовательности (ЛОТП). Она показывает, что для обратимой экзотермической реакции существует не четко определенная оптимальная температура, а определенная температурная последовательность, которая обеспечивает максимальную скорость процесса. Итак, для достижения степени превращения, который по значению приближается к равновесному, технологический процесс необходимо осуществлять по ЛОТ (ЛОТП).
Для
простой обратимой эндотермической
реакции![]() .
влияние
температуры
на степень превращения является
однозначным как по кинетике, так и по
термодинамике
процесса. С повышением температуры
увеличивается скорость реакции,
а также равновесная (
.
влияние
температуры
на степень превращения является
однозначным как по кинетике, так и по
термодинамике
процесса. С повышением температуры
увеличивается скорость реакции,
а также равновесная (![]() )
и фактическая (
)
и фактическая (![]() )степени
превращения (рис.
2.8, 2.9).
)степени
превращения (рис.
2.8, 2.9).
Иногда, особенно в технологии органических веществ, с повышением температуры проходят побочные реакции с большим температурным коэффициентом, чем у основной. Выход продукта в этих условиях может сильно снижаться, еще не приближаясь к состоянию равновесия. Такая зависимость наблюдается при синтезе метанола, высших спиртов и многих других продуктов органического синтеза. Поэтому необходимо рассмотреть влияние температуры на селективность процесса.

Рис. 2.8. Зависимость скорости простой обратимой эндотермической
реакции
![]() от
температуры(х1<х2<х3)
от
температуры(х1<х2<х3)

Рис. 2.9. Зависимость степени превращения от температуры для простой обратимой эндотермической реакции
Рассмотрим
параллельную реакцию вида
![]() , для которой дифференциальная
селективность запишется уравнением
, для которой дифференциальная
селективность запишется уравнением
 (2.91)
(2.91)
где -Sdif- селективность; ωR - скорость основной реакции; ωS - скорость побочной реакции.
Подставив значение ωR и ωS в формулу (2.91), находим
 (2.92)
(2.92)
Как видно из приведенного уравнения, все величины, которые у него входят (за исключением температуры), являются постоянными. Зависимость селективности от температуры является прямопропорциональной. Для каждого последовательного процесса существует наиболее выгоднейшая температура (Топт) как с точки зрения термодинамики, так и с точки зрения кинетики, при которой достигается определенная селективность, в итоге - экономичность процесса.
Итак, температура является мощным фактором, но им не всегда можно воспользоваться для улучшения показателей химико-технологических процессов. Так, порой повышение температуры ограничивается:
возможным выпариванием и образованием побочных продуктов;
снижением прочности и механической стойкости материалов, из которых изготовлены аппараты и коммуникации химических производств;
уменьшением степени превращения и, соответственно, выхода продукта в обратимых экзотермических реакциях;
возможным снижением селективности сложных реакций.
Итак, выбор температуры является сложным заданием. Оптимальные температуры процессов зависят от природы реагентов и их концентраций, необходимой степени превращения исходных веществ в продукты реакции, давления, поверхности контакта реагирующих фаз, интенсивности их перемешивания, а также от активности катализаторов.
2.2.2,2. Влияние концентрации реагентов
Анализируя уравнения (2.47-2.50), которые описывают скорость химических процессов, можно утверждать, что концентрация реагирующих веществ имеет существенное влияние на скорость реакций всех типов, кроме нулевого. С увеличением концентрации скорость реакции однозначно возрастает. Изменение концентрации как реагентов, так и продуктов во времени непосредственно характеризует кинетику процесса.
На
примере простой необратимой реакции ,
![]() определим,
какой характер имеет
изменение концентрации реагентов во
времени.
определим,
какой характер имеет
изменение концентрации реагентов во
времени.
Скорость реакции равняется
![]() или
или
![]() (2.93)
(2.93)
Проинтегрируем это уравнение:
 (2.94)
(2.94)
и получим
![]() (2.95)
(2.95)
откуда
![]() (2.96)
(2.96)
Так, текущая концентрация реагента во времени изменяется по экспоненциальной зависимости
![]() (2.97)
(2.97)
Рассмотрим влияние концентрации реагентов на ход разных по сложности гомогенных процессов.
Для
простой необратимой реакции
![]() изменение
концентрации основныхисходных
реагентов и продуктов реакции
характеризуется кривыми, приведенными
на рис.
2.10.
изменение
концентрации основныхисходных
реагентов и продуктов реакции
характеризуется кривыми, приведенными
на рис.
2.10.

Рис.
2.10. Изменение концентрации реагента А
(1) и продукта R
(2) для простой мономолекулярной
необратимой реакции
![]()
Как видно из рис. 2.10, концентрация реагента А уменьшается во времени от начального значения (САо) практически к нулю, а концентрация продукта (СR) возрастает для необратимых процессов от нуля до достижения почти полного превращения реагента в продукт (хR=1). Влияние концентрации тем больше, чем выше порядок реакции. Поэтому концентрированием (обогащением) сырья можно значительно увеличить скорость реакции. Например, для реакций второго порядка увеличение концентрации исходных веществ вдвое дает возможность ускорить химическую реакцию в четыре раза.
На практике чаще встречаются сложные реакции, которые охватывают несколько элементарных. К ним принадлежат обратные, параллельные, последовательные. Каждая из них также подчиняется закону действия масс.
Рассмотрим
простейшую мономолекулярную обратную
реакцию![]() .
В
кинетическом уравнении для такой реакции
учитывают скорости прямой и обратной
реакций.
Скорость обратной реакции равняется
разности скоростей прямой и обратной
реакций, а потому ее можно выразить
такими уравнениями:
.
В
кинетическом уравнении для такой реакции
учитывают скорости прямой и обратной
реакций.
Скорость обратной реакции равняется
разности скоростей прямой и обратной
реакций, а потому ее можно выразить
такими уравнениями:
-по
реагенту А:![]() ,
,
![]()
—по
продукту R:
![]()
где
k1,
k2-
константы скоростей соответственно
прямой и обратной реакций; СА,
СR
- концентрации
реагента А
и
продукта R
в
определенный момент протекания процесса;
![]() - равновесная
концентрация реагента А.
- равновесная
концентрация реагента А.
Изменение
концентрации исходного реагента А
во
времени для мономолекулярной обратимой
реакции
![]() изображено
на рис. 2.11.
изображено
на рис. 2.11.

Рис.
2,11. Изменение концентрации реагента А
(1) и продукта R
(2) для простой мономолекулярной обратимой
реакции
![]()
Как
видно из рис. 2.11, концентрация исходного
реагента СА
уменьшается
до
равновесной СА
(при
данных условиях), а концентрация продукта
возрастает и достигает равновесного
значения, которому отвечает равновесная
степень превращения
![]() .
.
Среди
сложных реакций очень часто встречаются
параллельные, которые описываются общим
уравнением вида
![]() ,
где R
- целевой продукт, S-
побочный.
,
где R
- целевой продукт, S-
побочный.
Классическим примером таких реакций являются окисление аммиака в производстве азотной кислоты. В зависимости от условий осуществления технологического процесса, могут происходить такие параллельные реакции:

В параллельных реакциях скорость превращения исходного реагента равняется
![]() (2.98)
(2.98)
а скорости образования целевого продукта R и побочного S соответственно
![]() (2.99)
(2.99)
![]() (2.100)
(2.100)
Изменение концентраций реагента и продуктов R и S во времени для простейшего случая параллельных реакций приведены на рис. 2.12.

Рис. 2.12. Изменение концентрации реагента А (І), целевого продукта R (2) и побочного S (3) во времени для параллельной реакции, если к1 > к2
Как видно из рис. 2.12, степень превращения реагентa А в основной продукт R очень зависит от соотношения констант скоростей основной и побочной реакций к1 и к2.
Чем большая константа скорости основной реакции, тем выше степень превращения исходного реагента и выход основного продукта.
Последовательные реакции довольно распространены, в частности, в органическом синтезе. В последовательных реакциях образующийся промежуточный продукт превращается в конечный вследствие ряда таких реакций, как хлорирование, нитрование, сульфирование, окисление углеводородов и т.п.. Например, хлорирование бензола можно описать такой упрощенной схемой:
![]()
При синтезе метанола образуется целевой продукт и побочный продукт – диметиловый эфир:
![]()
Для
последовательной необратимой реакции
![]() скорость
скорость
превращения
исходного реагента в целевой продукт
R,
который
в этом случае является промежуточным,
равняется
![]() ,
скорость
образования целевого продукта
,
скорость
образования целевого продукта
![]() ,
а
конечного -
,
а
конечного -
![]() .
.
Изменение концентраций компонентов реакционной смеси во времени в случае
хода
последовательной реакции типа
![]() приведенная на рис. 2.13. Как
видно из рис. 2.13, для возможно большего
выхода целевого продукта R
необходимо
не только наибольшее соотношение к1/к2,
но
и оптимальное время осуществления
процесса, так как с увеличением
продолжительности процесса целевой
продукт R
будет превращаться в нежелательный
побочный S.
приведенная на рис. 2.13. Как
видно из рис. 2.13, для возможно большего
выхода целевого продукта R
необходимо
не только наибольшее соотношение к1/к2,
но
и оптимальное время осуществления
процесса, так как с увеличением
продолжительности процесса целевой
продукт R
будет превращаться в нежелательный
побочный S.

Рис.
2.13. Изменение концентраций компонентов
реакционной среды в случае последовательной
реакции А —>R
—>S:
а-
к1
![]() к2;
б- к1»к2;
в-к1«к2;
1-дляА,
2- для промежуточного продукта R
(целевого), 3 - для конечного S
(побочного)
к2;
б- к1»к2;
в-к1«к2;
1-дляА,
2- для промежуточного продукта R
(целевого), 3 - для конечного S
(побочного)
Примерами таких процессов есть многочисленные окислительные процессы производства спиртов, альдегидов, кислот и других кислородосодержащих производных органических соединений, а также процессов неполного гидрирования (например, СО + 2Н2 —> -» СН3ОН).
Как видно из уравнения (2.71), скорость гомогенных процессов определяется константой скорости и концентрацией реагирующих веществ. Для увеличения скорости процесса следует найти способы увеличения этих величин, а потом выбрать среди них наиболее рациональный, который требует наименьших производственных затрат для достижения заданной Интенсивности процесса.
Увеличение концентрации можно достичь повышением содержимого взаимодействующих компонентов в исходном сырье, повышением давления, отводом продуктов реакции из реакционного объема.
Увеличение концентрации компонентов в исходном сырье повышает концентрацию и, соответственно, скорость процесса. Выбор способа концентрирования исходной сырью зависит, прежде всего, от ее агрегатного состояния (см. ч. 1, 4.42). Концентрирование сырья есть одним из наиболее распространенных средств интенсификации технологических процессов.
2.2.2.3. Влияние давления
Эффективность
применения давления зависит от агрегатного
состояния реагирующих
веществ. Целесообразно пользоваться
давлением в процессах, которые проходят
при участии газов, поскольку в этом
случае повышения давления приводит
к уменьшению объема газовой фазы и
соответственно увеличению концентрации
реагирующих веществ. Итак, для газофазных
реакций повышения давления
равноценно увеличению концентрации
реагентов. Влияние давления для модельной
необратимой реакции типа
![]() выражается
таким кинетическим
уравнением:
выражается
таким кинетическим
уравнением:
![]() (2.101)
(2.101)
где РА, Рв - парциальные давления исходных компонентов; РА = ІР и Рв = тР (где І, т -постоянные или коэффициенты пропорциональности)
![]() (1.102)
(1.102)
здесь п - порядок реакции [п = (а + Ь)].
Итак, скорость реакции пропорциональная давлению в степени, которая равняется порядку реакции, т.е. увеличением давления более всего интенсифицируются реакции высших порядков (рис. 2.14). Следует принимать во внимание, что с повышением давления может изменяться порядок реакции п и уменьшаться к.

Рис. 2.14. Влияние порядка реакции на скорость гомогенного газофазного процесса
Для
обратимых газовых процессов, которые
проходят с уменьшением объема, например,
АГ
+ ВГ<=>
RГ,
скорость
реакции и степень превращения реагента
с повышением
давления будут возрастать (рис. 2.15, 2.16)
вследствие увеличения действительных
концентраций (парциальных давлений)
компонентов Ра
и
Рв
и
уменьшения равновесных
парциальных давлений
![]() и
и
![]() ,т.е.
смещения равновесия в сторону образования
продукта. Поэтому в таких процессах
очень высокие давления использовать
невыгодно, особенно в случае, если
газовая смесь содержит значительное
количество инертных примесей.
,т.е.
смещения равновесия в сторону образования
продукта. Поэтому в таких процессах
очень высокие давления использовать
невыгодно, особенно в случае, если
газовая смесь содержит значительное
количество инертных примесей.
Оптимальные значения давления для разных процессов колеблются в очень широких границах. Большое количество важных производственных процессов, в частности таких, как синтез аммиака, метанола, производство бензина гидрированием трудного топлива и т.п., которые происходят с уменьшением газового объема, осуществляются только благодаря использованию высоких давлений (свыше 10 МПа).
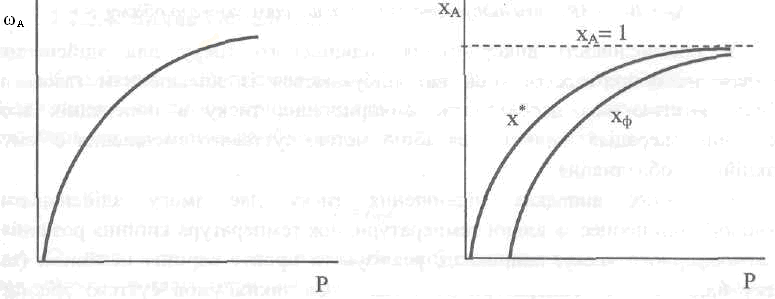
|
Рис. 2.15. Зависимость скорости простой обратимой реакции
АГ
+ ВГ |
Рис. 2.16. Зависимость степени
превращения
от давления для простой обратимой
реакции АГ
+ ВГ
|
На
обратимые газовые реакции, которые
проходят с увеличением объема, например,
АГ
+ ВГ![]() 3RГ
,
давление
влияет положительно при условии, если
реакционная система
еще не приблизилась к положению равновесия
вследствие увеличения действительных
концентраций исходных реагентов РА
и
Рв.
Но
при приближении к положению
равновесия зависимость выхода продукта
от давления проходит через максимум,
а потом уменьшается (рис. 2.17). Значение
оптимального давления Ропт
зависит
от характера реакции, ее порядка п
и
от заданной степени превращения Ха-
3RГ
,
давление
влияет положительно при условии, если
реакционная система
еще не приблизилась к положению равновесия
вследствие увеличения действительных
концентраций исходных реагентов РА
и
Рв.
Но
при приближении к положению
равновесия зависимость выхода продукта
от давления проходит через максимум,
а потом уменьшается (рис. 2.17). Значение
оптимального давления Ропт
зависит
от характера реакции, ее порядка п
и
от заданной степени превращения Ха-

Рис.
2.17.
Зависимость степени превращения от
давления для обратимой реакции
АГ
+ ВГ![]() 3RГ,
которая проходит с увеличением газового
объема
3RГ,
которая проходит с увеличением газового
объема
В промышленности использования повышенного давления для осуществления газофазных обратных реакций, которые происходят с увеличением газового объема, определяется необходимостью использования давления в предыдущих или последующих операциях производства или с целью существенного уменьшения объема реакционного оборудования.
В некоторых случаях повышения давления дает возможность осуществлять технологический процесс при более высокой температуре, чем температура кипения растворов при атмосферном давлении, например, реализовать процесс варки целлюлозы (за давления 6...8 МПа и температуры 313...323К). При таких условиях существенно возрастает скорость процесса и отсутствует кипение раствора.
Отвод продуктов реакции из реакционной зоны увеличивает результирующую скорость реакции
![]() (2.103)
(2.103)
где
![]() и
и
![]() - скорости прямой и обратной реакций,
вследствие уменьшения скорости
обратимой реакции.
- скорости прямой и обратной реакций,
вследствие уменьшения скорости
обратимой реакции.
Если
реакция происходит в газовой фазе, то
перевод продукта в жидкую
или твердую фазу означает уменьшение
СА*
практически
до нуля. Из газовой смеси
продукт можно отводить конденсацией,
избирательной абсорбцией, адсорбцией
и т.п.. Во многих производствах для этого
газовую смесь выводят из реактора, а
потом после отделения продукта снова
возвращают в аппарат. Такие процессы
являются циклическими (круговыми), они
осуществляются постадийно. На каждой
стадии концентрация продукта
![]() возрастает
до максимальной величины, а потом -после
его отделения от реакционной смеси,
уменьшается до величины, близкой к
нулю. Из жидкой смеси продукты реакции
отводятся в зависимости от их свойств
кристаллизацией, выпариванием
(десорбцией), адсорбцией и т.п.Осаждение
кристаллов с последующим возвращением
маточного раствора в процесс часто
используют в технологии минеральных
солей, например, в производстве хлорида
калия, сульфата аммония.
Десорбцию паров растворенного вещества
используют для очистки газов и в
технологии органических веществ.
Примером таких процессов является
десорбция бензола из солярового масла
при переработке коксового газа.
возрастает
до максимальной величины, а потом -после
его отделения от реакционной смеси,
уменьшается до величины, близкой к
нулю. Из жидкой смеси продукты реакции
отводятся в зависимости от их свойств
кристаллизацией, выпариванием
(десорбцией), адсорбцией и т.п.Осаждение
кристаллов с последующим возвращением
маточного раствора в процесс часто
используют в технологии минеральных
солей, например, в производстве хлорида
калия, сульфата аммония.
Десорбцию паров растворенного вещества
используют для очистки газов и в
технологии органических веществ.
Примером таких процессов является
десорбция бензола из солярового масла
при переработке коксового газа.
2.2.2,4. Влияние катализатора
Катализаторы оказывают очень большое влияние на скорость химических процессов. Катализатор дает возможность ускорить процесс вследствие уменьшения энергии активации, которая приводит к увеличению константы скорости
![]()
Одной из теорий, с помощью которой объясняется положительное влияние присутствия катализаторов на скорость процесса, есть теория активированного комплекса. Согласно ней катализатор изменяет маршрут реакции, заменяя одностадийный процесс многостадийным. На промежуточных стадиях образовываются активированные комплексы, образованные реагентами и катализатором. При этом как энергия активации каждой из промежуточных стадий, так и суммарная энергия активации процесса являются значительно меньшими по сравнению с некаталитической реакцией.
Пусть происходит некаталитическая реакция А + В —>R , энергия активации которой равняется Е. В присутствии катализатора на первой стадии происходит взаимодействие одного из реагентов с катализатором
![]()
а энергия активации этой реакции Е1. На второй стадии происходит взаимодействие активированного комплекса А[каі]* с другим реагентом, вследствие чего образовывается продукт R :некаталитический и каталитический процессы приведены на рис. 2.18.
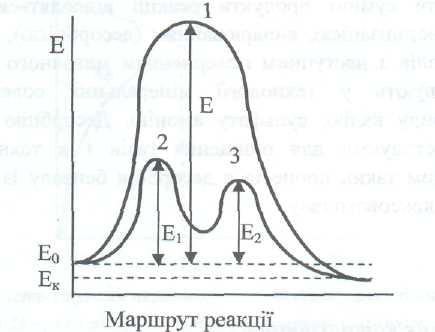
Рис. 2.18. Энергетическая диаграмма состояний 1некаталитической и каталитической II реакцій ;1 -образование промежуточного соединения АВ в некаталитической реакции;
2-образование промежуточного активированного комплекса А[каг];
3-образование промежуточного активированного комплекса АВ[каі]
Если лимитирующей является первая стадия каталитического процесса (Е1 > Е2), то скорость зависит от концентраций реагента А и катализатора, а если вторая {Еі < Ег), то скорость зависит от концентраций реагентов А и В и катализатора
![]() (2.104)
(2.104)
но
![]() (2.105)
(2.105)
откуда
![]() (2.107)
(2.107)
тогда
![]() (2..107)
(2..107)
Суммарная энергия активации каталитического процесса есть меньшей, чем некаталитического: (Е1+Е2< Е). Уменьшение энергии активации каталитического процесса сравнительно с некаталитическим Е - (Еі + Е2) = ΔЕ собственное и обеспечивает ускорение реакции.
