
- •Одесский национальный политехнический университет
- •Часть первая теоретические основы химической технологии
- •Раздел 1. Понятие химическая технология и химического производство
- •Раздел 2. Основные закономерности химической технологии
- •Раздел 1
- •Определение технологии как науки. Механическая и химическая технология
- •1.2. Содержание и структура курса "общая химическая технология", его роль в химико-технологическом образовании
- •1.10. Методы химической технологии
- •Раздел 2 основные закономерности химической технологии
- •2.1.4. Взаимосвязь между показателями хтп
- •2.2. Гомогенные химико-технологические процессы
- •2.3. Гетерогенные (некаталитические) химико-технологические процессы
- •2.4. Каталитические химико-технологические процессы
- •1. Достаточно высокой активностью относительно реакции
- •2. Минимальной продолжительностью контактирования
- •4. Стойкостью к действию контактных ядов.
- •6. Большой удельной поверхностью.
2.3. Гетерогенные (некаталитические) химико-технологические процессы
2.3.1. Стадии гетерогенного ХТП
Гетерогенные ХТП проходят на поверхности раздела двух или нескольких фаз, например, в системах газ-жидкость (Г-Ж), газ-твердое тело (Г-Т), жидкость-твердое тело (Ж-Т), жидкость-жидкость (Ж-Ж, если эти жидкости не смешиваются), твердое-твердое тело (Т-Т), газ-жидкость-твердое тело (Г—Ж—Т) и т.п.. По сравнению с гомогенными, гетерогенные процессы являются значительно более сложными, так как усложняются перенос вещества в объеме фаз и через поверхность их раздела. Именно этот последний признак есть общим для всех гетерогенных процессов: химическому взаимодействию обязательно предшествует перенос реагента в объеме одной фазы к поверхности раздела фаз со следующей диффузией в объем другой фазы.
Способность реагента (или продукта химической реакции) проникать из объема одной фазы через поверхность раздела в объем другой зависит от агрегатного состояния и физических параметров фаз, которые принимают участие в гетерогенном ХТП. Чем меньшая плотность и вязкость фазы, тем интенсивнее в ней будут происходить диффузионные процессы, т.е. она будет "подвижной". Из двух или нескольких фаз наиболее подвижной будет та, плотность и вязкость которой будут наименьшими. В таких системах, как Г-Ж, Г-Т, наиболее подвижной фазой будет, очевидно, газовая; в системе Ж-Т ~ жидкостная; Ж-Ж- жидкость с меньшей вязкостью и, соответственно, меньшим поверхностным натяжением. В системах Т-Т реакции происходят лишь на поверхности контакта, диффузионные процессы при участии реагентов практически отсутствуют, а потому "подвижная" фаза в этом случае отсутствует. Взаимодействие в системе Т-Т отличают из других гетерогенных процессов и рассматривают как отдельный специфический случай - топохимический процесс.
Компоненты более подвижной фазы диффундируют в объем другой, поэтому, такая фаза "передает" реагент другой, поэтому ее называют передающей. Та фаза, в объем которой переходит реагент из передающей фазы, называется принимающая. Принято считать, что передающая фаза есть "внешней", а принимающая - "внутренней" сферой в гетерогенной системе.
Вообще гетерогенный некаталитический процесс, в котором происходит реакция, например, Аг + Вт —> Rт + Sг, (где Аг — газообразный компонент передающей фазы; Вт- твердофазный компонент принимающей фазы) охватывает такие последовательные стадии (рис. 2.19):
диффузия реагента в объем передающей фазы к поверхности раздела фаз;
диффузия реагента в объем принимающей фазы;
химическое взаимодействие между реагентом из передающей фазы и реагентом принимающей фазы;
диффузия продукта реакции в объем принимающей фазы к поверхности раздела фаз;
диффузия продукта реакции в объем передающей фазы.
Приведенную схему гетерогенного ХТП называют полной, так как она охватывает все основные стадии процесса. Такой полной схемой описывается, например, горение угля, который состоит из органической (углерод) и негорючей минеральной части, в среде воздуха. Кислород диффундирует к поверхности частички угля, адсорбируется ее поверхностью, диффундирует в объем частички порами и трещинками на встречу с химически активным углеродом, вследствие чего происходит химическая реакция
![]()
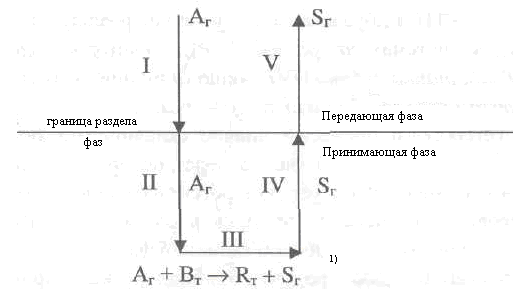
Рис. 2.19. Схема гетерогенного процесса
При реакции образуется газообразный продукт - оксид углерода (IV), который вследствие разности парциальных давлений внутри твердой частички и над ней в газовой фазе, диффундирует через слой минеральной негорючей части наружу, а потом - в объем воздуха. Но далеко не все гетерогенные процессы являются полными, т.е. охватывают все пять указанных выше стадий. Рассмотрим некоторые примеры таких неполных гетерогенных ХТП.
Если вследствие химического взаимодействия образуется вещество, которое по фазовому (агрегатному) состоянию принадлежит к принимающей фазе или растворяется в ней, то гетерогенный процесс может состоять из меньшего количества стадий: четырех или, даже, трех. Например, в системе Г—Ж образуется продукт, растворимый в жидкости; он диффундирует в жидкой среде, но переход его в газовую фазу не происходит. В частности, при поглощении из воздуха сероводорода водным раствором гидроксида натрия происходит реакция
![]()
Образовавшийся натрия гидрогенсульфид очень хорошо растворим в воде, поэтому он диффундирует лишь в растворе, а в воздух - нет. Поэтому такой процесс является четырехстадийным.
Если же в системе Г-Т или Ж-Т образуется твердый продукт, который в объеме твердого вещества, очевидно, не диффундирует, то гетерогенный процесс состоит лишь из трех первых стадий. Такой случай иллюстрируется таким химико-технологическим процессом:
![]()
Случаются также случаи, когда практически отсутствует первая стадия гетерогенного процесса. Это происходит, если передающая фаза монокомпонентна и состоит лишь из реагирующего вещества, а продукт реакции остается в принимающей фазе. Примером такого процесса является стадия карбонизации аммонизированного рассола в производстве кальцинированной соды
![]()
2.3.2. Скорость гетерогенного ХТП
Поскольку гетерогенный ХТП является сложным, многостадийным, то общая его скорость (ω) будет зависеть от скоростей каждой из стадий и будет выражаться уравнением
![]() (2.108)
(2.108)
где к - коэффициент скорости процесса; F - площадь поверхности контакта фаз; ∆С -движущая сила процесса. По сути это выражение является уравнением масопередачи. В нем коэффициент скорости процесса является сложной величиной, которая учитывает диффузионные и кинетические явления, которые существуют в гетерогенном процессе. Величина, обратная к коэффициенту скорости - 1/к, характеризует сопротивление системы ходу гетерогенного процесса
![]() (2.109)
(2.109)
где кд - константа скорости диффузионных стадий процесса (константа масопередачи); 1/кд - диффузионное сопротивление процесса; кр - константа скорости химической реакции; 1/кр - кинетическое сопротивление процесса.
Но диффузия может происходить как в передающей, так и в принимающей фазах, поэтому в общем случае
![]() (2.110)
(2.110)
где кд1 - константа скорости диффузии в передающей фазе; 1/кд1 - диффузионное сопротивление передающей фазы; кд2 - константа скорости диффузии в принимающей фазе; 1/кд2 - диффузионное сопротивление принимающей фазы.
Итак, скорость гетерогенного ХТП описывается таким общим уравнением:
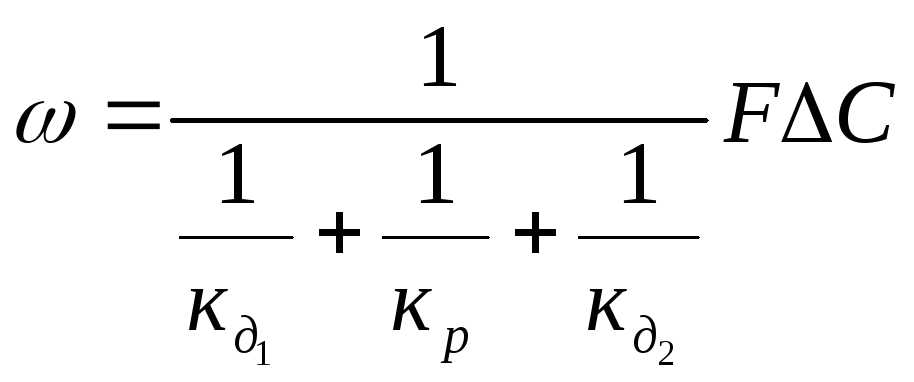 (2.111)
(2.111)
В реальных гетерогенных ХТП скорости отдельных стадий, преимущественно, существенным образом отличаются. Очевидно, что результирующая скорость всего процесса будет определяться ходом самой медленной стадии, которая называется лимитирующей стадией процесса.
Если самыми медленными являются диффузионные процессы (соответственно /, II, IV или V стадии гетерогенного ХТП), то он лимитируется диффузионными явлениями; поэтому говорят, что процесс происходит в диффузионной области. При этом, если медленнее всего происходит диффузия в передающей фазе (/ или V стадия), то процесс проходит во внешнедифузионной области. Если же медленными будет диффузия в объеме принимающей фазы (// или IV стадия), то процесс происходит во внутридиффузионной области.
В случае, когда самой медленной стадией является химическое взаимодействие (III стадия), процесс проходит в кинетической области, так как зависит от кинетических факторов. Бывает, что скорости всех стадий являются соизмеримыми, т.е. одного порядка. Тогда считают, что процесс происходит в переходной (смешанной) диффузионно-кинетической области. В этом случае общая скорость процесса равняется сумме скоростей всех стадий и для нее правильным является уравнение (2.111).
Определение области хода гетерогенного ХТП является очень важной технологической задачей, так как дает возможность выбрать средства его интенсификации и подобрать соответствующее технологическое оборудование. Область пртекания конкретного процесса чаще всего определяют экспериментально по характеру влияния разных факторов на скорость или коэффициент скорости процесса. К таким факторам относится температура, линейная скорость движения потока передающей фазы, размеры частичек принимающей фазы. Исследования выполняют, изменяя значение лишь одного параметра при постоянных значениях других.
Изменение температуры применяют для установления кинетической области протекания процесса. Следует заметить, что повышение температуры может одновременно влиять на разные по сути процессы: кинетические (химическое взаимодействие между веществами) и диффузионные. Влияние температуры на скорость химического взаимодействия можно оценить по уравнению Аррениуса (2.72).
В этом случае скорость процесса может возрастать вследствие увеличения константы скорости химической реакции. Константа скорости может увеличиваться вследствие роста скорости диффузионных стадий процесса, который, в свою очередь, объясняется уменьшением вязкости среды.
Именно по влиянию температуры на интенсивность кинетических или диффузионных явлений различают области протекания гетерогенного процесса.
Если проанализировать влияние температуры в очень широком диапазоне ее значений на скорость гетерогенного процесса, то можно выделить три характерных участка (рис. 2.20).
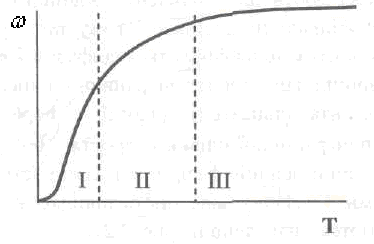
Рис. 2.20. Зависимость скорости гетерогенного ХТП от температуры Области хода процесса: /- кинетическая; II- переходная; III- диффузная
На первой наблюдается резкий рост скорости процесса с повышением температуры: так как, процесс лимитируется химическим взаимодействием. При увеличении температуры на 10 град, коэффициент скорости процесса, который в этом случае отвечает константе скорости химической реакции, возрастает в 2.,.4 раза. Увеличение коэффициента скорости реакции вследствие интенсификаций диффузии сравнительно незначительно (на 10...30 %), итак, первый участок отвечает кинетической области процесса:
![]() соответственно
соответственно
![]()
Третий участок отвечает температурному интервалу, в котором прирост температуры незначителен или и вообще не влияет на скорость процесса. В этой области скорость процесса зависит лишь от изменения физических параметров среды, прежде всего, вязкости. Уменьшение ее приводит к увеличению коэффициента диффузии компонентов системы. Поэтому эту область называют диффузионной. Температурный коэффициент в диффузионной области равняется 1,1. ..1,3, т.е.
![]() (2.112)
(2.112)
На втором, промежуточном, участке влияние температуры на скорость гетерогенного ХТП наименьшая, увеличение температуры уже не составляет такого весомого прироста скорости, как в кинетической области. Объясняется это тем, что сопротивление всех факторов ходу процесса становится соизмеримым. Значение температурного коэффициента в этой области равняется 1,3. ..2.
Изменение
скорости движения передающей фазы
(скорости потока) относительно принимающей
фазы применяют для выявления
внешнедиффузионной области процесса.
При увеличении скорости движения потока
происходит его турбулизация, вследствие
чего интенсифицируются диффузионные
явления в этой фазе за счет
уменьшения толщины ламинарной приграничной
пленки со стороны более подвижной фазы.
Соответственно константа скорости
диффузии в передающей фазе, которая
зависит
от толщины приграничной пленки δ,
возрастает
(так как kD1=D/δ).
При
этом как диффузия реагента в принимающей
фазе, так и скорость химического
взаимодействия остаются неизменными.
Графическая зависимость скорости
гетерогенного ХТП от линейной скорости
потока приведена на рис.
2.21.![]()
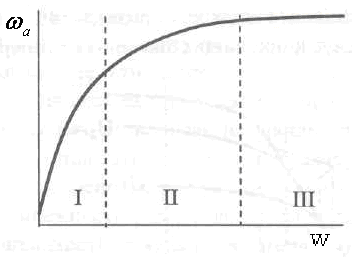
Рис. 2.21. Зависимость скорости гетерогенного ХГП от линейной скорости движения передающей фазы. Области протекания процесса: I- внешнедиффузионная;II — переходная; III — кинетическая
Участок на кривой, где наблюдается наибольшее влияние скорости потока на скорость процесса, принадлежит внешнедиффузионной области. Именно здесь наблюдается резкое уменьшение толщины приграничной пленки. Во второй области влияние скорости потока меньше, так как толщина пленки становится все меньше - эта область отвечает переходной, а та, где увеличение значения аргумента при постоянной температуре почти не влияет на ход гетерогенного ХТП (изменения толщины ламинарного слоя практически нет), - кинетической. В третьей области скорость процесса можно увеличить лишь повышением температуры.
Конкретизировать, в какую диффузную область - внутреннюю или внешнюю -переходит гетерогенный ХТП при росте температуры (рис. 2.21), можно, увеличивая линейную скорость передающей фазы. Если при постепенном ее увеличении в диффузионной области наблюдается рост общей скорости процесса (рис. 2.22), то это является подтверждением того, что он происходит в внешнедиффузионной области. При этом температурные интервалы существования отдельных областей не изменяются.
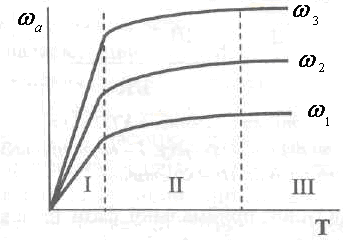
Рис.
2.22. Зависимость скорости гетерогенного
процесса от температуры и линейной
скорости
потока![]() -
Области хода процесса: 1- кинетическая;II
- переходная; III – диффузионная
-
Области хода процесса: 1- кинетическая;II
- переходная; III – диффузионная
Иногда увеличение линейной скорости приводит к изменению характера кривой - кинетическая область существует и при высших значениях температуры (рис. 2.23).
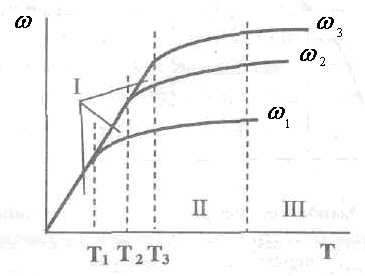
Рис.
2.23. Зависимость скорости гетерогенного
процесса и температурных границ
существования определенных областей
его хода от температуры и скорости
потока
![]() Области
протекания процесса: I-
кинетическая; II - переходная; III -
диффузионная
Области
протекания процесса: I-
кинетическая; II - переходная; III -
диффузионная
При этом видно, что все три области смещаются в сторону высших температур, а диапазон существования кинетической области расширяется. Это означает, что изменением скорости движения фаз процесс можно перевести из диффузионной в кинетическую область, т.е. создается возможность в дальнейшем интенсифицировать процесс повышением температуры.

Рис. 2.24. Зависимость скорости гетерогенного ХТП от размеров частичек принимающей фазы. Области протекания процесса: I- внутридиффузионная;II- переходная; III- кинетическая
По влиянию размеров частичек принимающей фазы на скорость процесса определяют наличие внутридиффузионной области. Очевидно, если самой медленной стадией гетерогенного ХТП есть диффузия реагента или продукта через слой принимающей фазы (твердой частички, капли жидкости), то с увеличением ее размеров (радиуса) процесс будет замедляться, так как время, необходимое для проникновения реагента вглубь частичек или для обратной диффузии продукта, будет возрастать. Исследование для определения внутри-диффузионной области осуществляют при тех же температурах и скоростях потока, когда дальнейшее их увеличение уже не влияет на скорость гетерогенного процесса. Результаты исследований представляют в виде графика зависимости скорости процесса от величины, обратной радиусу частички - 1/R (рис. 2.24).
Если на этой зависимости можно выделить участок, где наблюдается существенный прирост скорости процесса с уменьшением размеров частички, соответственно, с увеличением величины 1/R (рис. 2.24), то в системе лимитирующей стадией является внутренняя диффузия, т.е. процесс происходит во внутри-диффузионной области.
2.3.3. Общие принципы интенсификации гетерогенных ХТП
Сведения об области протекания гетерогенного процесса и анализ основного кинетического уравнения (2.111) дают основания очертить основные направления увеличения скорости ХТП.
Если процесс проходит в кинетической области, то основным фактором его интенсификации является увеличение температуры. Обеспечение оптимального значения температуры, кроме сугубо технологических особенностей, зависит еще и от экономических факторов, т.е. от необходимых затрат на создание определенного температурного режима.
Если процесс проходит во внешнедиффузионной области, то для его ускорения необходимо увеличивать скорость движения передающей фазы. Но следует иметь в виду, что иногда, например, при осуществлении процесса в системе Ж—Т в реакторе с мешалкой, скорость движения жидкости имеет оптимальное значение. Дальнейшее ее увеличение свыше этих значений может привести к увлечению твердых частичек потоком жидкости, которые начнут двигаться вместе с ней. Относительная скорость движения частичек относительно жидкости может уменьшиться до нуля. Затем толщина приграничной пленки со стороны жидкой фазы возрастет, а вместе с ней увеличится общее диффузионное сопротивление системы. Итак, увеличение скорости движения жидкости в реакторе не всегда означает увеличение скорости передающей фазы относительно принимающей. Вместе с тем, приведенные соображения дают основание для выбора типа реактора для осуществления процесса, который лимитируется внешней диффузией Если гетерогенный ХТП лимитируется сопротивлением принимающей фазы, т.е. проходит во внутридиффузионной области, то, прежде всего, необходимо уменьшать размеры частичек принимающей фазы. Кроме того, уменьшение размеров частичек одинаковых по массе конденсированного вещества (жидкости или твердого тела) приведет к увеличению их количества, и следовательно к росту суммарной площади поверхности контакта фаз в гетерогенной системе. Это дает возможность увеличить значение двух членов уравнения (2.111) - коэффициента скорости и площади поверхности. Итак, измельчение (диспергирование) принимающей фазы в любом случае должно благоприятствовать увеличению скорости процесса.
Тем не менее, и в этом случае есть определенные предостережения относительно возможности достижения минимальных размеров частичек. Во-первых, измельчение вещества (или размалывание твердых частичек или разбрызгивание жидкости) нуждается в значительных затратах энергии. Во-вторых, из-за очень малых размеров твердые частички могут образовывать агрегаты, вследствие чего площадь поверхности уменьшается. В-третьих, мелкодисперсные частички легко выносятся из реактора с подвижной фазой, что приводит к их потерям. В-четвертых, мелкодисперсные твердые частички могут создавать очень большое гидравлическое сопротивление в реакторах, которые работают в режиме идеального вытеснения.
2.3.4. Гетерогенные некаталитические процессы в системе Г-Т
Гетерогенные некаталитические процессы в системе Г-Т являются типичными в разнообразных областях химической промышленности. К ним принадлежат адсорбция и десорбция в процессах очистки газов от вредных или нежелательных примесей (поглощение сероводорода оксидами цинка или железа, осушение воздуха синтетическими цеолитами или силикагелем); выжигание (обжиг) металлических руд (окислительное выжигание сульфидов металлов, сульфатных руд или оксидов металлов); пиролиз твердофазного топлива (коксование каменного угля), газификация угля и дерева; получение цементного клинкера; выпарывание и конденсация паров веществ (возгонка йода, переработка отходов цинка) и т.п.
2.3. 4.1. Кинетические модели гетерогенных ХТП в системе Г-Т
Назначение модели любого процесса - это адекватное математическое описание всех явлений, которые происходят в гетерогенной системе. Результаты анализа системы используют в технологических расчетах, прежде всего конструктивных при проектировании реактора заданной производительности.
Для описания гетерогенных процессов в системе Г-Т разработан ряд моделей, наиболее распространенными из которых является квазигомогенная модель и модель с фронтальным перемещением зоны реакции (модель с невзаимодействующим ядром). Этими же моделями описывают также процессы, которые проходят в системе Ж—Т.
Рассмотрим обе модели гетерогенного ХТП для систем Г-Т и Ж—Т на примере процесса, в котором проходит реакция
![]()
Квазигомогенная (условно гомогенная) модель предусматривает, что гетерогенный процесс проходит одновременно во всем объеме твердой частички. Считают, что химическое взаимодействие между газофазным и твердофазным реагентами происходит лишь после того, как газообразный реагент проникнет и достаточно равномерно насытит твердую частичку, т.е. образуется условно гомогенная (квазигомогенная) система, в которой диффузия реагентов не лимитирует ход процесса. Это возможно при условии, когда газообразный реагент легко и быстро проникает вглубь частички, которая, очевидно, должна быть высокопористой, а химическая реакция, которая проходит на развитой внутренней поверхности частички, - достаточно медленной. Схематично ход процесса во времени по квазигомогенной модели изображен на рис. 2.25.

Рис.
2.25. Изменение концентрации твердофазного
реагента В и твердофазного продукта
S
в
разные моменты протекания гетерогенного
ХТП: а-до начала реакции хВ
=0;6-в некоторый момент хода процесса, 0<
хВ
< 1; в - в конце процесса, хв![]()
К началу химической реакции (при τ=0 Хв=0) концентрация реагента В одинакова по всему сечению частички с радиусом R (рис. 2.25,а). После насыщения газообразным реагентом начинается химическое взаимодействие, вследствие которого концентрация вещества В уменьшается, а продукта S - возрастает. Промежуточное состояние системы (0< хВ <1) изображено на рис. 2.25,6. Завершающая стадия процесса изображена на рис.2.25.,в: когда практически все вещество В превратилась в продукт S.
Приведенная модель имеет довольно ограниченное применение, так как описывает процессы при участии высокодисперсных твердых частичек, которые в реальных технологических процессах случаются не часто.
Модель с фронтальным перемещением зоны реакции наиболее полно учитывает все процессы в системе Г—Т (Ж-Т), а потому применяется чаще. Суть этой модели состоит в том, что реакция между газо- и твердофазным реагентами начинается на внешней поверхности твердой частички (точнее она происходит во внешнем тонком слое, который условно принимают за сферическую поверхность). При этом возникает (формируется) фронт реакции. Лишь после того, как твердофазный реагент в этой тонкой прослойке полностью прореагирует, зона реакции, а точнее ее фронт, переместится вглубь частички - в следующий ее тонкий слой. Так происходит до тех пор, пока фронт реакции постепенно не проникает вплоть до центра твердой частички и процесс полностью не завершится. В любой момент процесса за фронтом реакции остается зола, которая состоит из твердофазного продукта реакции (ST) и инертного вещества, которое входило в начальный состав твердой частички. Впереди фронта реакции находится (вплоть до окончания реакции) не прореагировавшее твердое вещество, которое называют ядром частички. Поэтому эта модель имеет еще и другое название - модель с непрореагировшим ядром. Очевидно, что во время протекания процесса размеры ядра частички постепенно уменьшаются до нуля. Особенность модели состоит в том, что во времени происходит изменение радиуса непрореагировавшего ядра при постоянной концентрации твердофазного реагента в нем, тогда как радиус частички не изменяется. Схематично ход процесса во времени, соответственно модели с фронтальным перемещением зоны реакции, приведен на рис. 2.26. Фронтальное перемещение зоны реакции вглубь частички учитывает, в отличие от квазигомогенной модели, важное влияние на гетерогенный процесс диффузионных явлений, в частности, переноса газообразного реагента во внутренние области частички. Именно от интенсивности диффузии газообразного реагента в передающей и принимающей фазах и его химической активности будет зависеть общая скорость ХТП в системе Г-Т(Ж-Т) Для того, чтобы учесть действие всех факторов на процесс, сначала будем считать, что в системе существуют как диффузионные, так и кинетические сопротивления процесса, т.е. он происходит в переходной области.
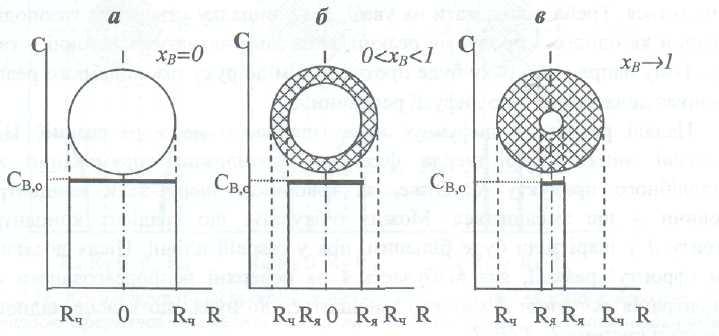
Рис.
2.26. Изменение концентрации твердофазного
реагента В во время хода процесса:а-хв=0;
б- 0<
хВ
<1; хВ
![]() 1
1
Рассмотрим и проанализируем отдельные стадии этого процесса в момент, когда фронт реакции переместился на определенную глубину в отдельной частичке, которая окружена ламинарной межевой газовой пленкой. Влияние разных факторов на процесс будем анализировать по изменению концентрации газообразного реагента А в разных точках пространства системы Г-Т (рис. 2.27).
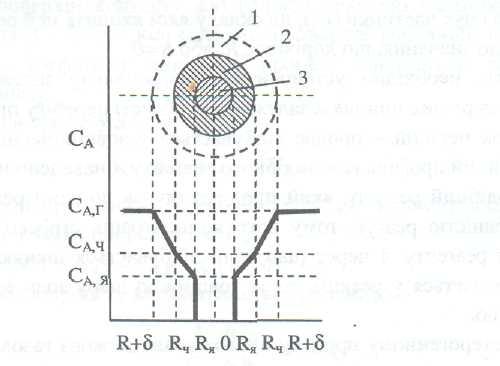
Рис. 2.27. Концентрационный профиль газообразного реагента вследствие его взаимодействия с твердофазной частичкой соответственно модели с фронтальным перемещением зоны реакции: 1 - межевая газовая пленка; 2 - слой твердофазных продуктов или золы; З - непрореагировавшее ядро
Концентрация вещества А в газовой среде является постоянной до достижения поверхности приграничной газовой пленки. Последняя оказывает внешнедиффузионное сопротивление реагенту А, поэтому концентрация его за толщиной ламинарной пленки уменьшается. Надо также иметь в виду, что в случае образования газообразного вещества как одного из продуктов реакции, оно будет диффундировать наружу в газовую фазу. Поэтому направление его движения будет противоположным к движению газообразного реагента - возникает дополнительное сопротивление диффузии вещества.
В дальнейшем реагент А диффундирует через слой золы к зоне реакции. Этому процессу оказывают сопротивление твердая фаза и противоположно направленный поток газообразного продукта R. Итак, за толщиной слоя золы концентрация вещества А еще уменьшится. Можно ожидать, что градиент концентрации реагента А в слое золы будет большим, чем в газовой пленке. После достижения зоны (фронта) реакции, которая проходит на поверхности непрореагировавшего ядра, концентрация вещества А мгновенно уменьшается до нуля, которое собственно, отвечает этой модели системы Г-Т (Ж-Т).
Реальные гетерогенные системы преимущественно проходят в определенной области. Поэтому рассмотрим три случая, когда процесс лимитируется внешней, внутренней диффузией или же скоростью химической реакции.
Суть задачи анализа моделей состоит в том, чтобы установить влияние разных факторов на интенсивность процесса в системе Г—Т (Ж-Т). Интенсивность процесса будем характеризовать временем, необходимым для достижения заданного (хВ) или полного (хВ=1) степени превращения твердофазного реагента. За это время начальный радиус частички (R0), в состав которой входит этот реагент, соответственно уменьшится до значения, которое равняется R, или R0.
Итак, необходимо установить функциональную зависимость продолжительности процесса (τ) от разных факторов в зависимости от области протекания процесса.
Случай первый - процесс проходит в внешнедиффузионной области. Концентрационный профиль газообразного реагента А приведен на рис. 2.28,а.
Газообразный реагент, который продиффундировал к зоне реакции на поверхности ядра, там полностью реагирует, поэтому его концентрация стремится к нулю. Перенос реагента А через слой золы проходит быстро, а поскольку он сразу же расходуется на реакцию, то за толщиной слоя золы его концентрация равняется нулю.
Сопротивление гетерогенному процессу совершает лишь межевая газовая пленка. Поэтому за ее толщиной концентрация газообразного реагента изменяется от СА,Г -концентрации в газовой фазе, к нулю

Рис. 2.28. Концентрационный профиль газообразного реагента вследствие его взаимодействия с твердой сферической частичкой. Области хода процесса: а - внешнедиффузионная;б - внутридиффузионная; в - кинетическая. 1 – граничная газовая пленка;
2 - слой твердофазных продуктов или золы; 3 - непрореагировавшее ядро
Итак, в этом случае скорость гетерогенного ХТП равняется скорости конвективной диффузии реагента А через приграничную газовую пленку;
![]() (2.113)
(2.113)
где FЧ - площадь поверхности контакта фаз (площадь поверхности частички);GA, GB -количества реагентов А и В; b — количество молей твердого вещества, которое реагирует с 1 молем газа; кГ - коэффициент скорости процесса (диффузии) по газу; ∆А -движущая сила процесса.
Движущая сила процесса равняется
![]() (2.114)
(2.114)
где
![]() -
концентрация
вещества в газовой фазе;
-
концентрация
вещества в газовой фазе;
![]() -
концентрация вещества Ана
поверхности твердой частички радиусом
Rч.
-
концентрация вещества Ана
поверхности твердой частички радиусом
Rч.
Но
![]() =0,
поэтому
=0,
поэтому![]()
Тогда скорость процесса будет выражаться уравнением
![]() (2.115)
(2.115)
Площадь поверхности частички, которую условно принимают за сферическую, равняется
![]() (2.116)
(2.116)
тогда
![]() (2.116)
(2.116)
Количества веществ А и В, которые прореагировали, пропорциональны уменьшению объема или радиуса ядра непрореаговавшей частички
![]() (2.117)
(2.117)
де-ρг - плотность частички; V - объем частички; RГ - радиус непрореагировавшего ядра частички.
![]() (2.118)
(2.118)
Из уравнений (2.116) и(2.117 получим
 (2.119)
(2.119)
Разделив переменные, получим
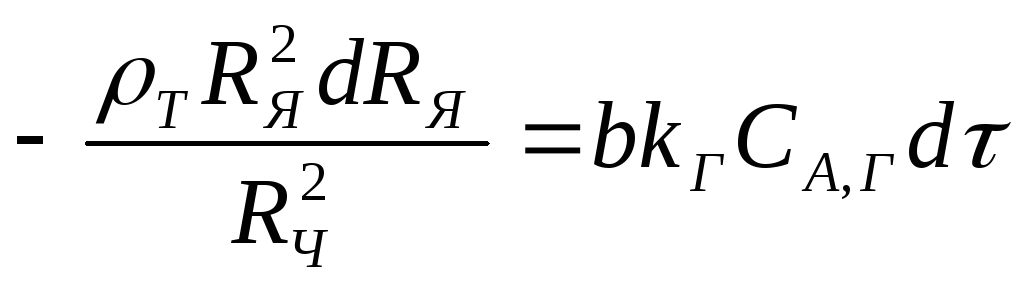 (2.120)
(2.120)
Проинтегрируем это выражение от начального значения его радиуса Rч при τ=0 (к началу химического преобразования) до Rя- радиуса непрореагировавшего ядра в любой момент времени τ
 (2.121)
(2.121)
Вследствие этого получим выражение для определения продолжительности изменения радиуса непрореагировавшей частички от Rч до Rя.
![]() (2.122)
(2.122)
Откуда
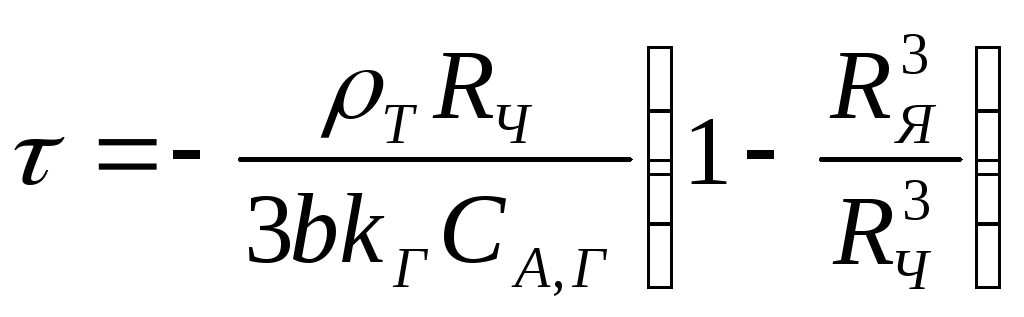 (2.123)
(2.123)
Время, за которое достигается полное преобразование (τ/) твердофазового реагента, определяется по уравнению
![]() (2.124)
(2.124)
Степень превращения хτ, которая достигается за время τ, определяется из выражения
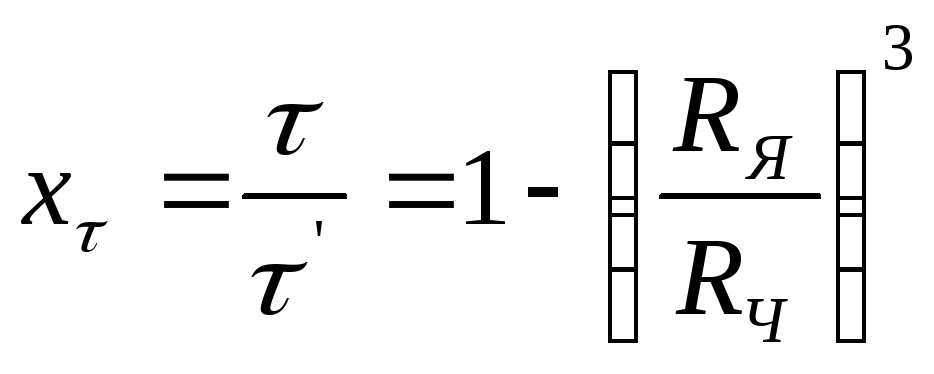 (2.125)
(2.125)
Анализируя уравнение (2.123) и (2.124), можно определить направления интенсификации гетерогенного процесса Г-Т, который проходит во внешне-диффузионной области. Для этого необходимо:
уменьшать размеры твердых частичек;
увеличивать значение кг за счет перемешивания системы или увеличения скорости движения передающей фазы;
повышать концентрацию реагента в газовой фазе.
Случай второй - процесс проходит во внутренне диффузионной области, т.е. лимитируется диффузией газообразного реагента через слой твердофазных продуктов реакции (золы). Концентрационный профиль газообразного реагента в системе Г-Т для этого случая приведен на рис. 2.28,6.
В этой области хода процесса сопротивлением межевой ламинарной пленки пренебрегаем: концентрация реагента А за толщиной этого слоя остается постоянной и равняется его концентрации в газовой фазе. Итак, на поверхности твердой частички с радиусом Rч концентрация реагента А равняется СА,Г.
Слой золы препятствует диффузии газообразного реагента к зоне реакции -фронта реакции, которая проходит на поверхности непрореагировавшего ядра Скорость диффузии газообразного реагента А через слой твердофазного продукта, соответственно закону Фика, описывается уравнением
![]() (2.126)
(2.126)
где D - эффективный коэффициент диффузии.
С другой стороны, скорость процесса по веществу А выражается уравнением
![]() (2.127)
(2.127)
где FЯ - площадь поверхности непрореагировавшего ядра, на котором происходит химическая реакция. Приравняв два выражения для скорости процесса (2.126) и (2.127), получим
![]() (2.128)
(2.128)
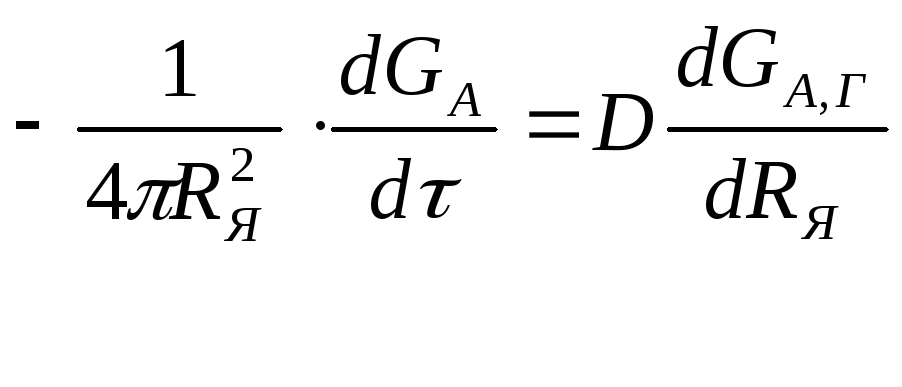 (2.129)
(2.129)
Разделим переменные и получим
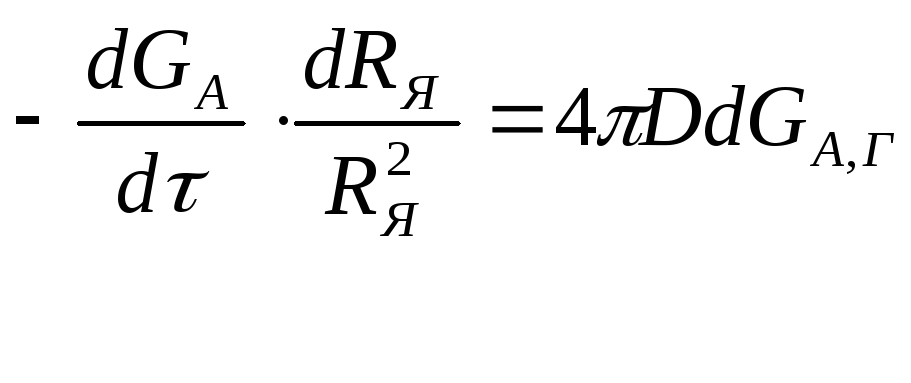 (2.130)
(2.130)
Проинтегрируем это выражение по концентрации от СА,Г на поверхности твердой частички с радиусом Rч до нуля - на поверхности непрореагировавшего ядра радиусом Rя, где и происходит быстрая химическая реакция.
 (2.131)
(2.131)
и получим
![]() (2.132)
(2.132)
Подставив в это выражение уравнения (2.117), получим
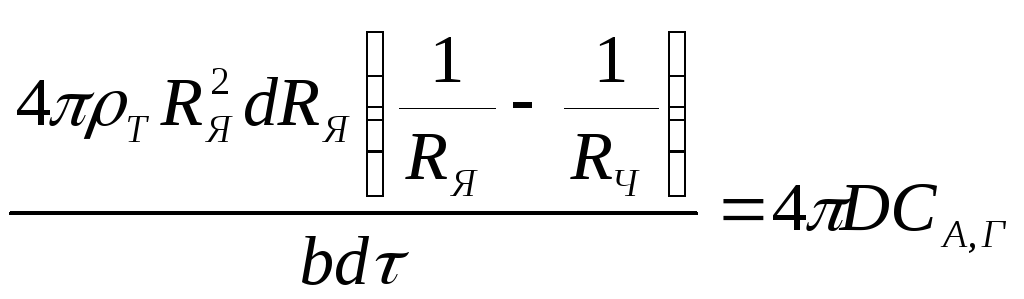 (2.133)
(2.133)
Снова разделим переменные и проинтегрируем полученное выражение
 (2.134)
(2.134)
Откуда
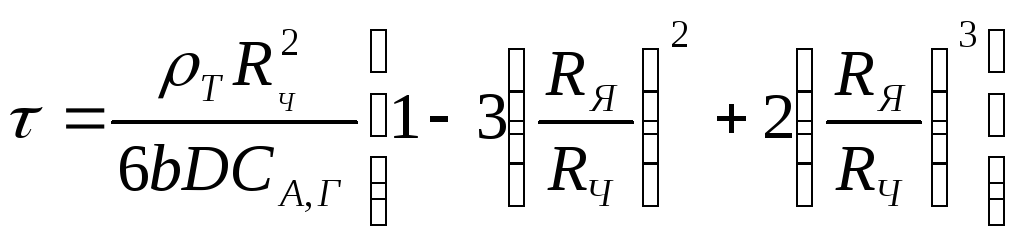 (2.135)
(2.135)
Полное превращение частички ( Rя =0) достигается за время τ’
![]() (2.136)
(2.136)
![]() Отношение
времени превращения ко времени
полного превращения τ/
равняется:
Отношение
времени превращения ко времени
полного превращения τ/
равняется:
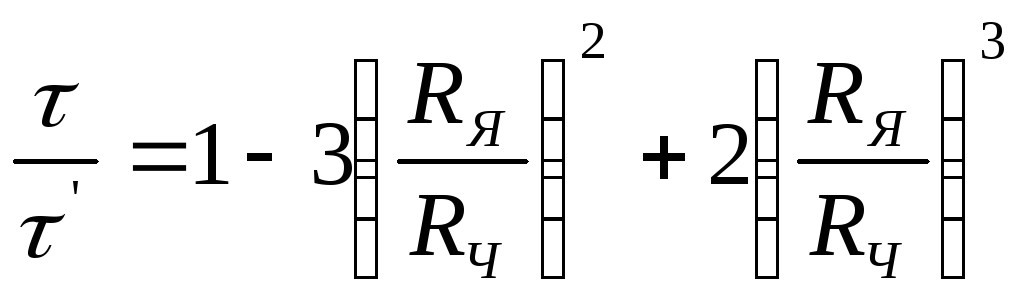 (2.137)
(2.137)
или выраженное через степень превращения хτ в момент времени τ
![]() (2.138)
(2.138)
На основании уравнений (2.135) и (2.136) можно утверждать, что интенсификации гетерогенного процесса во внутридиффузионной области можно достичь:
уменьшением размеров частичек их измельчением (в выражении для скорости процесса радиус входит в числитель в квадрате);
увеличением скорости диффузии через слой твердого продукта вследствие повышения пористости, например, специальной предварительной подготовкой сырья;
увеличением концентрации реагента в газовой фазе
Третий случай - процесс происходит в кинетической области, т.е. лимитируется скоростью химической реакции. В этом случае считаем, что ни межевая газовая пленка, ни слой твердофазного продукта (зола) на скорость диффузии газообразного реагента из газовой фазы к зоне реакции практически не влияют, поэтому концентрация газообразного реагента остается постоянной вплоть до зоны реакции (рис. 2.28,в).
Скорость химической реакции по газообразному реагенту равняется
![]() (2.139)
(2.139)
где к - константа скорости химической реакции; СА,Г - концентрация газообразного реагента, который продиффундировал в зону реакции.
Приравняв уравнение (2.127) и (2.139), получим
![]() (2.140)
(2.140)
где Fя - площадь непрореагировавшего ядра, на поверхности которого происходит химическая реакция.
Подставив в это уравнение значения Fя , а из выражения (2.116) - dCB получим
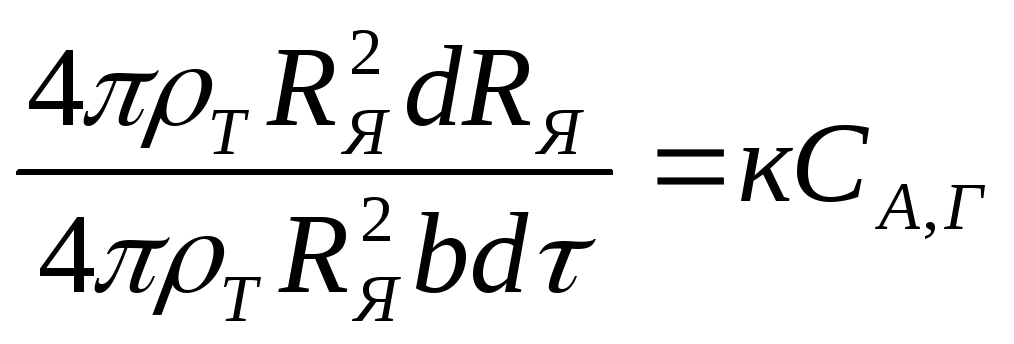 (2.141)
(2.141)
![]() (2.142)
(2.142)
Проинтегрировав это выражение от Rя при τ=0 до Rя в любой момент времени τ, имеем
![]() (2.143)
(2.143)
![]() (2.144)
(2.144)
Время полного превращения τ' (Rя = 0) равняется
![]() (2.145)
(2.145)
Отношение τ к τ', выраженное через величины радиусов частички
![]() (2.146)
(2.146)
или выраженное через степень превращения
![]() (2.146)
(2.146)
Интенсификацию процесса в системе Г-Т, который проходит в кинетической области, соответственно уравнениям (2.144) и (2.145) можно осуществить такими методами:
увеличением константы скорости химической реакции повышением температуры процесса или применением катализатора;
уменьшением размеров твердых частичек;
увеличением концентрации газообразного реагента.
Лимитирующую стадию процесса в системе Г-Т можно определить экспериментально, как отмечалось выше, или теоретически. Для определения области протекания процесса теоретически на основании уравнений (2.125), (2.138) и (2.147) строят графические зависимости степени превращения (хτ) от относительного времени взаимодействия (τ/τ'). Соответствующие кривые изображены на рис. 2.29.
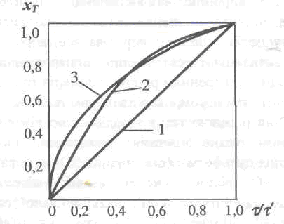
Рис. 2.29. Зависимость степени превращения хτ от относительного времени взаимодействия τ/τ'. Лимитирующие стадии процесса: 1 - внешняя диффузия; 2 - внутренняя диффузия;З - химическая реакция
Область
протекания процесса в системе Г—Т
для
частичек разных размеров можно
определить, используя уравнение (2.124),
(2.136) и (2.145). На их основании
выводят соотношение, которые отвечают
разным временам превращения частичек
с радиусами Rч1
и
R
ч2
(
Rч1
>
R
ч2):
полного
превращения![]() и
и![]() т/тапромежуточным
-
т/тапромежуточным
-
![]() и
и![]()
Полученные соотношения характеризуют соответствующие лимитирующие стадии - внешнюю диффузию, если
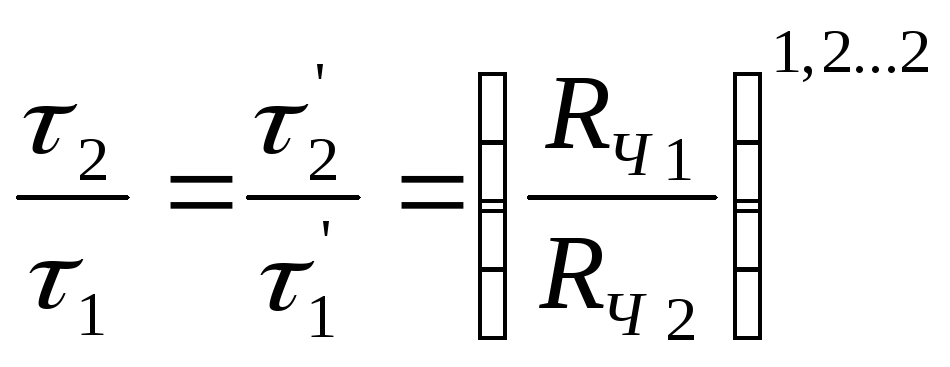 (2.148)
(2.148)
- внутреннюю диффузию, если
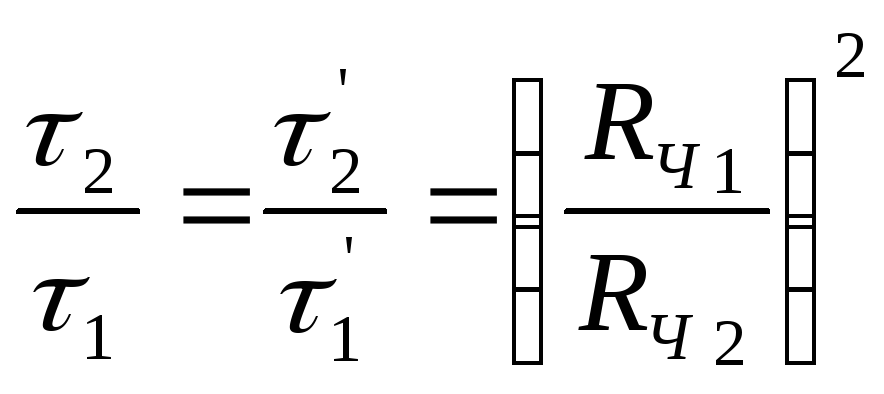 (2.149)
(2.149)
- химическую реакцию первого порядка, если
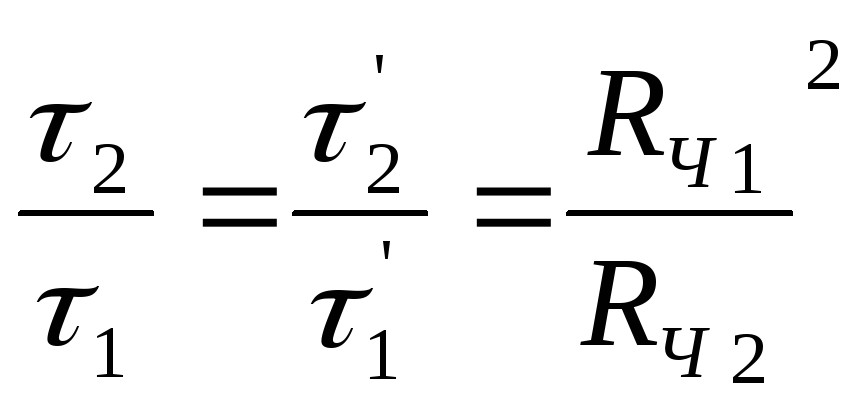 (2.150)
(2.150)
2.3.5.Гетерогенные некаталитические процессы
в системах Г-Ж и Ж-Ж
ХТП, в которых принимают участие газообразные и жидкие реагенты, достаточно распространены в химических производствах как основные технологические процессы, так и вспомогательные, например, при очистке газов от вредных или нежелательных примесей. К таким процессам принадлежат, прежде всего, абсорбция, хемосорбция, десорбция, а также дистилляция и ректификация, выпаривание и конденсация, газофазная полимеризация с образованием жидких полимеров и т.п.
Наиболее характерным процессом, который проходит в системе Г-Ж, является хемосорбция (поглощение жидкостью газа) с дальнейшим химическим взаимодействием в жидкой фазе. Типичными технологическими процессами, которые базируются на хемосорбции, являются получение серной (поглощение SО3 серной кислотой) и азотной (абсорбция N02 водой) кислот; аммония нитрата (нейтрализация азотной кислоты газообразным аммиаком); кальцинированной соды (карбонизация аммонизированного рассола), жидкофазное хлорирование (абсорбция хлора ненасыщенными углеводородами), а также процессы очистки газов: природного газа от сероводорода (растворами моноэтаноламина или содохинонным); коксового газа от сероводорода и аммиака; вентиляционных газов производство магния и много других.
Именно хемосорбционные процессы характеризуются массопередачей как физическим явлением и сопровождаются химическим взаимодействием. Другие процессы, которые также принадлежат к системе Г-Ж, преимущественно являются физическими процессами (дистилляция, ректификация, конденсация) и лишь некоторые из них сопровождаются химическими превращениями (полимеризация, отгонка газа, который образовывается при термическом распаде жидкого соединения).
Значительно менее распространены, по сравнению с газожидкостными, являются системы, образованные несмешивающимися жидкостями. Основным типом процессов в системе Ж-Ж есть экстракция - переход компонента одной жидкости в объем другой. Чаще всего такие процессы применяют для концентрирования бедных (низкоконцентрированных) растворов солей цветных, драгоценных, редкоземельных металлов, полученных переработкой естественных руд, а также во время очистки нефтепродуктов, производство йода, брома, анилина и т.п.
Вообще закономерности процессов в системах Г-Ж и Ж-Ж являются аналогичными. Поэтому в дальнейшем проанализируем лишь процессы в системе Г-Ж как более распространенные в химической технологии и при осуществлении природоохранных мероприятий.
2.3. 5.1. Кинетические модели процессов в системе Г-Ж (Ж-Ж)
Существует ряд моделей, которые описывают гетерогенный процесс в системе Г-Ж. К ним принадлежат, в частности, пленочная модель и модель обновления поверхности. Тем не менее ни одна из них не является достаточно полной и для практических расчетов нужно вводить эмпирические параметры, которые отображают гидродинамические условия. Именно поэтому результаты, полученные во время применения разных моделей, практически совпадают.
Чаще всего применяют пленочную (двухпленочную) модель, которая является простейшей, довольно наглядной и дает представление о совокупности массообменных и химических процессов. Рассмотрим пленочную модель на примере системы, компонентами которой является газовая смесь, которая содержит реагент, и жидкость с реагентом В.
Основные положения пленочной теории такие.
1. В обеих фазах непосредственно возле границы раздела фаз (ГРФ) есть тонкий приграничный слой вещества в виде недвижимой или ламинарной пленки. Внутри пленки перенос вещества осуществляется только стационарной молекулярной диффузией, которая описывается уравнением
![]() (2.151)
(2.151)
которое после интегрирования дает выражение коэффициента массопередачи
![]() (2.152)
(2.152)
где δ - толщина приграничной пленки.
2. На границе раздела фаз существует равновесие, которое описывается законом Генри:
![]() (2.153)
(2.153)
где
![]() - парциальное
равновесное давление реагента А
в
газовой фазе; Н
– коэффициент
Генри;
- парциальное
равновесное давление реагента А
в
газовой фазе; Н
– коэффициент
Генри;
![]() — равновесная
концентрация реагента А
в
жидкой фазе.
— равновесная
концентрация реагента А
в
жидкой фазе.
3. За пределами пленок в объемах соответственно газовой и жидкой фаз концентрации реагирующих веществ являются постоянными вследствие конвективного и турбулентного переноса. Вследствие этого градиенты концентраций возникают лишь в близлежащих пленках, где сосредоточено все диффузное сопротивление массопереносу. Поскольку в состоянии равновесия сопротивление на границе раздела фаз отсутствует, общее сопротивление массопередачи состоит из сопротивлений каждой из фаз, т.е. существует аддитивность фазовых сопротивлений. Соответственно этому, коэффициент массопередачи из газовой в жидкую фазу можно записать как
 (2.154)
(2.154)
Вообще скорость реакции, отнесенная к единице площади поверхности раздела фаз, выражается уравнением
![]()
(2.155)
где βА,Г - коэффициент скорости массопередачи реагента А в газовой фазе; βА,Р и βВ,Р - коэффициенты скорости массопередачи реагентов А и В в жидкой фазе.
Для общего случая концентрационный профиль реагентов А и В в этой системе приведен на рис. 2.30. Реальный концентрационный профиль зависит от скорости химической реакции между реагентами в жидкой фазе. Толщина зоны жидкости, в которой происходит реакция, зависит от скорости химической реакции, концентраций реагентов А и В, а также от значений коэффициентов их диффузий в жидкости. Зона реакции тем меньше по толщине, чем выше значения указанных факторов.
Рассмотрим три частных случая, когда скорость реакции очень высокая (мгновенная реакция), высокая (быстрая реакция) и малая (медленная реакция).
В случае мгновенной реакции реагенты А и В, которые диффундируют навстречу друг другу, мгновенно реагируют внутри жидкостной пленки на некоторой условной плоскости - зоне реакции, размещенной на расстоянии δ1 от поверхности раздела фаз. Вследствие мгновенного и необратимого взаимодействия концентрация реагентов в зоне реакции резко уменьшается до нуля. Лимитирующей стадией такого процесса является диффузия газа через приграничную газовую пленку к поверхности раздела фаз, т.е. процесс происходит в внешнедиффузионной области. Тогда скорость процесса будет описываться уравнением
![]() (2.156)
(2.156)
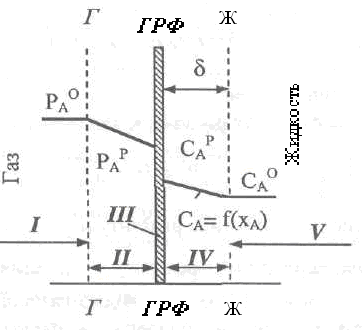
Рис.
2.30. Распределение концентрации
газообразного реагента А в системе Г-Ж:
![]() -в
турбулентном потоке газа;
-в
турбулентном потоке газа;![]() -в приграничном слое жидкости;
-в приграничном слое жидкости;![]() -в приграничном слое жидкости;
-в приграничном слое жидкости;![]() -в турбулентном потоке жидкости.
-в турбулентном потоке жидкости.
Зоны: I- турбулентный поток газа; II - приграничный слой газа;
III - граница раздела фаз (ГРФ); IV - приграничный слой жидкости;
V - турбулентный поток жидкости
Для интенсификации этого процесса необходимо увеличивать парциальное давление вещества А в газовой фазе и увеличивать коэффициент скорости масcопередачи βг, что достигается увеличением скорости газового потока относительно жидкости и его турбулизацией.
Однако концентрационный профиль для реагентов А и В может иметь другой вид от того, который приведен на рис. 2.30.
Если реакция происходит на границе раздела фаз (зона реакции совпадает в пространстве с целью раздела фаз), что возможно из за высокой концентрации реагента В в жидкой фазе, то δ1=0; тогда концентрационный профиль будет выглядеть так, как показано на рис. 2.31,а. Сопротивление жидкой фазы в таком случае считают нулевым, а все диффузионные сопротивление в системе локализованы лишь в газовой пленке
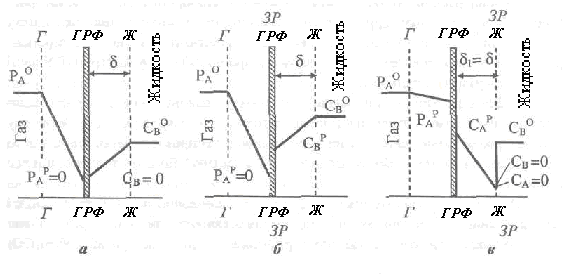
Рис. 2.31. Концентрационный профиль реагентов в системе Г-Ж в режиме мгновенной реакции: при высокой концентрации реагента В; 6-при высоком значении коэффициента βВ,Р ;в- при низких значений концентраций В или коэффициента массопередачи βВ,Р
Если значение коэффициента βВ,Р высокое и подвод реагента В в зону реакции превышает расход его в реакции, то на границе раздела фаз со стороны жидкости наблюдается его избыточная концентрация (рис. 2.31, б).
В случае, если концентрация реагента В или значение коэффициента массопередачи βВ,Р незначительны, то зона реакции может переместиться от поверхности раздела фаз в толщу жидкости и совпадать с границей ламинарной пленки жидкости (δ1=δ). Скорость процесса в этом случае лимитируется скоростью диффузии реагента В. Соответствующий концентрационный профиль реагентов приведен на рис.2.31,в.
Режим мгновенной реакции наблюдается в случаях протекания йонных реакций, которые заключаются в обмене веществ протонами (абсорбция кислотного агента сильным основанием или наоборот). Примерами таких реакций могут быть: поглощение аммиака азотной кислотой в производстве аммония нитрата, абсорбция "кислых" газов (SО2, Н2S) водными растворами щелочей (NaOН, моно- и диэтаноламинов) и гидролитически щелочных солей (Na2СО3) в процессах очистки газов; взаимодействие SO3 с высшими спиртами при получении поверхностно активных веществ, сульфирование олеумом ароматических углеводородов и т.п.. Мгновенными считают также реакции второго порядка с константой скорости большей, чем 105 м3 /моль·с.
Режим быстрой реакции отличается уменьшением скорости химической реакции по сравнению с мгновенной и приводит к закономерному расширению зоны реакции. При этом возможные две схемы протекания процесса.
Зона реакции ограничивается границами ламинарной пленки жидкой фазы (рис. 2.32,а). Это означает, что за время диффузии через приграничную жидкостную пленку растворенный газообразный реагент А успевает полностью прореагировать с жидким реагентом В, превращаясь при этом в продукт. Поэтому во внутренние области (ядро потока) он не поступает.
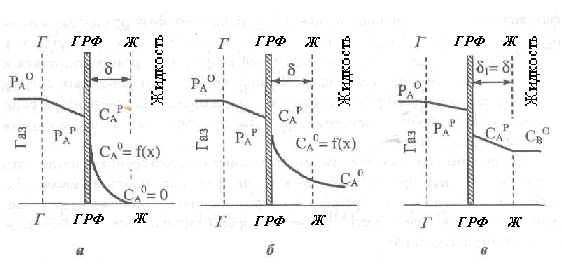
Рис. 2.32. Концентрационный профиль реагентов в системе Г-Ж в режимах быстрой (а, б) и медленной (в) реакций: а - зона реакции ограничивается границами ламинарной пленки жидкой фазы; б - зона реакции распространяется на турбулентную область в жидкости
Зона реакции расположена не только в приграничной пленке, но и распространяется на часть турбулизированного потока жидкости (рис. 2.32,6). В этом случае растворенный реагент А не успевает полностью прореагировать за время его диффузии через приграничную пленку, поэтому часть его попадает в ядро потока. Особенностью режима быстрой реакции есть одновременный ход диффузионных и химических явлений в приграничной пленке жидкой фазы, которая становится диффузионно-реакционной зоной. Режим быстрой реакции наблюдается, например, при абсорбции СО2 водными растворами едкого натра, моно- и диэтаноламинов.
Режим медленной реакции характеризуется настолько малой скоростью реакции, что химическим превращением растворенного реагента А на протяжении времени его диффузии через приграничную жидкостную пленку можно пренебречь, тогда реакция проходит в ядре потока жидкости. Поэтому изменение концентрации абсорбированного вещества А в пределах ламинарной пленки имеет линейный характер (рис. 2.32,в).
В режиме медленной реакции процесс происходит преимущественно в кинетической области, хотя может наблюдаться также диффузионно-кинетическая область. В кинетической области проходят такие технологические процессы, как сульфирование и нитрование ароматических соединений, гидрирование и жидкофазное хлорирование и окисление ненасыщенных углеводородов и т.п..
Модель обновления поверхности (модель проницаемости) основывается на предположении того, что через некоторые промежутки времени происходит замещение элементов жидкости, которые находятся возле поверхности раздела фаз, жидкостью из глубинных слоев, причем эти элементы жидкости характеризуются одинаковым начальным составом. На протяжении времени, пока элемент жидкости находится возле поверхности раздела фаз, происходит абсорбция газообразного реагента при условии, что элемент неподвижен и имеет бесконечную глубину. Скорость абсорбции в таком условно неподвижном недвижимом элементе является величиной переменной, она уменьшается во времени, так как проходит насыщение жидкости газом, вследствие чего движущая сила процесса закономерно уменьшается. Итак, абсорбцию согласно этой модели рассматривают как нестационарный процесс.
Модели обновления поверхности (их существует несколько разновидностей, которые отличаются распределением времени замены элементов жидкости возле поверхности раздела фаз) более реалистичны, чем пленочные, так как жидкую фазу рассматривают не как неподвижную, а в динамике, которая значительно точнее отображает поведение жидкости в абсорбционном процессе. Однако математический аппарат, который используется в таких моделях, значительно сложнее. Если же сравнивать результаты анализа функционирования моделей разных типов (пленочные и обновление поверхности), то они преимущественно отличаются незначительно. Поэтому на практике чаще применяют более простую модель - пленочную.
Если абсорбция сопровождается химическим превращением поглощенного вещества, то этот процесс проходит быстрее, чем простой массообмен. Отношение скорости абсорбции, которая сопровождается химическим взаимодействием, (хемосорбции) к скорости физической сорбции называется коэффициентом ускорения абсорбции Ф
![]() (2.157)
(2.157)
где ωж,хим. ωж,ф.аб - скорости процесса в жидкой фазе в случае протекания химической реакции и физической абсорбции, соответственно.
Рассмотрим систему АГ—ВЖ. Если в ней проходит лишь физическое поглощение вещества А, то скорость этого процесса определяется как
![]() (2.158)
(2.158)
где
βА,Ж-
коэффициент
массопередачи вещества А
в
жидкости;
![]() ,
СА,Ж
- концентрации
,
СА,Ж
- концентрации
реагента А в жидкости возле поверхности раздела фаз и на границе ламинарного слоя жидкости. Если поглощенное вещество реагирует в жидкой фазе, то скорость процесса равняется
![]()
![]() (2.159)
(2.159)
где![]() -
коэффициент
массопередачи в жидкой фазе при наличии
химической реакции
-
коэффициент
массопередачи в жидкой фазе при наличии
химической реакции
Если условно принять, что движущая сила хемосорбции эквивалентна движущей силе физической абсорбции, то
![]() (2.160)
(2.160)
Коэффициент ускорения может приобретать значения от Ф=1 для очень медленных реакций до Ф=∞ для мгновенных.
Ускорение абсорбции при наличии химической реакции объясняется именно увеличением движущей силы процесса сравнительно с сугубо физическим растворением газа. Вследствие физической абсорбции концентрация поглощенного вещества возрастает, а движущая сила процесса, соответственно, уменьшается. Если происходит хемосорбция, то поглощенный компонент реагирует, его концентрация в жидкой фазе уменьшается, а движущая сила процесса возрастает.
