
69_39_Genetikapdf
.pdf51
вищих ссавців. Полі-Ц обумовлює включення проліну, а полі-А – включення лізину.
Дотті (1965 – 1966) для бактерії E.coli установив, що кодон АУГ є знаком трансляції. Біля ініціюючого кодону (АУГ) іРНК утворює спіральну «шпильку». У цій петлі знаходиться кодон АУГ. Цю «шпильку» впізнає рибосома як місце приєднання до іРНК. Термінальний (нонсенс) кодон є місцем обриву трансляції і вивільнення рибосом.
Велику роль грають безглузді кодони«нонсенси», які не кодують жодну амінокислоту – це УАА, УГА і УАГ. Вони ще називаютьсятермінальними кодонами. Ці кодони грають роль пунктуації, визначаючи кордони між генами і даючи сигнали для кінця транскрипції.
Код характеризується неперекриваємістю. Це було доведено вивченням мутацій, що порушують синтез білків. При коді, що перекривається, зміни в одній парі нуклеотидів повинні вести до порушення трансляції трьох амінокислот тому, що при перекриванні коду один із нуклеотидів входить до складу трьох триплетів (кодонів). Проте, при мутації змінилось лише транслювання однієї амінокислоти,
що доводить неперекриваємість коду.
Генетичний код зчитується поступово зі стартової точки на початку гену і доходить до його кінця. Цей факт установив Ф. Крик. Якщо у результаті мутацій з’явиться вставка, то після вставки всі триплети зміняться. При втраті нуклеотиду також змінюються триплети.
Таким чином, |
можна |
сформулювати основні положення |
генетичного |
коду, викладені Ф. |
Криком |
у 1962 р. у Нобелівській лекції |
і розвинуті у |
подальшому іншими вченими: |
|
|
|
·кодони складаються із трьох (сусідніх) основ (код триплетний);
·сусідні кодони не перекриваються (код не перекривається);
·іРНК зчитується правильними групами із трьох основ, починаючи зі стартової точки;
·кодова послідовність гену колінеарна із послідовністю амінокислот, причому поліпептидний ланцюг синтезується поступово, починаючи з N-кінця;
·у загальному випадку одну амінокислоту кодує більш ніж один триплет
(виродженість коду);
·у деяких умовах in vitro код виявляється неоднозначним (двозначним). Так, деякі триплети кодують більше однієї амінокислоти. Наприклад,
при обробці рибосом стрептоміцином кодон УУУ також починає кодувати ізолейцин і серин, крім фенілаланіну;
·код універсальний (чи майже універсальний) для всіх організмів;
·код транскрибується із одного полінуклеотидного ланцюга ДНК;
· |
є триплети-«нонсенси», що не |
кодують жодну амінокислоту |
|
відіграють роль пунктуації; |
|
·дві перших основи кодону несуть більшу частину інформації, третя основа – меншу. Зчитуючий механізм, як правило, не відрізняє основи,
52
що займає третє місце. Тому мутація, що приводить до зміни третьої основи кодону, не впливає на закодовану амінокислоту.
6.2. Таблиця відповідності кодонів іРНК амінокислотам білка
Розглянемо питання про ,теяким |
чином 4 нуклеотиди |
молекули |
ДНК |
|
|||||||||
визначають послідовність 20 основних амінокислот у молекулі білка. Зрозуміло, |
|
||||||||||||
що один нуклеотид не може кодувати одну амінокисл, тотуму що різних |
|
||||||||||||
нуклеотидів |
усього 4. |
Двох |
нуклеотидів |
теж не вистачить для кодування20 |
|
||||||||
амінокислот, так як таких парних поєднань може бути лише 16. Якщо підрахувати |
|
||||||||||||
число теоретично можливих |
сполучень |
по три з чотирьох різних нуклеотидів |
|
||||||||||
ДНК або РНК, то отримаємо 64, тобто даної кількості достатньо для кодування 20 |
|
||||||||||||
амінокислот. Одиницею кодування у нуклеїнових |
кислотах кодонє |
– це |
три |
|
|||||||||
поруч розташовані нуклеотиди(триплет), тобто генетичний код є триплетним. |
|
||||||||||||
Інформаційними у нуклеотидах виступають азотисті основи– аденін, тимін, |
|
||||||||||||
гуанін, цитозин і урацил. |
|
|
|
|
|
|
|
|
|
|
|||
Оскільки число можливих триплетних комбінацій складає64, існування |
|
||||||||||||
триплетного коду припускає, що або не всі триплети приймають |
участь |
в |
|||||||||||
кодуванні амінокислот, або деякі амінокислоти кодуються більш ніж одним |
|
||||||||||||
кодоном. |
|
|
|
|
|
|
|
|
|
|
|
|
|
Кодони, |
які |
кодують |
більше |
однієї |
амінокислоти |
назива |
|||||||
синонімічними |
(18 |
амінокислот |
кодуються |
кількома |
триплетами– |
код |
|
||||||
вироджений). Лише дві амінокислоти – триптофан і метіонін є невиродженими і |
|
||||||||||||
кодуються одним кодоном кожна. Три позиції нуклеотидів у складі синонімічних |
|
||||||||||||
кодонів не рівнозначні: найважливішою для визначення змісту |
кодона |
є |
|||||||||||
комбінація нуклеотидів у першій та другій позиції. При цьому друга позиція |
|
||||||||||||
визначає зміст кодона найжорсткіше– нуклеотидні заміни по ній |
завжди |
|
|||||||||||
приводять до зміни змісту(амінокислотної заміни). Найнезмістовнішою є третя |
|
||||||||||||
позиція – нуклеотидні заміни по третій позиції в70 % випадків не викликають |
|
||||||||||||
змін змісту кодона. |
|
|
|
|
|
|
|
|
|
|
|
||
Сучасні уявлення про властивості і |
структуругенетичного |
коду отримали |
|
||||||||||
переконливі експериментальні обґрунтування на початку60-х рр. XX ст., коли |
|
||||||||||||
була розроблена система штучного(безклітинного) синтезу білкових молекул in |
|
||||||||||||
vitro з використанням в якості матриць синтетичних полірибонуклеотидів, а також |
|
||||||||||||
рибосом та інших необхідних компонентів, що були виділені з бактеріальних |
|
||||||||||||
клітин. За допомогою зазначених методів вдалося розшифрувати структуру усіх |
|
||||||||||||
64 кодонів іРНК (табл. 6.1). |
|
|
|
|
|
|
|
|
|
|
|||
Як видно з таблиці6.1 більшості з 20 амінокислот, що входять до складу |
|
||||||||||||
білкових молекул, відповідає більш, ніж один триплет, тому генетичний код стали |
|
||||||||||||
позначати |
терміном «вироджений», |
а |
різні |
триплети |
для |
однієї |
і тієї |
|
|||||
амінокислоти |
називають триплетами-синонімами. |
В |
подальшому |
було |
|
||||||||
встановлено, що кодон АУГ є знаком початку |
трансляції. Біля ініціюючого |
|
|||||||||||
кодону (АУГ) іРНК утворює спіральну«шпильку» (петлю), у якій знаходиться |
|
||||||||||||
кодон АУГ. Цю «шпильку» впізнає рибосома як місце приєднання до іРНК. |
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
53 |
|
|
|
|
Відповідність кодонів і-РНК амінокислотам |
Таблиця 6.1 |
|||||||||||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
Друга азотиста основа |
|
|
|
|
|
||||
|
|
|
|
У |
|
|
Ц |
|
|
А |
|
Г |
|
|
|
|
|
|
фенілаланін |
|
серин |
|
тирозин |
|
цистеїн |
У |
|
|
|||
|
|
У |
фенілаланін |
|
серин |
|
тирозин |
|
цистеїн |
Ц |
|
|
|||
|
|
лейцин |
|
серин |
|
стоп-кодон |
стоп-кодон |
А |
|
|
|||||
|
|
|
|
|
|
|
|||||||||
|
основа |
|
лейцин |
|
серин |
|
стоп-кодон |
триптофан |
Г |
основа |
|
||||
|
|
лейцин |
|
пролін |
|
гістидин |
|
аргинін |
У |
|
|||||
|
|
|
|
|
|
|
|
||||||||
|
|
Ц |
лейцин |
|
пролін |
|
гістидин |
|
аргинін |
Ц |
|
|
|||
|
азотиста |
лейцин |
|
пролін |
|
глутамін |
|
аргинін |
А |
азотиста |
|
||||
|
|
|
|
|
|
||||||||||
|
|
ізолейцин |
|
треонін |
|
аспарагін |
|
серин |
Ц |
|
|||||
|
|
|
лейцин |
|
пролін |
|
глутамін |
|
аргинін |
Г |
|
|
|||
|
|
|
ізолейцин |
|
треонін |
|
аспарагін |
|
серин |
У |
|
|
|||
|
Перша |
А |
ізолейцин |
|
треонін |
|
лізин |
|
аргинін |
А |
Третя |
|
|||
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
метионін |
|
треонін |
|
лізин |
|
аргинін |
Г |
|
|
|||
|
|
|
валін |
|
аланін |
|
асп. к-та |
|
гліцин |
У |
|
|
|||
|
|
Г |
валін |
|
аланін |
|
асп. к-та |
|
гліцин |
Ц |
|
|
|||
|
|
валін |
|
аланін |
|
глут. к-та |
|
гліцин |
А |
|
|
||||
|
|
|
|
|
|
|
|
||||||||
|
|
|
валін |
|
аланін |
|
глут. к-та |
|
гліцин |
Г |
|
|
|||
|
Крім 61 |
триплету |
|
іРНК, |
що |
містять інформацію про ту чи інш |
|||||||||
амінокислоту, були виявлені також три триплети (УАА, УАГ і УГА), які не несуть |
|||||||||||||||
такої |
інформації, |
але |
здатні |
зупиняти |
процес |
зчитування |
нуклеотидн |
||||||||
послідовності |
під |
час |
|
синтезу |
|
поліпептиду. Ці |
|
триплети |
були |
названі |
|||||
термінуючими, або «стоп»-триплетами («стоп»-кодонами).
Два параметри амінокислотних залишків мають особливе значення для структури білка: розмір і здатність взаємодіяти з водою. За останньою ознакою амінокислоти можна розділити дві групи: полярні або гідрофільні (взаємодіють із водою – аргинін, аспарагін, аспарагінова кислота, глутамін, глутамінова кислота, гістидин, лізин, серин, треонін) і неполярні або гідрофобні(відштовхуються від
молекул |
води – |
цистеїн, ізолейцин, лейцин, |
метионін, фенілаланін, триптофан, |
|||
тирозин, валін). Три гідрофобні залишки(аланін, гліцин, пролін) мають малий |
||||||
розмір, тому їх можна вважати«нейтральними» щодо спорідненості до води. У |
||||||
глобулярних |
водорозчинних |
білках |
співвідношення |
між |
гідрофобними |
|
полярними залишками дорівнює в середньому50:50. Унаслідок гідрофобного |
||||||
ефекту |
неполярні залишки |
прагнуть |
опинитися всередині |
структури, білка |
||
полярні залишаються на поверхні, зберігаючи взаємодію з водою. Це і є головна рушійна сила, яка змушує білковий ланцюг укладатися певним чином у просторі, формуючи компактну глобулярну структуру, що має певну функціональну активність.
Залежно від типу нуклеотиду в другій позиції, усі кодони можна розділити на чотири групи. До групи урацилу (урацил у другій позиції) належать гідрофобні амінокислоти великого розміру, до групи аденіну – великі полярні амінокислоти
54
(крім тирозину, але хоча й він загалом гідрофобний, також здатен утворювати водневий зв’язок), група цитозину сформована амінокислотами малого розміру. Тобто нуклеотидні заміни в першій і третій позиціях кодону у межах цих груп не викликають зміни властивостей амінокислоти, мінімізуючи вплив таких амінокислотних замін на просторову структуру білка, тобто генетичний код є відносно стійким до дії мутацій.
6.3. Властивості генетичного коду
Система запису генетичної інформації у ДНК(іРНК) у вигляді визначеної послідовності нуклеотидів називається генетичним кодом. Генетичний код відображений у таблиці3.1. Добре видно, що генетичний код вироджений: 20 амінокислот представлені 61 кодоном. Майже кожній амінокислоті відповідає декілька кодонів-синонімів.
Другою особливістю коду є тенденція до групування , кодонівякі відповідають одній амінокислоті. Часто основа у третьому положенні кодона є несуттєвою для її специфічності. Одна амінокислота може бути представлена чотирма кодонами, які відрізняються лише за третьою основою. Інколи різниця заключається у перевазі пурина над піримідином в цьому положенні. Меншу специфічність цього положення в кодоні називають виродженістю третьої основи.
Ця особливість, а також тенденція до подібності кодонів для амінокислот одного типу (тобто полярних, гідрофобних тощо) зводять до мінімуму ефект мутацій. При такій організації генетичного коду випадкова заміна якої-небудь азотистої з великою ймовірністю приведе до заміни на вихідну амінокислоту або ж заміни не відбудеться зовсім.
Тільки 61 із 64 триплетів використовується для позначення амінокислот. Яка ж функція трьох кодонів, що залишились? Триплети УАА, УАГ і УГА є кодонами термінаторами, на яких синтез білка зупиняється. Вони названі
«nonsens»-кодонами (термінаторами), які означають кінець синтезу даної поліпептидної молекули. До них відносяться такі триплети ДНК: АТТ, АЦТ, АТЦ; у РНК - УАА (охра), УГА (опал)і УАГ (амбер).
Властивості генетичного коду:
·Триплетність - одній амінокислоті в поліпептидному ланцюжку
відповідають три розташованих поруч нуклеотиди молекули ДНК (іРНК); мінімальна одиниця функції - триплет (кодон).
·Виродженість (надмірність) - одній і тій же амінокислоті може відповідати декілька кодонів.
· |
Неперекриваємість (дискретність) - один нуклеотид входить до |
|
складу тільки одного триплету. |
·Безперервність – між кодонами немає розділових знаків, тобто інформація прочитується безперервно.
· |
Специфічність - у переважній більшості випадків у всіх живих |
|
організмах однакові триплети кодують однакові амінокислоти |
55
·Універсальність - «стандартний» генетичний код працює однаково в організмах різного рівня складності – від вірусів до людини.
·Односпрямованість зчитування (побудова нового полінуклеотиду йде у напрямку 5/ => 3/).
· |
Серед |
триплетів |
генетичного |
коду |
є, |
котрітакі не |
кодують |
|
амінокислот. Вони |
названі «nonsens»-кодонами |
(термінаторами), що |
||||
позначають кінець синтезу даної поліпептидної молекули. До них відносяться в ДНК такі триплети: АТТ, АЦТ, АТЦ; у РНК - УАА, УГА, УАГ.
Запитання для самоперевірки:
1.За допомогою чого встановлюється відповідність між послідовністю гена і послідовністю білка?
2.Що таке генетичний код?
3.Ким і як був встановлений перший триплет іРНК– УУУ, що кодував амінокислоту фенілаланін?
4.З використанням якої методики і ким було розшифровано триплети для усіх 20 амінокислот?
5.Яку роль у генетичному коді відіграють нонсенс-кодони?
6.Сформулюйте основні положення генетичного коду.
7.Що означає поняття «неперекриваємості» генетичного коду?
8.У чому полягає виродженість генетичного коду?
9.Поясніть чи є генетичний код універсальним?
10.Яким чином 4 нуклеотиди молекули ДНК визначають послідовність20 основних амінокислот у молекулі білка?
11.Що є одиницею кодування у нуклеїнових кислотах?
12.Що означає поняття «синонімічності» кодонів ДНК, РНК?
13.Які амінокислоти є невиродженими і кодуються одним кодоном кожна?
14.Яке значення має кожна позиція нуклеотиду у складі триплету?
15.Який триплет генетичного коду є знаком початку трансляції?
16.Чому нуклеотидні заміни в першій і третій позиціях кодону не викликають зміни властивостей амінокислоти?
17.Яким чином організація генетичного коду зводить до мінімуму ефект мутацій?
18.Скільки триплетів генетичного коду використовується для позначення амінокислот?
19.Назвіть властивості генетичного коду.
20. Чому одиницею генетичного коду не може виступати , одваин обо чотири поруч розташовані нуклеотиди ДНК, РНК?
21.Що означає поняття «безперервності» генетичного коду?
22.Чи є генетичний код специфічним для усіх живих організмів?
23. |
Назвіть кодони, які не кодують амінокислот, |
виконують функцію |
|
зупинки синтезу білкової молекули. |
|
24. |
Що означає поняття «універсальності» генетичного коду? |
|

56
ТЕМА 7. СИНТЕЗ БІЛКІВ У КЛІТИНІ
7.1. Транскрипція іРНК
Інформація |
про |
первинну |
структуру |
білкової |
молекули |
закодова |
||||
послідовністю |
|
нуклеотидів у відповідній |
ділянці |
молекули - ДНКгені. |
|
|||||
Транскрипція – синтез РНК на матриці ДНК. Транскрипція є першим етапом |
|
|||||||||
перенесення |
генетичної |
інформації |
і представляє |
собою |
|
процес |
біосинтез |
|||
молекул РНК за програмою ДНК. Принципова суть цього процесу полягає в тому, |
|
|||||||||
що інформація структурного гена(або декількох розташованих поруч генів), що |
|
|||||||||
записана у |
формі нуклеотидної послідовності кодуючого ланцюга, |
Д |
||||||||
переписується (транскрибується) у нуклеотидну послідовність молекули РНК, яка |
|
|||||||||
синтезується |
в |
напрямку5'→3' на |
основі |
комплементарної |
відповідності |
|
||||
дезоксирибонуклеотидів матричного ланцюга ДНК рибонуклеотидам РНК(А–У, |
|
|||||||||
Г–Ц, Т–А, Ц–Г) (рис. 7.1). В якості продуктів транскрипції(транскриптів) можна |
|
|||||||||
розглядати всі типи молекул РНК, що приймають участь у біосинтезі білків в |
|
|||||||||
клітині – інформаційні РНК (іРНК), рибосомні РНК (рРНК) та транспортні РНК |
|
|||||||||
(тРНК). |
|
|
|
|
|
|
|
|
|
|
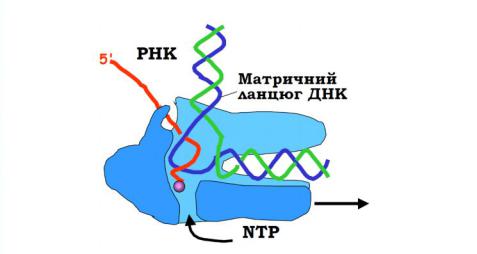
Рис. 7.1. Синтез РНК на матричному ланцюзі ДНК. (Стрілкою показаний напрямок зростання ланцюга РНК)
Процес транскрипції забезпечується комплексною дією ряду ферментів, до числа яких належить РНК-полімераза, що представляє собою складний білок, який складається з кількох субодиниць і здатний виконувати декілька функцій. На відміну від прокаріот, у клітинах яких є РНК-полімераза лише одного типу, що забезпечує синтез різних молекул РНК, у еукаріот встановлено наявність ядерних РНК-полімераз трьох типів (I, II, III), а також РНК-полімераз клітинних органел, що містять ДНК (мітохондрій, пластид). РНК-полімераза I знаходиться у ядерці і бере участь у синтезі більшості молекул рРНК, РНК-полімераза II забезпечує
синтез іРНК, а РНК-полімераза III здійснює синтез тРНК і одного варіанта молекули рРНК.
57
Транскрипція поділяється на три основні стадії – ініціацію (початок синтезу РНК), елонгацію (подовження полінуклеотидного ланцюга) і термінацію (закінчення процесу). Цей процес відбувається за участі ДНК-залежної-РНК- полімерази (рис. 7.2).
Рис. 7.2. Схема організації РНК-полімеразного комплексу (у розрізі) під час еленгації транскрипції
Дві великі субодиниці РНК-полімерази формують характерні«щелепи», із внутрішньою поверхнею яких взаємодіє ДНК. В залежності від напрямку руху РНК-полімерази один із двох ланцюгів ДНК буде обиратисяматричнийяк (антикодуючий) – той, на якому формується іРНК. Послідовність нуклеотидів іРНК збігається з послідовністю другого нематричного ланцюга ДНК, тому цей ланцюг ДНК називаютькодуючим, або змістовним. Його послідовність прийнято наводити як послідовність даного гену. Зростання ланцюга іРНК при транскрипції відбувається у напрямі від 5´- до 3´-кінця.
|
Оскільки структурні гени еукаріот мають переривчасту(мозаїчну) будову, |
|
|||||
то їх транскрипція має специфічні особливості, що відрізняють її від транскрипції |
|
||||||
у прокаріот. У разі еукаріотичного гену, що кодує синтез поліпептиду, цей процес |
|
||||||
починається з транскрибування всієї нуклеотидної послідовності, що містить як |
|
||||||
екзонні (кодуючі), так і інтронні (некодуючі) ділянки ДНК. При цьому молекула |
|
||||||
іРНК |
відображає |
структуру |
всього |
мозаїчного |
гену |
і |
її |
проінформаційною РНК (про-іРНК). Після синтезу про-іРНК відбувається процес |
|
||||||
її дозрівання (процесинг, див. підрозділ 7.3). |
|
|
|
|
|||
7.2. Трансляція іРНК
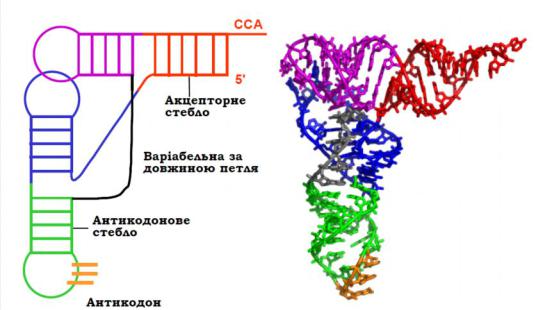
Молекули тРНК містять 73 – 93 (найчастіше 76) нуклеотидів. У складі тРНК формуються комплементарні дволанцюгові стебла та шпильки з петлями на кінцях за єдиною для всіх тРНК схемою(рис. 7.3). Кінцеві фрагменти тРНК об’єднуються у дволанцюгове стебло, причому чотири нуклеотиди на його3´- кінці залишаються неспареними. 3´-кінцевий триплет ЦЦА є стандартним для всіх тРНК, до рибози кінцевого нуклеотиду ковалентно приєднується амінокислота– відповідно, дане стебло називають акцепторним.
58
Рис. 7.3. Схема та просторова структура тРНК
Чотири дволанцюгові стебла попарно переходять одне в одне й формують дві приблизно перпендику-лярні одна одній подвійні спіралі. У результаті молекула тРНК приймає Г- або L-подібну форму з двома плечима різної довжини: на кінці одного плеча акцептується амінокислота(акцептор-не плече), на кінці іншого – у складі антикодонової петлі розташований антикодон(антикодонове плече).
Загальна кількість типів тРНК, які обслуговують процес білкового синтезу,
становить близько 40. |
Оскільки типів |
тРНК |
більше, ніж |
амінокислот, |
одній |
|
амінокислоті |
може |
відповідати |
кілька |
тРНК– такі |
тРНК |
називають |
ізоакцепторними. Типів тРНК менше, ніж кодонів, тому одна тРНК здатна розпізнавати кілька синонімічних кодонів.
Порядок залучення амінокислот до поліпептидного ланцюга, залежить лише від взаємодії між кодоном іРНК і антикодоном тРНК; рибосома не розпізнає амінокислоту, яку несе тРНК. Отже, приєднання (акцептування) певної амінокислоти до тРНК відповідного типу(і тільки відповідного) є одним із найважливіших моментів білкового синтезу: від точності цього процесу буде залежати й точність синтезу білка в цілому.
Процес приєднання амінокислот до тРНК каталізується фермент аміноацил-тРНК-синтетазою. Кожен із 20 типів (за кількістю амінокислот) цих ферментів є молекулярним пристроєм, який забезпечує високоточне приєднання амінокислот до відповідних тРНК. Спочатку амінокислота активується за участю АТФ з утворенням аміноацил-АМФ. Від АМФ аміноацильна група переноситься на 3´-кінцевий нуклеотид тРНК.
Рибосома – рибонуклеопротеїновий комплекс, який складається з двох субодиниць. Мала субодиниця прокаріотичної рибосоми містить одну молекулу 16S рРНК і 21 молекулу рибосомних білків. Велика субодиниця містить дві молекули рРНК (23S і 5S) і білки 36 типів.
59
Еукаріотична рибосома містить 18S рРНК (мала субодиниця), дві рРНК (28S і 5,8S) у великій субодиниці і більше 36 типів білків. Структура і принцип роботи про- і еукаріотичної рибосом подібні. Синтез еукаріотичних рРНК(18S; 5,8S і 28S) здійснюється в ядерці.
Рибосомні РНК становлять близько2/3 маси рибосоми і визначають її
структуру та функції. Рибосомні білки, що розташовані на поверхні рРНК(і, |
|
|||||
відповідно, на поверхні рибосоми), стабілізують її просторову організацію. |
|
|
||||
Під час роботи рибосоми її мала субодиниця взаємодіє з іРНК. Сумісно |
|
|||||
двома |
субодиницями |
рибосоми утворюються |
сайти |
зв’язування |
для |
трьо |
молекул |
тРНК: А-сайт |
(аміноацильний) – у |
ньому |
знаходиться |
тРНК |
з |
амінокислотою; Р-сайт (пептидильний) – тут із рибосомою взаємодіє пептидитРНК (тРНК, до якої приєднаний поліпептидний ланцюг, що синтезується); Е- сайт (сайт виходу тРНК з рибосоми) – куди потрапляє деаміноацильована тРНК перед її звільненням із рибосоми.
Трансляція як черговий етап реалізації генетичної інформації полягає в синтезі поліпептиду на рибосомі, при якому в якості матриці використовується молекула іРНК. Слід зауважити, що у клітинах прокаріот, які не мають ядра генетичний матеріал (ДНК) знаходиться в цитоплазмі, що визначає безперервний характер взаємозв’язку процесів транскрипції і трансляції. Іншими словами, одразу після утворення 5'-кінця молекули іРНК, синтез якої ще не завершено, вже здатний вступати в контакт з рибосомою, ініціюючи синтез поліпептиду, тобто транскрипція і трансляція у прокаріот відбуваються одночасно. Таким чином у клітинах прокаріот процеси транскрипції і трансляції не відмежовані у просторі і часі. Що стосується еукаріот, то процеси транскрипції їх ядерної генетичної інформації та її трансляції розділені, оскільки транскрипція відбувається у ядрі, а трансляція – у цитоплазмі клітини.
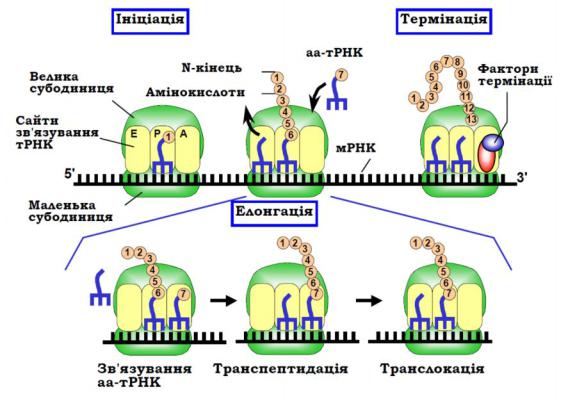
Безперевний процес трансляції (біосинтезу білка) поділяють на три етапи:
ініціація, |
елонгація та термінація(рис. 7.4). |
Зчитування |
інформації |
з іРНК |
здійснюється рибосомою в напрямку від5´- до 3´-кінця, а поліпептидний ланцюг |
||||
синтезується від N- до С-кінця. |
|
|
|
|
Ініціація. Для ініціації трансляції принципово важливе значення ма |
||||
специфічність структурної організації групи ідентичних рибосом(полірибосом |
||||
або полісом), яка може брати участь у |
синтезі первинної структури певної |
|||
білкової |
молекули (поліпептиду), кодованої |
відповідною |
іРНК. Як |
відомо, |
рибосома складаються з молекул рРНК, які визначають її специфічність, а також з білків. У складі рибосоми є2 структурні субодиниці (велика і мала), які можна
диференціювати |
на |
підставі |
їх |
здатності |
по-різному |
осіда |
ультрацентрифугуванні препаратів очищених рибосом із |
зруйнованих |
клітин, |
||||
тобто за коефіцієнтом седиментації (величиною S, одиниця Сведберга). За певних |
||||||
умов у клітині може відбуватися розділення (дисоціація) цих двох субодиниць або |
||||||
їх сполучення (асоціація). |
|
|
|
|
|
|
Рибосомою |
впізнається стартовий |
кодон, що задає |
початок і |
рамку |
||
зчитування інформації. На нього та в Р-сайт рибосоми одночасно завантажується ініціаторна аа-тРНК. Стартовим кодоном є здебільшого метіоніновий кодон АУГ,
60
відповідно, ініціаторною є завжди метионінова тРНК(за своєю структурою вона
відрізняється |
від звичайної метионінової тРНК, яка використо-вується для |
|||
включення |
метионіну |
усередині |
білкового |
).ланцюгаОтже, першою |
амінокислотою |
завжди |
виступає |
метионін(як |
правило, відщеплюється |
посттрансляційно).
Рис. 7.4. Схема процесу трансляції
Елонгація. Робота рибосоми під час елонгації трансляції полягає
послідовному зчитуванні інформації з іРНК(рибосома рухається вздовж іРНК з |
|
||||||||||
кроком 1 кодон) і відповідному |
приєднанні |
амінокислот |
до |
поліпептидного |
|||||||
ланцюга. Кожен такий крок складається з трьох |
операцій, що |
циклічно |
|
||||||||
повторюються (елонгаційний цикл). |
|
|
|
|
|
|
|
||||
Цикл розпочинається зі зв’язування аміноацил-тРНК з А-сайтом. Процес |
|
||||||||||
розміщення |
аа-тРНК |
в |
А-сайті |
супроводжується |
дисоціацією |
з |
Е-с |
||||
деаміноацильованої тРНК, яка залишилася там із попереднього циклу. Між |
|
||||||||||
амінокислотою, зв’язаною з тРНК у А-сайті і амінокислотною |
послідовністю |
||||||||||
тРНК, що міститься у Р-сайті утворюється пептидний зв’язок(забезпечується |
|
||||||||||
пептидилтрансферазним центром, що розміщений у |
великій |
субодиниці |
|||||||||
рибосоми і формується виключно рРНК, що забезпечує |
транспептидацію). |
|
|||||||||
Унаслідок транспептидації в А-сайті опиняється пептидил-тРНК із подовженим |
|
||||||||||
на одну амінокислоту |
пептидилом, |
у Р-сайті – |
деаміноацильована тРНК. Третя |
|
|||||||
операція (транслокація) полягає в переміщенні рибосоми на один кодон уздовж |
|
||||||||||
іРНК (при цьому молекули тРНК залишаються зв’язаними зі своїми кодонами), |
|
||||||||||
після чого розпочинається наступний елонгаційний цикл. |
|
|
|
|
|
||||||
Термінація. Коли після чергового елонгаційного циклу(який стане остан- |
|
||||||||||
нім) в А-сайті опиняється один із трьох стоп-кодонів, він розпізнається фактора- |
|
||||||||||
