
2013
.pdf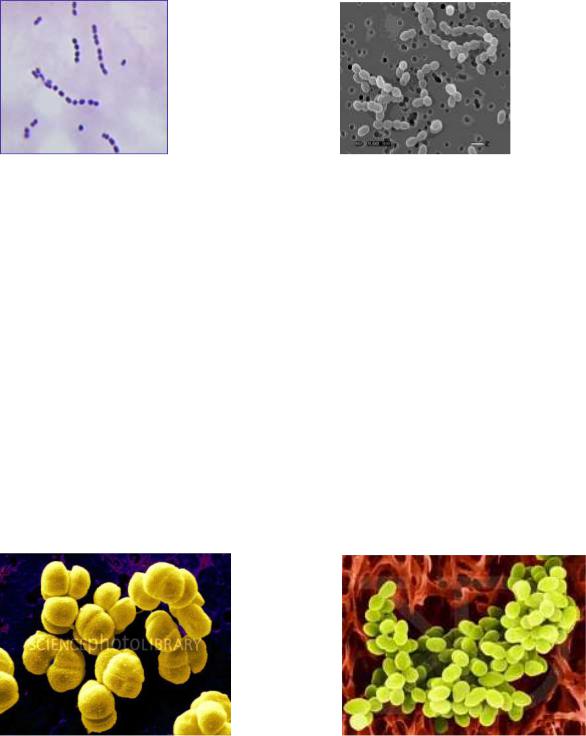
Рис. 19. Lactococcus lactis |
Рис. 20. Leuconostoc mesenteroides |
Бактерії Lactococcus lactis (стрептокок молочний) спричиняють скисання молока, використовуються у молочній промисловості для виготовлення кисломолочного сиру, сметани (рис. 19). Виявлені у коров’ячому гної, пилу, грунті, на рослинах і посуді. Форма клітин переважно овальна (d = 0,5–1 мкм).
Бактерії Leuconostoc mesenteroides (рис. 20) утворюють поодинокі клітини, диплококи або ланцюжки, на середовищі з сахарозою – капсули, які можна виявити, фарбуючи препарати розчином стерильної туші. Колонії слизуваті, майже безбарвні, великі (d = 2–4 мкм). Leuconostoc mesenteroides і L. dextranicum
поширені в цукрі, силосі, мелясі та інших багатих на вуглеводи рослинних продуктах. Ці бактерії завдають шкоди цукровій і спиртовій промисловості.
Сарцини (рис.21) – коки, що групуються в кубоподібні пакети різної величини. Число коків у пакеті кратне чотирьом. Це сапрофіти, що розвиваються у рослинних продуктах, які бродять головним чином у пивному суслі, пиві, засівних дріжджах. У результаті їх життєдіяльності пиво скисає, каламутніє, набуває медового смаку і запаху ("сарцинна хвороба"). Сарцини поширені у повітрі, пилу,
на зерні, в основному такі види Sarcina flava, S.lutea, S.maxima.
Рис. 21. Sarcina flava |
Рис. 22. Staphylocoсcus aureus |
Стафілококи (рис. 22) можна виявити на шкірі, слизових оболонках рота й носа людини, а також у багатьох харчових продуктах. Найчастіше зустрічаються види Staphylocoсcus aureus (утворює золотисто-жовтий пігмент) і S. albus (утворює білий пігмент). Ці бактерії – збудники фурункульозу, маститу, харчових отруєнь.
Паличкоподібні бактерії – циліндричні клітини, довжина яких становить у середньому 2 – 6, іноді 10 – 12 мкм. Довжина клітин одного й того самого виду варіює залежно від віку культури та умов вирощування: складу середовища, рН, аерації, температури та інших факторів. Палички можуть бути з’єднані попарно або в ланцюжки. Традиційно вони поділяються на дві групи: Васterium – палички,
31
що не утворюють спор, і Васіllиs – спороутворювальні палички.
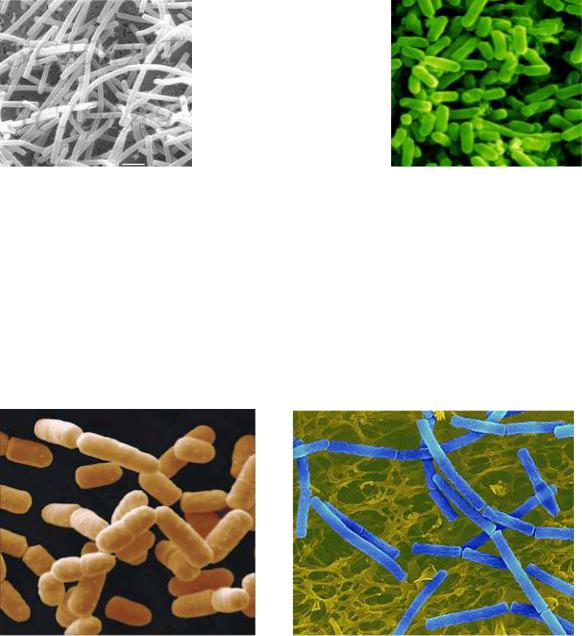
Молочнокислі бактерії роду Lactobacillus (рис. 23) завдовжки 2 – 7 і завтовшки 0,5 – 0,8 мкм зустрічаються поодиноко, інколи бувають з’єднаними в ланцюжки. Нерухомі, грампозитивні, гомота гетероферментативні, оптимальна температура розвитку 45 – 50 °С. У виробництві хліба і хлібобулочних виробів, для одержання кисломолочних продуктів, у виробництві молочної кислоти, у спиртовому виробництві застосовуються такі види молочнокислих бактерій:
L.casei, L.аcidophіlum, L.delbrueckii subsp. bulgaricus, L.plantarum, L.delbrueckii.
Рис. 23. Lactobacillus delbrueckii |
Рис. 24. Escherichia coli |
Оцтовокислі бактерії – грамнегативні палички завдовжки 1 – 2 мкм, діаметром 0,4 – 0,8 мкм, які утворюють довгі ланцюжки. Застосовуються для одержання харчового оцту, але одночасно є контамінантами вина, пива, квасу, інших харчових продуктів.
Бактерії Escherichia coli (кишкова паличка) мають такі розміри, мкм : діаметр 0,5, довжина 1 – 2. Поодинокі, грамнегативні, рухливі короткі палички, які постійно перебувають у кишковику людини і тварин, звідки потрапляють у воду, ґрунт, на рослини, різні предмети та ін. (рис.24). Вони є показниками санітарного стану води, харчових продуктів , обладнання, приміщень та обслуговуючого персоналу харчових підприємств.
Рис. 25. Bacillus subtilis |
Рис. 26. Васіllus megaterium |
У харчових виробництвах виявлено такі спорові паличкоподібні бактерії:
Васіllus subtіlis, B. cereus, B. megaterium та ін. (рис. 25, 26).
Bacillus subtilis (сінна паличка) – безбарвні колонії або сірувато-білі, трохи зморшкуваті або утворюють бархатистий наліт, край хвилястий, розгалужений,
32

щільно прилягає до агарового середовища. Палички короткі й тонкі завдовжки 3 – 6 мкм. Спори овальні, розташовані ексцентрально.
В. mesenteriсus (картопляна паличка) – колонії зморшкуваті, сірувато-білі, кремові, жовто-бурі, рідко забарвлені у чорний або рожевий колір. Палички тонкі, довгі або короткі завдовжки 3 – 10 мкм, поодинокі або з’єднуються у довгі нитки. Спори овальні, клітини не роздуті.
B.cereus – колонії плоскі, з рівною поверхнею, злегка ввігнуті, матові, з хвилястими краями. Клітини товсті завдовжки 3 – 5 мкм, діаметром до 1,5 мкм, поодинокі і з’єднані у нитки. Спори овальні, розташовані ексцентрально.
B.mycoides – колонії плоскі, ризоїдні (міцелієподібні), стеляться по поверхні агару. Клітини мають довжину 5 – 10 мкм, поодинокі або з’єднані у довгі ланцюжки у вигляді ниток.
B.megаterium – колонії правильної форми, округлі, з чітко окресленими краями, опуклі, кремові, молочно-білі, матові або з жирним блиском. Клітини товсті (до 2 мкм), завдовжки до 10 – 12 мкм, поодинокі або з’єднані в ланцюжки. Спори овальні або довгасті.
B.polymyxa – колонії безбарвні, плоскі або опуклі, гладенькі і слизуваті, часто
звиростами по краях. Клітини завдовжки 27 мкм, поодинокі, в парах або коротких ланцюжках. При утворенні спор роздуваються лимоноподібно або утворюють форми, що нагадують клостридії. Спори овальні, довгасті, розташовані у центрі клітини.
B.brevis – колонії білі, іноді з жовтуватим відтінком, опуклі або плоскі, блискучі, маслянистої консистенції. Клітини завдовжки 3 – 5 мкм, поодинокі, рідко з’єднані в ланцюжки. Спори овальні, розташовані на кінцях клітини. Маслянокислі бактерії – типові анаероби. Рухливі палички завдовжки 8 – 12 мкм. Нагадують форму cигари, оскільки діаметр спор більший, ніж діаметр клітини. Бактерії розвиваються за відсутності кисню. Поширені у природі. Багато сапрофітів використовуються в промисловості для одержання бутилового спирту, масляної кислоти та інших цінних продуктів (рис.27).
Рис. 27. Маслянокислі бактерії
Актиноміцети (гр. actis – промінь, mycos – гриб) – променисті грибки – група мікроорганізмів, що належать до прокаріотів, але дещо подібні до грибів. Як і бактерії, всі актиноміцети містять у складі клітинної стінки пептидоглікан, не мають диференційованого ядра, ширина клітин (0,5 – 1,5 мкм) подібна до
33
бактеріальних. Подібність до грибів виявляється у здатності клітин галузитися у вигляді міцелію й утворювати на кінцях гіф спори, що є для ряду родів актиноміцетів основним способом розмноження.
Нижчі форми актиноміцетів – проактиноміцети і коринеформні бактерії – охоплюють такі роди, як Mycobacterium, Nocardia, Arthrobacter, Corynebacteruim та ін. Це одноклітинні форми, у яких спостерігається тенденція до утворення міцелію чи клітин з мінливою неправильною формою у молодих культурах. З віком клітини більшості видів розпадаються на кокоподібні або овальні за формою. Плеоморфізм (морфологічне різноманіття) характерний для усіх видів, розмноження відбувається поділом клітин, фрагментацією міцелію чи утворенням спор.
Крім плеоморфізму, для корінебактерій характерно «розтріскування» клітин у процесі розмноження. Воно відбувається через те, що перетинка, яка з’єднує дочірні клітини, разшаровується на різних боках з різною швидкістю, так що клітини опиняються під кутом одна до одної. Водночас спостерігається і множинний поділ клітин, за якого з однієї довгої палички утворюються кілька коротких (рис.28).
а |
б |
в |
Рис. 28. Актиноміцети: а – корінебактерії; б – мікобактерії; в – стрептоміцети
Справжні актиноміцети або еуактиноміцети поєднуються в кілька родів. Один з них – рід Streptomyces. Ці мікроорганізми утворюють сильно розгалужений міцелій, що не має поперечних перегородок. Він частково вростає у поживне середовище, утворює щільний субстратний міцелій, важко відокремлюваний бактеріологічною петлею. Над поверхнею субстрату утворюється повітряний міцелій. Є особливі повітряні гіфи (спорофори), від яких відшнуровуються спори, що слугують для розповсюдження виду. Будова цих спорофор (прямі, хвилясті, спіральні, зібрані в пучки, мутовчасті тощо) є однією з систематичних ознак стрептоміцетів. Спори стрептоміцетів чутливі до нагрівання, однак у сухому стані можуть тривалий час зберігати життєздатність. Міцелій у справжніх актиноміцетів зберігається протягом усього життєвого циклу, на коки і палички з віком не розчленовується (рис.29). Більшість стрептоміцетів утворює пігменти, що забарвлюють колонії в різні кольори, часто пігменти виділяються в середовище.
34
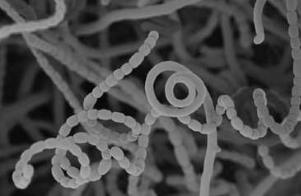
Рис. 29. Streptomyces sp.
Практичне застосування актиноміцетів. Багато видів роду
Corynebacteruim є продуцентами амінокислот. Більшість стрептоміцетів продукує біологічно активні речовин з антибіотичними властивостями, деякі з яких знайшли застосування в медицині: стрептоміцин (Streptomyces griseus), новоміцини
(Streptomyces fradiae), канаміцин (Streptomyces kanamyceticus) тетрацикліни (Streptomyces aureofaciens) тощо.
2.Культуральні ознаки бактерій
Зметою ідентифікації бактерій проводять посів чистих культур на щільні середовища у чашки Петрі і на скошений агар в пробірки. При рості на чашках Петрі розрізняють поверхневі, глибинні колонії. Вивчають і описують особливості поверхневих колоній, що розміщені ізольовано одна від одної, і відмічають такі ознаки:
1) формa колоній – кругла, овальна і т.д. (рис. 30);
2)розміри – діаметр вимірюють лінійкою і виражають в міліметрах: дрібні – 1
–2, середні – 2 – 4, крупні – більше 4, найдрібніші – менше 1 мм;
3)колір колоній і субстрату під колоніями (від білого до чорного);
4)поверхня – гладка, шорстка, складчаста, бугриста, блискуча, матова, борошниста, флуоресцируюча, волога, суха;
5)прозорість – прозора, напівпрозора, непрозора;
6)край колонії – встановлюють при малому збільшенні мікроскопа або за допомогою лупи (рис. 31);
7)структура колонії (встановлюють при малому збільшені мікроскопа) – однорідна, дрібнозерниста, волокниста;
8)профіль – плоский, вигнутий, каплеподібний, конусоподібний та ін. (рис.32);
9)консистенція (визначають за торканням бактеріальної петлі поверхні колоній) – щільна, мягка, тістоподібна, слизиста та ін.
35

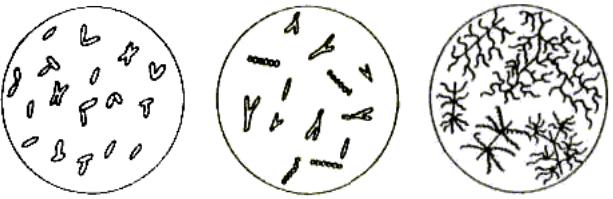
Рис.30. Форми колоній: а – кругла; б – кругла з фістончастим краєм; в – кругла з валиком по краю; г та д – ризоїдна; е – з ризоїдним краєм; ж – амебоподібна; з – ниткоподібна; и – складчаста; к – неправильна; л – концентрична; м – складна
Рис. 31. Край колоній : а – гладкий; б – хвилястий; в – зубчастий; г – лопатевий; д –
неправильний; е – вієподібний; ж – ниткоподібний; з – ворсинчастий; и – гілкоподібний
Рис. 32. Профіль колоній: а – вигнутий; б – кратероподібний; в – бугритий; г – вростаючий
в агар; д – плоский; е – випуклий; ж – каплеподібний; з – конусоподібний
Колонії, що відрізняються хоча б однією із зовнішніх ознак, варто розглядати як різні типи. Кожен вид бактерій має певний тип колонії, тому за кількістю типів
36
колоній в чашках Петрі можна судити орієнтовно про різноманітність видового складу бактеріальної мікрофлори досліджуваних харчових продуктів.
3. Приготування препаратів фіксованих і пофарбованих клітин
Переважна більшість бактеріальних клітин безбарвні, а також серед бактерій відові види, що здатні рухатись. Такі особливості дещо перешкоджають дослідженню їх морфологічних особливостей. Мікроскопіювання бактеріальних клітин найбільш зручно проводити при підготовці фіксованих забарвлених препаратів.
Фіксованими вважають клітини мікроорганізмів, у яких перервані життєві процеси, але цілком збережена тонка структура. Пофарбовані фіксовані клітини і деталі їхньої будови різкіше виділяються на фоні препарату. Це полегшує вивчення форми, розмірів, внутрішніх елементів (ядра, оболонки, спор, включень), спрощує підрахунок кількості клітин. Фіксовані препарати звичайно розглядають з імерсією. Приготування таких препаратів має такі етапи: приготування мазка, висушування, фіксація та фарбування.
Приготування мазка. На знежирене предметне скло нанести маленьку краплю очищеної води і петлею перенести в неї невелику кількість досліджуваного матеріалу, як для препарату „роздавлена крапля‖. Одержану суспензію рівномірно розподілити петлею або краєм покривного скла на площі 1 – 2 см2 якомога тоншим шаром, щоб вона висихала майже відразу після приготування мазка.
Сушіння мазка. Найкраще сушити препарат при кімнатній температурі на повітрі. Якщо мазок висихає повільно, препарат можна злегка нагрівати у струмені теплого повітря, тримаючи скло високо над полум’ям пальника мазком догори. Цю операцію слід виконувати дуже обережно, не перегріваючи мазок, інакше клітини мікроорганізмів деформуються.
Фіксація. Цей процес має на меті вбити мікроорганізми, тобто зробити їх безпечними, якщо вони патогенні; забезпечити найкраще прилипання клітин до скла, зробити мазок більш сприятливим до фарбування (мертві клітини забарвлюються краще, ніж живі). Поширений спосіб фіксації – термічна обробка. Для цього препарат треба тричі пронести через найгарячіше полум’я пальника, тримаючи предметне скло мазком догори. Не слід сильно перегрівати мазок, оскільки можуть статися грубі зміни зовнішнього вигляду клітини і внутрішніх клітинних структур (зморщування). Іноді застосовують хімічні способи фіксації: занурюють предметне скло з мазком у мензурку з 96 %-м етанолом на 15 – 20 хв, з безводним метанолом на 3 – 5 хв, з розчином Никифорова на 15 – 20 хв, із сумішшю 96 %-го етанолу і 40 %-го формаліну (співвідношення 95:5) на 2 хв. Можна фіксатор наливати безпосередньо на мазок і витримувати зазначений час. Після закінчення фіксації мазок обережно промивають легким струменем здистильованої води й фарбують.
Фарбування. Розрізняють прості, складні і диференціальні способи фарбування мікроорганізмів. При простому фарбуванні частіше використовують один барвник і профарбовують усю клітину. Це дає можливість чітко визначити форми і розміри клітин. Складне фарбування передбачає застосування двох або
37
декількох барвників, наприклад, діагностичне визначення відношення бактерій до фарбування за Грамом. Диференціальне фарбування засноване на індивідуальному відношенні біологічних структур клітин до різних барвників (фарбування спор, оболонки, ядра капсул, метахроматина й ін.).
Техніка фарбування. Фіксований препарат вмістити на паралельні скляні мостики, які лежать на стінках кристалізатора, і облити з піпетки кількома краплинами розчину вибраного барвника. Слід звертати увагу на те, щоб кінець піпетки не торкався мазка. Тривалість фарбування – від декількох секунд до 1 – 3 хв. Необхідно стежити, щоб під час фарбування розчин барвника на мазку не підсихав, і у разі потреби доливати нові порції. Після закінчення фарбування препарат промити струменем води доти, поки вода, що стікає, стане безбарвною. Потім препарат висушити на повітрі або обережно промокнути фільтрувальним папером і мікроскопувати з імерсією.
Фарбування ендоспор. Для фарбування ендоспор застосовують спеціальні складні методи, тому що багатошарова оболонка і кортекс спори важко проникні для основних барвників. З метою розпушення оболонки ендоспор фарбування мазків проводять сильним барвником при нагріванні, потім цитоплазму знебарвлюють і додатково фарбують у контрастний колір.
Фарбування за методом Пєшкова. Приготовлений тонкий мазок 2 – 3-добової культури бактерій фіксують на полум’ї пальника або сумішшю 5 частин 40 %-го формаліну і 95 частин 96 %-го етанолу впродовж 4 хв. Після фіксації мазок заливають метиленовою синню і доводять до кипіння, тримаючи предметне скло над полум'ям пальника. Тривалість фарбування 10 – 20 с. У міру випарювання додають нові порції фарби. Далі препарат ретельно промивають водою і протягом 30 с дофарбовують 0,5 %-м розчином нейтрального червоного. Знову препарат промивають водою, висушують і мікроскопують з імерсією. Мікроскопічна картина: спори – блакитні або сині (молоді спори – темно-сині), цитоплазма вегетативних клітин – рожева або червона.
Фарбування за методом Златогорова. Мазок спороутворювальних бактерій висушують на повітрі. Для фіксації та розпушення оболонок ендоспор мазок не менш 10 разів проводять над полум’ям пальника. На препарат кладуть смужку фільтрувального паперу, рясно змочують карболовим фуксином Циля, підігрівають 8 – 10 хв до появи пари (але не до кипіння). При цьому важливо, щоб барвник випаровувався, але папір не підсихав. Тому періодично додають нові порції фарби. Потім папір знімають і 6 – 10 с препарат знебарвлюють 5%-м розчином сульфатної кислоти і промивають водою. Вегетативні клітини при цьому знебарвлюються та їх додатково 2 хв фарбують метиленовою синню. Мазок знову промивають, сушать фільтрувальним папером і мікроскопують з імерсією. При правильно виконаних операціях спори фарбуються в яскраво-червоний колір і чітко виділяються на синьому фоні цитоплазми.
Фарбування за методом Леффлера в модифікації Пєшкова. Досліджувану культуру бактерій щодня протягом 2 – 3 днів пересівають на свіже напіврідке середовище, що містить не більш 0,5 % агару. Клітини петлею обережно
38
переносять у пробірку зі стерильною водою, підігрітою до температури, при якій культура вирощувалася. Краплю отриманої суспензії переглядають під мікроскопом і переконуються, що клітини добре рухливі і щільність суспензії становить 5 – 10 клітин у полі зору. Перед приготуванням мазка скло 3 – 4 рази проводять над полум’ям пальника, потім охолоджують і обпалену поверхню пастерівською піпеткою або петлею наносять 3 – 4 маленькі крапельки приготовленої суспензії бактеріальних клітин. Крапельки мають розтікатися по склу і швидко висихати. При тривалому висиханні бактерії часто втрачають джгутики. Висушений мазок заливають протравленням, витримують 15 хв без нагрівання, після чого протравлення змивають здистильованою водою. Далі препарат фарбують 5 хв розведеним водою фуксином Циля (1:1), занурюючи його мазком вниз у розчин барвника. Пофарбований мазок промивають водою, висушують на повітрі і розглядають з імерсією. При мікроскопуванні звертають увагу на розташування джгутиків, їхню кількість і довжину.
Фарбування капсул у бактерій. Для виявлення капсул застосовують спосіб негативного контрастування за допомогою чорної туші.
1. Негативне контрастування можна комбінувати з прижиттєвим фарбуванням клітин. Для цього краплю досліджуваної суспензії бактерій вмістити у краплю розбавленого розчину фуксину, потім змішати з краплею туші, накрити покривним склом і мікроскопувати з сухим об’єктивом.
2. Краплю бактеріальної суспензії внести у краплю карболового фуксину і залишити на 3 – 5 хв. Додати одну краплю туші й витримати з імерсією.
У полі зору на чорному тлі добре помітні червоні бактеріальні клітини і безбарвні капсули.
Фарбування бактерій за Грамом. Метод запропонований данським вченим Грамом у 1884 р. Суть фарбування полягає в тому, що при обробленні генціанвіолетом та йодом у клітинах одних мікроорганізмів (грампозитивних) утворюється стійкий і не розчинний у спирті комплекс, клітини інших мікроорганізмів (грамнегативних) після оброблення зазначеними барвниками легко знебарвлюються спиртом і набувають червоного кольору при подальшому обробленні фуксином.
Здатність забарвлюватися за Грамом залежить від фізико-хімічного складу оболонки цитоплазми і віку культури, тому фарбувати, за Грамом, завжди слід молоді, найчастіше однодобові культури.
Фарбування за Грамом виконують так. На знежиреному предметному склі приготувати три мазки з різних культур. У центр нанести мазок досліджуваного мікроорганізму, ліворуч і праворуч – мазки контрольних мікроорганізмів; грампозитивні – стафілококи, сарцини; грамнегативні – кишкова паличка. Мазки висушити на повітрі, фіксувати над полум’ям пальника. На фіксовані мазки покласти смужку фільтрованого паперу і налити розчин карболового генціанвіолету. Мазки фарбувати протягом 1 – 2 хв. Папір з барвником зняти і, не промиваючи водою, обробляти мазок розчином Люголя протягом 1 – 2 хв до повного почорніння. Потім розчин злити, препарат промити водою і 30 с обробляти етиловим спиртом для знебарвлення, для чого занурити предметне скло 2 – 3 рази в склянку зі спиртом або налити спирт на мазок. У цьому разі скло
39
злегка похитувати і спирт змінювати кілька разів. Далі препарат промити водою і додатково забарвити водним розчином фуксину протягом 1–2 хв. Фуксин злити, препарат знову промити водою, висушити і мікроскопувати з імерсією.
За правильного фарбування грампозитивні бактерії забарвлені в синьофіолетовий колір, грамнегативні – в червоний – колір фуксину.
4. Поживні середовища для культивування мікроорганізмів і способи стерилізації
Склад і призначення поживних середовищ. До складу поживних середовищ мають входити органічні елементи (C, H, О, N), зольні елементи ( Р, S, К, Ca, Mg, Fe ) і деякі мікроелементи (Mn, Cu, Na, Cl, Zn, B, Mo) тощо у формі сполук, що легко засвоюються мікроорганізмами. Вуглець споживають мікроорганізмигетеротрофи у формі глюкози, інших цукрів, органічних кислот, спиртів та інших сполук. Джерелом азоту можуть бути білки, пептони, амінокислоти. Решту елементів вводять у вигляді солей. Джерелом факторів росту можуть бути дріжджові екстракти або автолізати.
За складом поживні середовища поділяються на природні (натуральні) та штучні (синтетичні).
Натуральні середовища готують із продуктів тваринного або рослинного походження (наприклад шматки картоплі, моркви, м’ясна вода, гідролізоване молоко, солодове сусло, дріжджова вода та ін.). Їх використовують для вирощування мікроорганізмів, нагромадження біомаси, зберігання чистих культур, але вони мало підходять для вивчення фізіології обміну речовин.
До складу синтетичних середовищ входять точно вказані концентрації певних органічних або неорганічних хімічних сполук (амінокислот, цукрів, мінеральних солей, вітамінів). Наприклад, середовище Рідер для вирощування дріжджів, середовище Чапека для грибів та ін. Їх використовують для дослідження обміну речовин, виявлення закономірностей росту чи біосинтезу яких-небудь метаболітів та ін.
За призначенням розрізняють універсальні, селективні та диференціальнодіагностичні середовища. До універсальних належать середовища, сприятливі для росту багатьох видів мікроорганізмів (м’ясопептонний бульйон (МПБ), неохмелене пивне сусло та ін.). Елективні, або вибіркові, середовища забезпечують розвиток лише певних мікроорганізмів чи груп споріднених видів. Диференціально-діагностичні, або індикаторні, середовища використовують для диференціювання видів мікроорганізмів (наприклад середовище Ендо та ін.).
За консистенцією поживні середовища бувають щільними, рідкими і сипкими. Рідкі середовища застосовують для нагромадження біомаси мікроорганізмів, дослідження їх фізіолого-біохімічних властивостей, рідше – для зберігання, щільні – для виділення чистих культур, одержання ізольованих колоній, зберігання чистих культур у музеях та ін. Сипкі середовища (висівки, пшоно, буряковий жом, макуха та ін.) використовують для зберігання деяких видів мікроорганізмів та їх спор, приготування посівного матеріалу.
Для одержання щільних середовищ використовують агар, желатин і
40
