
2013
.pdfЯкщо помістити бактерії в гіпотонічний розчин, то відбувається зворотний процес, що характеризується проникненням води всередину клітини, що приводить до розбухання вмісту клітини, клітина набуває форми кулі й відбувається розрив оболонки. Таке явище називається плазмоптиз.
Багато мікроорганізмів чутливі до зміни звичної для них концентрації речовин у середовищі, деякі пристосовуються до цього. Так є осмотолерантні і навіть такі, котрі розвиваються в середовищі тільки з високою концентрацією речовин, тобто живуть при високому осмотичному тиску – осмофільні види. До них належать деякі представники дріжджів і міцеліальних грибів ріст яких спостерігається на середовищах, що містять 20 % цукру і більш. Такі мікроорганізми нерідко виявляються в солодких сиропах і варенні.
Осмофільні мікроорганізми, стійкі до високих концентрацій кухонної солі, називаються галофілами. Відомі також бактерії, названі екстремальними галофілами, оптимальна концентрація хлористого натрію для який 20—25%, а ріст їх можливий і при більш високому вмісті NaCI (30—32%), тобто практично в насиченому його розчині. Якщо ж концентрація хлористого натрію нижче 8— 12%, то ріст більшості таких бактерій, що відносяться в основному до сімейства Halobacteriaceae, не відбувається, а в деяких видів клітини лізуються.
2.2. Вплив реакції (рН) середовища
Відношення мікробів до реакції середовища дуже різноманітна. Кожен вид мікроорганізмів розвивається в певних значеннях рН середовища. При мінімальному й максимальному значенні рН життєдіяльність мікроорганізмів відбувається дуже повільно, при оптимальному – найінтенсивніше. При значенні рН нижче мінімального і вище максимального життєдіяльність мікроорганізмів припиняється і спостерігається навіть їх відмирання. Для більшості пліснявих грибів або дріжджів найсприятливішим є слабкокисле середовище, для бактерій – нейтральне. Однак відомі й ацидофільні форми, що не ростуть при рН вище 5,0— 5,5. Деякі з них є до того ж термофілами. З іншого боку, є алкалофільні мікроорганізми, оптимальне значення рН середовища для росту яких 10,0—11,0.
2.3. Вплив температури
Розвиток і життєдіяльність кожного виду мікроорганізмів можуть відбуватися тільки в певних межах температури. Мікроорганізми позбавлені механізмів, що регулюють температуру, тому їх існування визначається температурою навколишнього середовища.
Найменша температура, при якій спостерігається розвиток мікроорганізмів, хоч і дуже слабкий, називається мінімальною. Нижче цієї температури розвиток зупиняється, але мікроорганізми більш менш тривалий час можуть зберігатися живими. Найбільша температура, при якій ще може спостерігатися слабий розвиток мікроорганізмів, називається максимальною. Навіть при незначному перевищуванні температури розвиток мікроорганізмів зупиняється, і вони швидко гинуть. Температура, при якій розвиток мікроорганізмів відбувається найліпше, називається оптимальною.
61
Стосовно температури мікроорганізми можна підрозділити на психрофіли, мезофіли і термофіли. До психрофілів (греч. psichros — холод) відносять холодолюбні мікроорганізми, зокрема деякі ґрунтові і морські бактерії, а також хвороботворні для риб і водяних рослин мікроорганізми.
Багато з психрофілів добре розмножуються при температурах, сприятливих для мезофілів, однак можуть рости, хоча і повільно, при 0° С и нижче, тому їх називають факультативними психрофілами.
Інші мікроорганізми пристосувалися до існування при досить низьких температурах (близько 0° С и нижче), а при 25 ° С і вище вони гинуть. Подібні мікроорганізми відносять до облігатних психрофілів.
Психрофіли зустрічаються головним чином у холодних районах зі стійким температурним режимом.
Для мезофілів оптимальна температура складає 30...45°С. До цієї групи відноситься більше всього мікроорганізмів, у тому числі патогенних для людини і тварин.
Термофіли розвиваються при високій температурі: мінімум не нижче
35...40°С, оптимум 55...75 °С.
Здатність деяких неспороутворюючих бактерій гарячих джерел існувати при температурі 80...93 °С і вище дала підставу для виділення цих організмів у нову групу екстремальних-термофільних бактерій.
У природі термофільні мікроорганізми живуть у гарячих джерелах і беруть безпосередню участь у процесах самонагрівання гною, сіна, зерна тощо. Термофільні форми є серед бактерій, актиноміцетів, водоростей, грибів і найпростіших.
Мікроорганізми по-різному переносять граничні температури. Якщо низькі температури мікробні клітини переносять, після розморожування зберігаючи здатність до росту, то під впливом високих температур вони досить швидко гинуть. Високі температури (60 °С і вище) викликають коагуляцію білків і інактивацію ферментів.
Як правило при 60...70 °С гинуть вегетативні клітини. Нагрівання до 100...120°С використовують у мікробіології для повного знищення як вегетативних форм мікроорганізмів, так і їх спор. Це найбільш зручний і надійний спосіб стерилізації.
2.4. Вплив отруйних речовин на мікроорганізми.
Потрапляючи в бактеріальну клітину, отруйні речовини порушують її функції. Це приводить до зупинки росту організму - бактеріостатичний чи ефект його загибелі - бактерицидний ефект.
По характеру дії серед хімічних сполук виділяють:
поверхнево-активні речовини — жирні кислоти, мила, детергенти, що викликають ушкодження клітинної стінки;
-фенол, крезол і їхні похідні, що ушкоджують, крім клітинної стінки, і білки цитоплазми;
-акридини, що мають спорідненість з нуклеїновими кислотами, унаслідок чого процеси клітинного поділу порушуються;
62
-формальдегід (40 %-й розчин називають формаліном), що викликає денатурацію білків;
-солі важких металів, що викликають коагуляцію білків і тим самим зумовлюють загибель як мікробів, так і вірусів.
Характер дії отруйної для мікроорганізму речовини — бактерицидний чи бактеріостатичний - залежить від дози. Однак є мікроби, стійкі до дії загальних клітинних і метаболічних отрут (фенол, оксид вуглецю, сірководень і ін.), а деякі з них здатні використовувати отрути як джерела харчування.
Хімічні речовини, що згубно діють на мікроорганізми, називаються
антисептиками. Дія антисептиків на мікроорганізми залежить від хімічної структури речовини, його концентрації, тривалості контакту з клітиною (експозиції), а також від чутливості мікроорганізмів до даної речовини. У значній мірі активність антисептиків визначається і складом середовища, у якій знаходяться мікроорганізми.
Більшість антисептиків належить до групи загальноцитоплазматичних отрут, тобто отрут, що діють не тільки на мікроби, але і на будь-яку тваринну і рослинну клітину. Тому їхнє застосування для консервування харчових продуктів вкрай обмежено, а речовини, що дозволяється використовувати як консерванти, використовуються в малих дозах (від тисячних до десятих часток відсотка) і тільки для деяких видів продуктів.
Бактерицидний вплив антисептиків на розвиток мікроорганізмів використовують у харчовій промисловості. Для знищення мікроорганізмів у процесі виробництва ці речовини додають до харчового продукту. На бактерицидній дії антисептиків на мікроорганізми засноване копчення м'яса, риби й інших продуктів. Під час копчення продукт просочується димом, що містить летучі речовини, що мають антисептичні властивості.
До дезинфікуючих речовин, крім перерахованих, відносять також хлорвмісні препарати, кислоти, луги й ін. Згубну дію на бактерії справляють багато окислювачів (хлор, озон, перекис водню, перманганат калію) і ряд газів (диоксид вуглецю, сірчистий газ, сірководень).
3. Вплив біологічних факторів на мікроорганізми Взаємини мікроорганізмів. Мікроорганізми в природі тісно
взаємозалежні один від одного. Взаємини їх між собою бувають або сприятливими, тобто такими, що приносять взаємну користь, або шкідливими -
антагоністичними.
У ряді випадків спостерігаються асоціативні взаємини, коли, змінюючи компоненти середовища, одні мікроорганізми створюють сприятливі обставини для інших. Так, аероби, поглинаючи кисень, сприятливо впливають на розвиток анаеробів.
Нерідко продукти життєдіяльності одних мікробів служать джерелом енергії або живильних речовин для інших. Це явище називають метабіозом. Так, нітрифікуючі бактерії одержують енергію при окислюванні аміаку, що утворюється в результаті життєдіяльності амоніфікуючих бактерій. Квашення плодів і овочів, здійснюване молочнокислими бактеріями, супроводжується
63
розвитком молочної цвілі - геотрихум кандидум (Geotrichum candidum), що використовує молочну кислоту як джерело енергії.
Симбіоз - спільне існування мікроорганізмів:
Мутуалізм ( взаємовигідний симбіоз ) – співіснування взаємовигідне для обох симбіонтів, спільно вони розвиваються краще, ніж кожен окремо. (Молочнокислі бактерії + дріжджі → в процесі виготовлення кисломолочних продуктів, хліба ).
Синергізм – співдружня дія двох або декількох видів мікроорганізмів, коли при спільному розвитку підсилюються окремі фізіологічні функції (наприклад, підвищується синтез певних речовин ).
Метабіоз (коменсалізм) – один із симбіонтів живе за рахунок продуктів життєдіяльності іншого, не приносячи йому шкоди. (наприклад, мікроорганізми, які розщеплюють білки і мікроорганізми, які здатні використовувати продукти розпаду білків).
Існують асоціації між мікро- і макроорганізмами, названі симбіозом. Прикладами таких взаємин можуть служити:
симбіоз гриба з рослиною при утворенні мікориз; симбіоз бульбошкових бактерій з бобовими рослинами; симбіоз целюлозоруйнівних бактерій, що живуть у рубці тварин, із твариною й ін.
Паразитизм – користь отримує лише один із партнерів , приносячи шкоду (інколи до загибелі) своєму партнеру. ( збудники інфекційних захворювань людей та тварин ).
Антагонізм – один вид мікроорганізмів пригнічує або призупиняє розвиток іншого, або викликає його загибель. (Молочнокислі бактерії є антагоністами гнильних бактерій, так як продукт енергетичного обміну молочнокислих бактерій – молочна кислота – гальмує розвиток гнильних бактерій. Ідея використання антагонізму між молочнокислими бактеріями і гнильними бактеріями належить Мечнікову).
Антагонізм відіграє важливу роль у природному відборі, змінності та еволюції мікроорганізмів. Антагонізм між мікроорганізмами може бути викликаний наступними причинами: конкуренцією за живильні речовини; дією антибіотиків, вироблюваних деякими мікроорганізмами; знищенням одних мікроорганізмів іншими. Вивчення явища антагонізму в життєдіяльності мікроорганізмів призвело до відкриття антибактеріальних речовин – антибіотиків.
Антибіотики (від грец. ―анти‖ – проти, ―біос‖ – життя) – речовини мікробного, тваринного і рослинного походження, які пригнічують розвиток і біохімічну активність чутливих до них мікроорганізмів.
В процесі боротьби за існування, мікроорганізми виділяють різні за хімічною будовою та силою дії речовини, які можуть виявляти бактеріостатичну дію ( пригнічення росту та розмноження мікроорганізмів) або бактерицидну (загибель мікроорганізмів), або бактеріолітичну (лізис клітин мікроорганізмів). Сила дії залежить від природи антибіотика, його концентрації, часу дії, мікроструктури клітин організму та від зовнішніх умов: tº, pH, rH2 та ін.
64
Протибактерійні властивості зеленої плісняви вперше були встановлені в 1871 р. російським вченим Манасеіним. Потім це явище стали застосовувати в практиці для лікування гнійних ран – пов’язки з зеленою пліснявою або спорами в мигдальному маслі.
В 1928 р. англійський мікробіолог Флемінг виявив серед колоній бактерій, які виросли на поживному середовищі, зелену плісняву, навколо якої не росли стафілококи. Таким чином, встановили антагонізм зеленої плісняви по відношенню до стафілококів.
Останнім часом доведено, що деякі молочнокислі бактерії можуть крім молочної кислоти виділяти антибіотики, стійкі до високої температури і кислоти.
Властивості антибіотиків: вибірковість дії, висока антибіотична активність, дія при низьких концентраціях.
Мікроорганізми можуть адаптуватися до дії антибіотиків, виникає явище резистентності (звикання).
На сьогодні виділено велику кількість антибіотичних речовин, які знайшли широке практичне застосування:
Пеніцилін – антибактеріальна речовина, яка виділяється грибом Penicillium chryzogenum, P. notatum. Він діє на грампозитивні мікроорганізми і не діє на грамнегативні. Найбільш чутливі до пеніциліну: стрептококи, стафілококи, пневмококи.
Під впливом антибіотику у мікроорганізмів відбувається порушення синтезу клітинної оболонки, лізис протоплазми та загибель клітин.
Стрептоміцин – антибіотик, що утворюється одним із видів променевих грибів – актиноміцетом Actinomyces globisporum. Має властивість пригнічувати ріст як грампозитивні, так і грамнегативні, туберкульозної палички.
Проникаючи вглиб клітини, стрептоміцин зв’язується з різними внутрішньоклітинними сполуками, що і зумовлює його біологічну активність.
Тетрациклін – виділяють із культуральної рідини Actinomyces aureofaciens. Мають широкий спектр дії. Група цих антибіотиків (хлортетрациклін, окситетрациклін та ін.) знижують процес дихання бактерій, зменшують окиснення вуглеводів, гальмують утворення нуклеїнових кислот.
Трихотецин – антибіотик немедичного призначення, який виробляється грибом Trichothecium roseum. Має високу протигрибкову дію. Застосовується для боротьби з хворобами овочевих та плодових культур.
Нізин – антибіотик, який виробляється деякими молочнокислими бактеріями. Інгібує ріст стафілококів та стрептококів. Нізин використовується в консервній промисловості для зниження термостійкості бактерійних спор. Нізин застосовується при виготовлення згущеного молока, плавлених сирів, ікри.
Антибіотики в харчовій промисловості застосовують для консервування ряду продуктів (риби, птиці), а також для боротьби з мікроорганізмами – шкідниками дріжджового, бродильного виробництва.
Вимоги до антибіотиків, які використовуються у харчовій промисловості:  широкий спектр дії,
широкий спектр дії,
65
легке руйнування при термічному обробленні, не погіршувати органолептичні властивості продукта, бути нешкідливим для організму людини.
Відомі також антибіотичні речовини, вироблювані вищими рослинами (фітонциди) і тваринними організмами.
Це речовини, які виділяються вищими рослинами і володіють антимікробною дією. Вони різняться за хімічною природою й силою дії. Одні з них викликають загибель мікроорганізмів, інші лише пригнічують їх розвиток. Фітонциди володіють вибірковістю: кожен діє тільки на певні мікроорганізми. Ефект дії залежить від часу, умов і стійкості мікроорганізму.
Деякі фітонциди застосовуються в медичній практиці. Ведуться дослідження по вивченню можливості застосування фітонцидів з метою збільшення строків зберігання харчових продуктів, що швидко псуються.
4. Мікробіологічні методи дослідження чутливості мікроорганізмів до антимікробних препаратів
Для визначення чутливості мікроорганізмів до дезинфікуючих препаратів найчастіше використовують методи засновані на явищі дифузії антимікробної речовини в агар, до них належать наступні методи:
паперових дисків, циліндрів, лунок в товщі агару,
радіальних штрихів.
Першим етапом для трьох перших методів є виконання посіву тестової культури на щільне поживне середовище однорідним шаром. Дані методи дозволяють проводити оцінку чутливості досліджуваної культури одразу до декількох дезинфікуючих препаратів.
Метод паперових дисків (рис. 47А) полягає у дифузії в агар антибіотиків зі стандартних паперових дисків, які просочені певним дезрозчином в чітко визначеній концентрації. Такі диски встановлюються на щільне поживне середовище з попередньо засіяною культурою рівномірно на відстані від краю чашки Петрі близько 20 мм та на такій же відстані один від одного. В одній чашці можна встановлювати диски з різними препаратами або з різними концентраціями однієї досліджуваної речовини.
Метод циліндрів (рис. 47Г) відрізняється від попереднього тим, що на поживне середовище із засіяною рівномірним «газоном» культурою встановлюють за допомогою пінцета стерильні фарфорові, металеві чи скляні циліндри з дотриманням відстаней наведених у попередньому методі. Далі у
встановлені циліндри вносять досліджувані розчини дезрозчинів в кількості 0,1 см3.
Метод лунок в товщі агару (рис. 47В). Після засіву поживного середовища відповідною тест-культурою за допомогою стерильного свердла виконують лунки на відстані 1,5 – 2,0 см від краю чашки. В лунки вносять водні розчини певного дезінфікуючого засобу різної концентрації, або різні засоби.
66

При виконанні дослідження методом радіальних штрихів (рис. 47Б) у щільному поживному середовищі вирізають воронку чи доріжку по центру або біля краю чашки Петрі в утворену порожнину вносять певну кількість розчину будь-якої антимікробної речовини, дають їй повністю всмоктатися в агар, а далі проводять посіви різних тест-культур штрихом від краю доріжки.
Для оцінки ступеню чутливості мікроорганізмів до антимікробних препаратів при виконанні дослідження будь-яким із наведених методів вимірюють зону затримки росту тестової культури. Відсутність зони затримки росту вказує на те, що досліджувана культура не чутлива до дії даного антимікробного засобу. При діаметрі зони до 15 мм вважають, що мікроорганізми мають малий ступінь чутливості до досліджуваного засобу, діаметр зони від 15 до 25 мм вказує на середній ступінь чутливості. Наявність зони діаметром більше 25 мм свідчить про високий ступінь чутливості мікроорганізмів до даного антимікробного засобу.
За допомогою методів лунок в товщі агару та циліндрів можна перевірити ефективність дезінфікуючої дії антимікробного препарату (АМП) використовуючи в якості тест-культур типові для певного виду виробництва контамінанти.
А |
Б |
В |
Г |
Рис. 47. Дослідження чутливості мікроорганізмів до антимікробних препаратів методом: А
– паперових дисків, Б – радіальних штрихів, В – лунок в товщі агару, Г – циліндрів.
67

Використовуючи один і той же препарат, але у різних концентраціях користуючись методами паперових дисків, лунок в товщі агару та циліндрів можна також визначити мінімальну інгібуючу концентрацію (МІК) антимікробного засобу. За потреби можна з більшою точністю визначити МІК антимікробних препаратів використовуючи метод Є-тесту.
Є-тест являє собою вузьку смужку полімеру (0,5 x 6,0 см), на яку нанесений градієнт концентрацій антибактеріального препарату (АБП) (від мінімальних до максимальних). Пригнічення росту мікроорганізму довкола смужки Є-тесту відбувається лише в тій зоні, де концентрація АБП, дифундуючого з носія, вища МІК, при цьому утворюється краплевидна зона затримки росту (Рис.48). Значення концентрації АБП в кожній ділянці носія друкарським способом нанесені на зовнішній (зверненій до дослідника) поверхні Є-тесту. Величину МІК враховують в тому місці, де кордон зони затримки росту впритул прилягає до носія.
Рис. 48. Визначення МІК антимікробних препаратів методом Є-тесту
Завдання на виконання
1.Визначити вплив різних концентрацій кухонної солі на спороутворювальні і неспороутворювальні бактерії.
2.Визначити вплив різних концентрацій глюкози на дріжджі і плісняві гриби.
3.Провести визначення впливу температури на життєдіяльність культур дріжджів S.cerevisiae
4.Провести дослідження дії антибіотиків ( розчинів деззасобів) на Sarcina flava, Escherichia coli, Bacillus subtilis, Bacillus mesentericus, Candida valida, Rhodotorula glutinis, Rhizopus nigricans, Aspergillus niger, Penicillium chryzogenum, Fusarium culmorum методом паперових дисків чи методом лунок в товщі агару.
5.Провести дослідження дії фітонцидів цибулі і часнику на бактерії
(Sarcina flava, Escherichia coli) і міцеліальні гриби (Rhizopus nigricans, Penicillium chryzogenum).
68
Особливості виконання:
1. Визначення впливу концентрації кухонної солі (NaCl) у середовищі на бактерії
 Виконати посів бактерій у МПБ із 5-, 10- і 20%-ю концентрацією NaCl і без нього (контроль).
Виконати посів бактерій у МПБ із 5-, 10- і 20%-ю концентрацією NaCl і без нього (контроль).
 Посів бактерій з бульйонної чистої культури виконувати бактеріологічною петлею, дотримуючись правил асептики. Бактеріологічну петлю перед кожним посівом стерилізувати в полум’ї газового пальника.
Посів бактерій з бульйонної чистої культури виконувати бактеріологічною петлею, дотримуючись правил асептики. Бактеріологічну петлю перед кожним посівом стерилізувати в полум’ї газового пальника.
 Пробірки з засіяними середовищами зібрати в склянку з етикеткою, яка містить таку інформацію: прізвище студента, номер групи, назву та дату виконання аналізу; підписану склянку з посівами помістити в термостат із температурою 30 ºС.
Пробірки з засіяними середовищами зібрати в склянку з етикеткою, яка містить таку інформацію: прізвище студента, номер групи, назву та дату виконання аналізу; підписану склянку з посівами помістити в термостат із температурою 30 ºС.
2. Визначення впливу концентрації глюкози в середовищі на пліснявий гриб ( або дріжджі)
 Виконати посів спор пліснявого гриба (або дріжджів) у пивне сусло з 10-, 20- і 30 %-ю концентрацією глюкози і без неї (контроль).
Виконати посів спор пліснявого гриба (або дріжджів) у пивне сусло з 10-, 20- і 30 %-ю концентрацією глюкози і без неї (контроль).
 Далі дослід проводити за тієї ж послідовності, як описано в попередньоому завданні.
Далі дослід проводити за тієї ж послідовності, як описано в попередньоому завданні.
3. Визначення впливу температури на життєдіяльність культур дріжджів
S.cerevisiae.
 Виконати посів суспензії дріжджів S.cerevisiae у 3 пробірки пивного сусла з 10-%-ю концентрацією глюкози.
Виконати посів суспензії дріжджів S.cerevisiae у 3 пробірки пивного сусла з 10-%-ю концентрацією глюкози.
 Посів проводити в тій же послідовності, як перший дослід за тим виключенням, що посіви для культивування встановлюють: першу пробірку - в термостат із температурою 30 ºС, другу - в холодильник з температурою 5 ºС а третю – залишають при кімнатній температурі (близько 20 ºС).
Посів проводити в тій же послідовності, як перший дослід за тим виключенням, що посіви для культивування встановлюють: першу пробірку - в термостат із температурою 30 ºС, другу - в холодильник з температурою 5 ºС а третю – залишають при кімнатній температурі (близько 20 ºС).
4. Дослідження антибактеріальної дії антибіотиків (розчинів деззасобу).
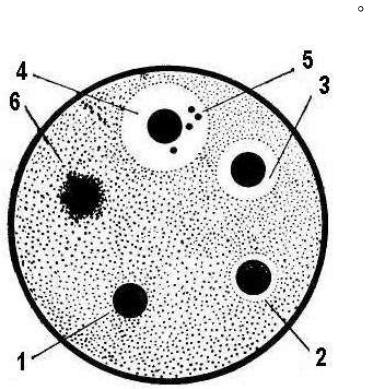
Чашку Петрі з застиглим МПА перевернути нагору дном і позначити на ньому номери дисків з антибіотиками (за кількістю виданих зразків). У лабораторний зошит занести назви антибіотиків і відповідні їм номери. Потім покласти чашку на стіл кришкою нагору. Дотримуючись правил стерильності, нанести піпеткою на поверхню пластинки агару краплю суспензії бактерій (мікрококи, сарцини чи інші види сапрофітів) ретельно розтерти її по всій поверхні середовища за допомогою стерильного шпателя. Обпаленим пінцетом нанести на поверхню агару диски, просочені антибіотиком (пеніциліном, стрептоміцином, левоміцетином, біоміцином тощо).
Диски розташувати по колу чашки так, як показано на рис. 49. Чашки помістити у термостат при температурі 37°С.
5. Визначення впливу фітонцидів цибулі та часнику на плісняві гриби (або бактерії).
У стерильній фарфоровій ступці розтовкти стерильним товкачиком невелику ріпчасту цибулину або зубчик часнику після зняття з них сухих лушпайок.
69
На поверхню застиглого сусло-агара (СА) чашки Петрі зробити суцільний посів спор досліджуваного гриба. Для цього відібрати стерильною піпеткою 0,2 см3 суспензії спор гриба, нанести її на поверхню агару, розподілити ретельно й рівномірно по всій поверхні СА стерильним шпателем Дригальського. Після цього у чашку в центр засіяної пластинки СА помістити невелику кількість (біля 1 г) подрібнених у ступці цибулі або часнику.
При проведенні визначення впливу фітонцидів цибулі або часнику на бактерії дослід проводиться так само, але береться інше поживне середовище – МПА.
Чашки помістити в термостат з температурою 25 С.
Рис. 49. Визначення антимікробної дії антибіотиків методом паперових дисків:
1 – культура стійка до дії антибіотика на даному диску; 2, 3, 4 – культура чутлива до антибіотика; 5 – колонії стійких особин даного штаму; 6 – колонії антибіотикозалежних клітин
Послідовність проведення дослідів записати у робочих зошитах.
Опрацювання результатів
1. Провести оцінку інтенсивності росту бактерій у поживному середовищі з різним змістом NaCl і без нього ( на наступному занятті). Інтенсивність розвитку бактерій у МПБ із NaCl і без нього оцінити після ретельного перемішування вмісту пробірок за ступенем мутності середовища, користуючись умовними позначеннями:
– (відсутність росту); + (слабкий ріст); ++ (помірний ріст); +++ (рясний ріст). Результати дослідження записати у вигляді таблиці (табл.5.):
|
|
|
|
|
|
Таблиця 5. |
|
Назва бактерій |
Концентрація NaCl, % |
|
|
|
|||
|
0 |
|
5 |
|
10 |
20 |
|
|
|
|
|
|
|
|
|
|
Оцінка росту |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
70
