
2013
.pdf
chryzogenum), ферментного препарату глюкозооксидази (Р. vitale ), у виробництві сирів (Р. rogueforti, Р.camemberti, P. candidum). Деякі з них зустрічаються на зерні, солоді, харчових продуктах.
РИС. 35. Aspergillus flavus |
РИС. 36. Penicillium. chryzogenum |
Клас Basidiomycetes об’єднує гриби з розгалуженим септованим міцелієм – шапкові, домові, трутовики, сажкові, іржасті та ін. Гриби розмножуються безстатевим і статевим способами, утворюючи одноабо багатоклітинні базидії з чотирма базидіоспорами.
На злакових культурах зустрічаються іржасті гриби – паразити багатьох вищих рослин. Вони відрізняються складним циклом розвитку. Деякі гриби весь цикл розвитку проходять на одній рослині (наприклад, іржа соняшника, гречки), інші – на двох (хлібна іржа). Свою назву гриби одержали у зв’язку з появою іржавих плям або смуг на уражених частинах рослин. Ураження злакових культур іржею призводить до їх недорозвинення, затримки утворення колосків і загибелі врожаю.
Клас недосконалих грибів (Fungi imperfectiі або Deuteromycetes) об’єднує гриби різних видів із септованим міцелієм, що розмножуються лише вегетативним і безстатевим способами. Деякі з недосконалих грибів втратили будь-які органи плодоношення і розмножуються брунькуванням або шматочками міцелію. Найважливішими представниками цього класу є такі роди:
Fusarium (рис.37) – для різних його видів характерні серпоподібно вигнуті конідії, розділені поперечними перегородками.
Вони розміщуються поодиноко або утворюють скупчення у вигляді рожевих подушечок на коротких розгалужених конідієносіях. Описано понад 800 видів цього гриба. Одні з них – сапрофіти, поширені у грунті, на рослинних рештках, деякі ведуть паразитичний спосіб життя, уражаючи пшеницю, жито, кукурудзу, просо, гречку, спричиняють в'янення льону і бавовнику. В овочесховищах гриби Fusarium спричиняють суху гниль картоплі і цукрових буряків (F. solani). У результаті життєдіяльності фузаріїв у зерні та насінні олійних рослин утворюються отруйні речовини, що спричиняють харчові отруєння – "п’яну хворобу" хліба (F. graminearum), септичну ангіну. Деякі види використовуються для одержання гіберилінової кислоти, яка активізує ріст солоду в спиртовій і пивоварній промисловостях.
51
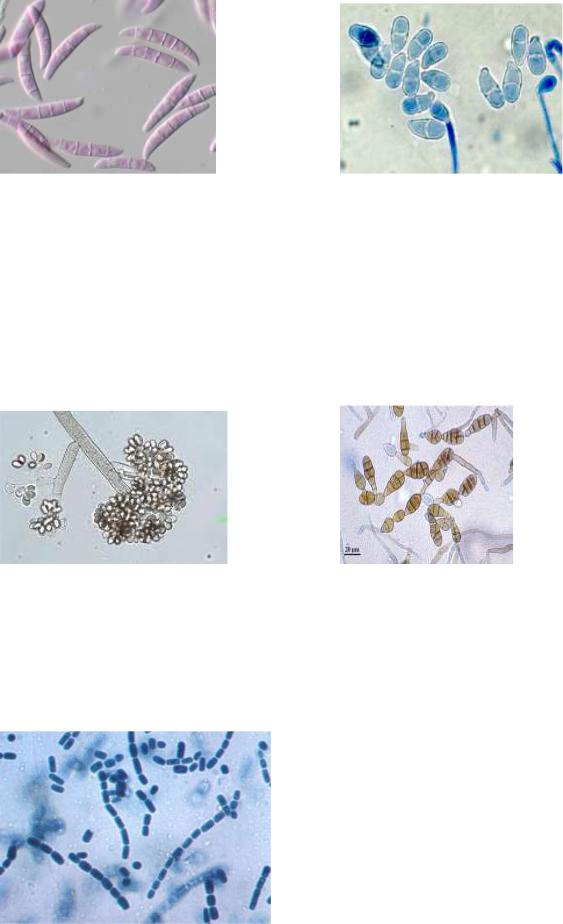
РИС. 37. Fusarium culmorum |
Рис. 38. Trichotecium rozeum |
Trichotecium на поживному середовищі утворює борошнисто-пухнастий, спочатку білий, потім рожевий міцелій; конідєносії добре розвинуті, прямостоячі, прості, без здуття біля вершини.
Trichotecium rozeum (рис.38) застосовується для одержання цитолітичних ферментів і антибіотика трихотецину.
Botrytis (рис.39) – міцелій брудно-сірого кольору пронизує субстрат у вигляді густої повсті. Конідії великі, одноклітинні, безбарвні або димчасті, яйцеподібні або круглі. Спричиняє кагатну гниль цукрових буряків під час зберігання. Збудник сірої гнилі капусти, моркви, помідорів, малини, полуниці, суниці (B. сinerеa).
Рис. 39. Botrytis сinerеa |
Рис. 40. Alternaria alternara |
Alternaria (рис.40) – міцелій забарвлений у темний колір, тому колонії на поживному середовищі темно-димчасті або маслиново-чорні. Конідієносії прямі, розгалужені або прості. Конідії багатоклітинні з поперечними та поздовжніми перегородками. У ланцюжках по 10 і більше конідій. Досить поширені у ґрунті і на рослинних тканинах. Цей гриб – збудник чорної гнилі у коренеплодів і плодів (A.radicina, A. citri), іноді спричиняє псування м’ясних і молочних продуктів.
Рис. 41. Endomyces lactis
Endomyces (рис. 41.) не мають особливих органів плодоношення. Їхні
52
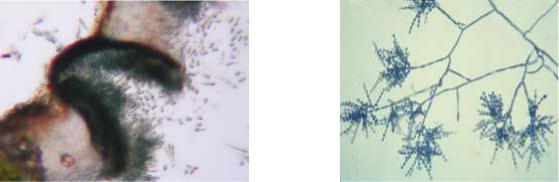
розгалужені білуваті гіфи поділяються перегородками на клітини, які потім роз’єднуються. Такі окремі клітини називаються оідіями, з кожної може розвинутися новий міцелій.
Endomyces lactis (молочна цвіль) поширена на кисломолочних продуктах, маслі, квашених овочах, пресованих дріжджах, солоді, містяться на стінках сирих приміщень.
Рhoma (рис. 42) розмножується пікнідами, в яких містяться дуже короткі конідієносії з безбарвними одноклітинними конідіями, поширені у сирих приміщеннях. Серед грибів багато збудників псування харчових продуктів, паперу, матеріалів.
Рис. 42. Phoma exigna |
Рис. 43. Cladosporium |
Cladosporium (рис.43) має розгалужені конідієносії, які несуть на кінцях ланцюжки конідій різноманітної форми і розмірів, найчастіше двоклітинні. Міцелій, конідієносії і конідії забарвлені в маслиново-зелений колір. Гриби виділяють у середовище темний пігмент. Вони часто розвиваються на різних харчових продуктах під час зберігання на холоді, а також виникають на поверхні кагатів.
3. Приготування препаратів грибів
Для приготування препарату грибів прожареною і охолодженою голкою взяти частину міцелію і перенести у краплю суміші води і гліцерину на предметне скло. Гриб ретельно розщепити препарувальними голками, потім накрити покривним склом і розглядати при малому (об’єктив 8х·) і великому (об’єктив 40х) збільшенні мікроскопа. Щоб будову міцелію можна було розглянути досить чітко, під покривне скло препарату можна додати невелику краплю фуксину. Особливо обережно слід готувати препарат мукорових грибів, оскільки при найменшому необережному русі спорангії лопаються і спори висипаються. Тому голками треба захопити лише верхній шар міцелію, не торкаючись поживного середовища.
Для розглядання стеригм і булавоподібного здуття аспергілів і китиць пеніцилів їх потрібно захопити разом з невеликим шматочком поживного середовища, розпрямити у краплі води і гліцерину на предметному склі, накрити покривним склом. При цьому відокремлюються конідії і можна розглянути будову цих грибів.
53
Завдання на виконання
1.Ознайомитись з зовнішнім виглядом, кольором, щільністю, характером росту різних видів міцеліальних грибів на чашках Петрі.
2.Приготувати прижиттєві препарати нижчих грибів родів Mucor racemosus і Rhizopus nigricans. Ознайомитись з будовою несептованого міцелію і органами розмноження (спорангіїв і спор) (х40).
3.Приготувати прижиттєві препарати вищих грибів родів Aspergillus flavus і Penicillium chrysogenum. Ознайомитись з будовою септованого міцелію і органами розмноження (конідієносіїв і конідій) (х40).
4.Приготувати прижиттєві препарати недосконалих грибів Fusarium culmorum, Trichothecium roseum, Endomyces lactis, Alternaria sp, Botrytis cinerea Розглянути будову септованого міцелію і конідій (х40)
Опрацювання результатів
1.Виконати у робочому зошиті рисунки морфологічних особливостей вивчених видів міцеліальних грибів. Рисунки повинні відображати: особливості будови міцелію та органів розмноження.
2.Скласти таблицю морфологічних та культуральних ознак розглянутих міцеліальних грибів (табл.4.) .
|
|
|
|
|
|
|
|
Таблиця 4. |
|
Клас |
Роди- |
Рід |
Вид |
Щільність |
Тип |
Способи |
Утворе- |
|
При- |
|
на |
|
|
та колір |
міцелію |
розмноження |
ння спор |
|
мітки |
|
|
|
|
міцелію |
|
|
(конідій) |
|
|
|
|
|
|
|
|
|
|
|
|
Контрольні запитання
1.Морфологічні відмінності грибів від інших груп мікроорганізмів.
2.Будова плодового тіла гриба. Особливості будови міцелію.
3. Способи вегетативного розмноження грибів.
4.Способи статтевого розмноження грибів.
5.Класифікація грибів.
6.Характеристика нижчих грибів.
7.Будова і значення мукорових грибів.
8.Будова вищих грибів – аскоміцетів, їх практичне значення.
9.Які гриби належать до базидіоміцетів?
10.Які гриби належать до недосконалих? Їх практичне значення.
11.Роль грибів у зберіганні сировини та харчових продуктів.
12.Як приготувати грибні препарати для мікроскопування?
ЛАБОРАТОРНА РОБОТА 5
Методи роботи з мікроорганізмами. Вплив фізико-хімічних та біологічних факторів зовнішнього середовища на життєдіяльність клітин живих організмів.
54
Мета роботи: полягає у засвоєнні базових методів роботи з мікроорганізмами та теоретичних відомостей щодо впливу фізико-хімічних та біологічних факторів зовнішнього середовища на життєдіяльність клітин живих організмів.
Матеріали та обладнання: мікроскопи, спиртівки, сірники, предметні та покривні скельця; крапельниці з дистильованою водою; змиті з пробірок тест-
культури мікроорганізмів: Sarcina flava, Escherichia coli, Bacillus subtilis, Bacillus mesentericus, Candida valida, Rhodotorula glutinis, Rhizopus nigricans, Aspergillus niger, Penicillium chryzogenum, Fusarium culmorum (по 1 пробірці); зубок часнику;
невелика цибулина; терка, порцелянова чашка; суспензія дріжджів Saccharomyces cerevisiae; сусло з концентраціями глюкози 0, 10, 20 та 30%, а також МПБ з концентраціями NaCl 0, 5, 10 та 20% (по 3 пробірки кожного) і додатково 3 пробірки сусла з 10% глюкози; на підгрупу з 4 студентів: чашка Петрі з МПА, чашка Петрі з ГКА або сусло-агар, 2 стерильні піпетки; шпатель Дригальського, набір антибіотиків, нанесених на паперові диски; камера Горяєва; шматочок мила та фільтрувальний папір (для кожного студента).
Загальні відомості
1.Методи роботи з мікроорганізмами
1.1 Порядок проведення посіву та пересіву мікроорганізмів
Для виділення мікроорганізмів з виробничих і природних субстратів, підтримки в активному стані чистих культур, приготування культур з метою передачі у виробництво і т.п. у лабораторній практиці користуються методами посіву та пересіву. Посівом, або інокуляцією, називається внесення мікробного матеріалу в стерильне поживне середовище. Пересів – це перенесення вирощеної на поживному середовищі культури мікроорганізмів на інше стерильне поживне середовище. Під час посіву (пересіву) мікроорганізмів потрібно дотримуватися таких правил (рис 44):
1.Запалити спиртівку або газовий пальник.
2.У ліву руку взяти дві пробірки: одну – зі стерильним середовищем, іншу (ближчу до себе) – з культурою, які тримають у нахиленому положенні. Великим і вказівним пальцями правої руки тримати бактеріологічну петлю, простерилізовану
уполум’ї пальника.
3.З обох пробірок вийняти ватні пробки, притиснути їх мізинцем і безіменним пальцем правої руки до долоні та обпалити краї пробірок, стежачи за тим, щоб пробки не торкалися сторонніх предметів.
4.Петлю ввести у пробірку з культурою, яку пересівають. Обережно, не торкаючись стінок, відібрати краплю рідкої культури. У разі проведення пересівання із скошеного шару агару для охолодження петлі спочатку доторкнутися нею до поверхні агару, де немає культури, після чого взяти невелику кількість мікробної біомаси.
5.Не торкаючись стінок пробірки, петлю з мікроорганізмами ввести у пробірку й сполоснути у стерильному рідкому середовищі. У разі внесення клітин, взятих петлею з щільного середовища, матеріал ретельно розтерти по стінці
55
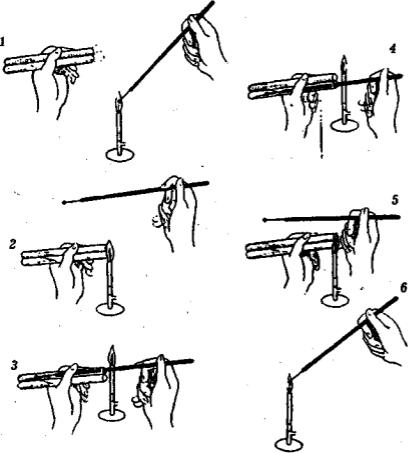
пробірки і верхньому краю рідкого середовища, весь час змиваючи його середовищем.
Якщо проводять пересівання на щільне поживне середовище (скошений шар агаризованого середовища), петлю з клітинами мікроорганізмів опускають до дна пробірки, де скупчується невелика кількість конденсаційної води. Злегка торкаючись петлею поверхні косяка, але не руйнуючи його, проводять зигзагоподібний штрих.
6.Петлю вийняти, обпалити краї пробірок і внутрішні кінці пробок, після чого пробірки закрити.
7.Петлю знову прожарити у полум’ї пальника.
8.На пробірці зазначити назву культури і дату посіву (підпис зробити чорнилом або олівцем по склу). Засіяні пробірки вмістити у термостат для вирощування при оптимальній для цього виду культури температурі.
Описані прийоми слід виконувати біля полум’я пальника для запобігання забруднення культур сторонніми мікроорганізмами. Не можна робити різких рухів, ходити тощо біля того, хто працює з чистою культурою, оскільки рух повітря посилює небезпеку випадкового зараження культури та середовища. Пересівати мікроорганізми краще в стерильному боксі.
Рис. 44. Пересів культури мікроорганізму: 1 – обжарювання петлі; 2 – обжарювання країв пробірок; 3 – набір культури; 4 – посів культури; 5 – обжарювання країв пробірок; 6 – обжарювання петлі
Посів у рідке середовище можна робити петлею або піпеткою (пастерівською
56

або градуйованою). Обидві пробірки тримають у злегка похиленому положенні, щоб не замочити ватяні пробки. Петлю з мікробним матеріалом опускають безпосередньо в стерильне середовище й обполіскують.
При внесенні клітин, узятих петлею зі щільного середовища, матеріал ретельно розтирають по стінці пробірки у верхнього краю рідкого середовища, увесь час змиваючи його середовищем.
Посів на щільні середовища. Посіви петлею на скошеному агарі виконують зиґзаґоподібним штрихом, вільно ковзаючи петлею по поверхні щільного середовища від одного краю пробірки (чашки Петрі) до іншого; або прямою рискою, для цього петлею проводять пряму лінію знизу догори посередині поверхні поживного середовища або суцільним посівом, розтираючи матеріал обережними круговими рухами по всій поверхні середовища.
Посів у чашки Петрі виконують у такий спосіб: щільне поживне середовище у пробірках або колбах розплавляють на киплячій водяній бані, охолоджують до 48 – 50 °С і, дотримуючись правил стерильності, розливають рівним шаром товщиною 10 – 15 мм у стерильні чашки. Застигле середовище можна злегка підсушити в термостаті. Посів виконують скляним шпателем Дригальского або петлею у вигляді паралельних або зиґзаґоподібних штрихів (метод виснажливого штриха).
У стовпчик агаризованого середовища посів виконують уколом (рис. 45).
Засіяні і підписані пробірки, колби або чашки Петрі ставлять у термостат для вирощування.
Рис. 45. Посів уколом
1.2. Методи одержання накопичувальних культур
Накопичувальними (елективними) називають культури, в яких переважають представники близьких видів або навіть одного виду мікроорганізмів. Для одержання таких культур створюють умови, що забезпечують переважний розвиток виду, який виділяють. Для цього використовують селективні середовища, а також варіюють такими факторами, як рН, температура, окисно-відновний потенціал, вводять певні антибіотики та ін. Так, збільшуючи кислотність середовища, усувають можливість розвитку бактерій і створюють сприятливі умови для розмноження дріжджів і міцеліальних грибів. Одержання накопичувальних культур термофільних організмів здійснюють при температурі 45
57
– 65 °С, рідше при 70 – 75 °С. Внесення в середовище певних концентрацій пеніциліну сприяє розвиткові грамнегативних бактерій або дріжджів. Неоміцин або пеніцилін спільно зі стрептоміцином придушують бактеріальну мікрофлору і створюють умови для переважного розвитку дріжджів. Ністатин, навпаки, перешкоджає життєдіяльності дріжджів, не впливаючи на бактерії. Для одержання накопичувальних культур аеробних мікроорганізмів поживне середовище наливають тонким шаром (1,5 – 2 см) у колби і культивують на качалках. Для збагачення анааеробними мікроорганізмами середовища розливають доверху у високі пробірки або флакончики з притертими пробками. У результаті повторних пересівів на те саме елективне середовище і створення сприятливих умов для видів культура поступово збагачується мікроорганізмами з бажаними властивостями і збіднюється супутніми формами.
1.3. Методи виділення чистих культур
Вивчати морфологічні, культуральні, фізіологічні особливості мікроорганізмів, застосовувати мікроорганізми на виробництві можна за наявності чистих культур. Чиста культура – це популяція генетично споріднених клітин, одержаних із однієї батьківської клітини.
Найчастіше чисту культуру виділяють з елективних культур.
Після одержання елективної культури розпочинають виділення чистої культури. Існує декілька методів виділення чистих культур. Вони всі ґрунтуються на ізолюванні від мікробної популяції однієї клітини (однієї колонії).
Виділення чистої культури з однієї колонії. Цей метод запровадив у мікробіологічну практику німецький учений Роберт Кох. Для виділення необхідно мати три-чотири стерильні чашки Петрі, пробірки або колбочки з щільними поживними середовищами, петлю або стерильну піпетку, шпатель Дригальського, елективну культуру, пальник. Перед початком роботи стіл протерти ватним тампоном, змоченим у спирті, ретельно вимити і продезінфікувати 70 % розчином спирту руки.
Щільні поживні середовища розплавити у киплячій водяній бані, охолоджують до температури 45 – 50 °С і розлити у чашки Петрі. Для цього колбу або пробірку з середовищем взяти правою рукою, тримаючи в похилому положенні, вийняти ватну пробку. Горловину посудини обпалити у полум’ї пальника і, відкривши великим і вказівним пальцями лівої руки кришку чашки Петрі, швидко вилити розплавлене середовище (15...20 см3) так, щоб дно чашки було повністю ним покрите. Кришку відразу закрити, чашки залишити в горизонтальному положенні на столі до повного застигання середовища.
За поверхневого способу виділення аеробних мікроорганізмів краплю культури або її розбавлення нанести петлею чи піпеткою в центр застиглого середовища, трохи відкриваючи кришку чашки Петрі. Обережно розтерти її стерильним шпателем Дригальського по всій поверхні середовища в чашці, після чого цим самим шпателем із залишками матеріалу протерти поверхню середовища послідовно в другій, третій, рідше – у четвертій чашці Петрі. При цьому кришка кожної чашки має бути відкритою настільки, щоб у щілину міг пройти лише шпатель. Після закінчення роботи скляний шпатель вмістити у дезінфікувальний
58

розчин.
Розсівати елективну культуру на поверхню поживного середовища можна і петлею (рис. 46).
Рис. 46. Розсів культури мікроорганізмів на поверхню поживного середовища: А – шпатель Дригальського; Б – розсів; В – ріст мікроорганізмів після розсіву шпателем; Г – ріст мікрорганізмів після розсіву петлею (в трьох чашках); Д – ріст мікроорганізмів після розсіву петлею (в одній чашці)
Отже, таким способом можна виділяти чисті культури виробничих дріжджів, бражки, молока, води, пива, вина, квасу, тіста, ґрунту, змивів сировини тощо, заздалегідь підготувавши розбавлення у стерильній воді або у фізіологічному розчині (0,85 %-й розчин натрію хлориду).
Після розсіву чашки Петрі підписати, перевернути догори дном, щоб утворена під кришкою конденсаційна вода не капала вниз і не розмивала ізольовані колонії. Чашки Петрі витримувати 2 – 7 діб у термостаті, оскільки швидкість росту у різних мікроорганізмів неоднакова, і щодня їх переглядати. Кожна клітина залишається на тому самому місці середовища, куди вона потрапила в момент розсіву. Тут клітини матимуть сприятливі умови для свого розвитку, починають розмножуватися й утворюють колонії, тобто виникає дуже велика кількість клітин одного виду. Колонії, що виросли, оглядають спочатку неозброєним оком, а потім за допомогою лупи і під мікроскопом.
При огляді колоній звертати увагу на форми і розміри колоній, їхнє забарвлення і забарвлення субстрату, характер поверхні колоній та їхніх країв, вид колоній та ін. Ізольовану колонію, що відрізняється від інших зовнішніми ознаками та міститься на відстані не менш як 1 см від інших колоній, відсіяти стерильною петлею в окрему пробірку з рідким середовищем або на поверхню скошеного твердого середовища.
Мікроорганізми, які належать до факультативних анаеробів, найчастіше виділяють глибинним посівом. Для цього розплавлені агаризовані поживні середовища слід розливати по 15 – 20 см3 у пробірки і простерилізувати.
59
Безпосередньо перед виділенням чистої культури середовища в пробірках розтопити у водяній бані. Після охолодження до температури 48 – 50 °С стерильною петлею внести краплю елективної культури у першу пробірку, закрити її ватною пробкою, вміст перемішати, після чого дві-три краплі суміші перенести у другу пробірку. Потім п’ять-шість крапель з другої пробірки перенести у третю. Таким чином одержують ряд розбавлень посівного матеріалу, який після переміщування між долонями обох рук стерильно виливають у чашки Петрі. Середовище з мікроорганізмами розподілити рівним шаром по дну кожної чашки і поставити на горизонтальну поверхню для застигання. При цьому працювати з агаризованими середовищами слід швидко, оскільки при температурі 40 °С вони застигають.
Для виділення анаеробних мікроорганізмів за методом Коха необхідно обмежити доступ кисню до культури. З цією метою поверхню глибинного посіву в чашці Петрі заливають стерильною сумішшю парафіну і вазеліну (1:1). Можна використовувати спеціальні стерильні трубки довжиною 20 – 30 см і діаметром 0,4
– 0,7 см, зроблені за типом піпеток Пастера. Після заповнення трубки сумішшю розбавлення накопичувальної культури і розплавленого й охолодженого поживного середовища трубку запаюють із двох сторін (з боку капіляра й у місці перетяжки). Можна залишати посівний матеріал, ретельно перемішаний з агаризованим, добре освітленим поживним середовищем, безпосередньо в звичайній пробірці. Ватяну пробку заміняють гумовою або заливають поверхню агару сумішшю парафіну і вазелінової олії. Щоб дістати вирослі колонії анаеробних мікроорганізмів, пробірки або трубки злегка нагрівають, швидко обертаючи над полум'ям пальника. Агар, що прилягає до стінок, розплавляється, і стовпчик вислизає в підготовлену стерильну чашку Петрі. Стовпчик агару розрізають стерильним ланцетом, колонії витягають стерильною петлею або стерильною капілярною трубкою і переносять у рідке середовище.
2.Вплив фізико-хімічних факторів зовнішнього середовища на життєдіяльність клітин живих організмів.
2.1. Вплив концентрації речовин, розчинених у середовищі
Концентрація розчинених у середовищі речовин має велике значення для росту мікроорганізмів. Від концентрації цих речовин у середовищі і, отже, від величини його осмотичного тиску залежить процес надходження поживних речовин у клітини мікроорганізмів шляхом осмосу. Вода і поживні речовини надходять у клітину, якщо осмотичний тиск у ній більший, ніж у середовищі. Підвищення концентрації речовин у середовищі приводить до уповільнення процесу надходження води в клітину в зв'язку зі зменшенням різниці між концентрацією речовин у клітині й середовищі. Він може припинитися зовсім, якщо концентрація речовин у середовищі виявиться більшою, ніж у клітині, і тоді клітини обезводнюються. Таке явище називається плазмоліз. У різних мікроорганізмів плазмоліз проявляється по-різному. До нього особливо стійкі стафілококи, сарцини, сінна паличка. Легко піддаються плазмолізу бактерії із групи пастерел, ентеробактерії, бацила сибірки.
60
