
- •Амперометричне (вольтамперометричне) титрування
- •Загальні відомості
- •Органічні сполуки, які визначають амперометричним титруванням
- •Продовження таблиці 1.1
- •Типи кривих амперометричного титрування
- •3. Характеристика реагентів, що використовують в якості титрантів в амперометрії
- •Хіміко-аналітичні й електрохімічні властивості неорганічних титрантів і Na2c2o4
- •Органічні сірковмісні реагенти, які застосовують в амперометричному титруванні
- •Продовження таблиці 3.3
- •4. Індикатори в амперометричному титруванні
- •5. Послідовні (диференційовані) титрування
- •6. Амперометричне титрування з двома індикаторними електродами
- •7. Приклади визначення речовин амперометричним титруванням
- •7.1. Визначення кадмію (II) або цинку (II) з їх сульфатів фероціанідом калію Принцип методу
- •Методика виконання роботи
- •7.2. Визначення свинцю в технічному Pb(no3)2 Принцип методу
- •Методика виконання роботи
- •7.3. Визначення міді (II) на двох індикаторних електродах з використанням йодометричних реакцій
- •Методика виконання роботи
- •7.4. Визначення залізу ванадатом амонію Принцип методу
- •Методика виконання роботи
- •7.5. Диетілдитіокарбамінат натрію в аналізі мідьвмісних продуктів Принцип методу
- •Методика виконання роботи
- •7.6. Амперометричне визначення свинцю розчином ддтк Принцип методу
- •Методика виконання роботи
- •7.7. Визначення міді (II) і кадмію, що спільно присутні у розчині Принцип методу
- •Методика виконання роботи
- •7.8. Визначення цинку або кадмію з їх сульфатів 8-меркаптохіноліном Принцип методу
- •Методика виконання роботи
- •7.9. Визначення заліза (III) 8-меркаптохіноліном на двох індикаторних електродах Принцип методу
- •Методика виконання роботи
- •7.10. Послідовне титрування заліза і міді розчином 8-меркаптохіноліну Принцип методу
- •Методика виконання роботи
- •Список літератури
Методика виконання роботи
Наважку зразка 0,5 г поміщають у мірну колбу на 200 мл, розчиняють у HNO3 (1:1) і після розчинення доводять до мітки дистильованою водою. Знімають вольтамперні криві. Техніку виконання див. у роботі 7.1. Будують графіки залежності I=f(E) і визначають значення потенціалу по площадці граничного струму. Накладають на електроди цей потенціал.
5
мл аналізованого розчину, що містить
Pb2+,
переносять у електролізер. Додають 20
мл фонового електроліту, занурюють
електроди, включають електромотор або
магнітну мішалку, титрують, реєструючи
показання мікроамперметра після кожного
додавання К2Cr2O7
(по 0,1 мл). Титрування проводять 2–3 рази.
Дані заносять у табл. (див. табл. 7.4). За
результатами титрування будують криву
в координатах
![]() .
Знаходять об’єм титранту, що відповідає
точці еквівалентності, і користуючись
формулою титриметричного аналізу
.
Знаходять об’єм титранту, що відповідає
точці еквівалентності, і користуючись
формулою титриметричного аналізу
 ,
,
розраховують масову частку свинцю.
7.3. Визначення міді (II) на двох індикаторних електродах з використанням йодометричних реакцій
Титрування проводять з використанням двох індикаторних електродів. Визначення іонів міді (II) засноване на хімічній реакції:
![]()
I2,
який виділяється, відновлюється на Pt
електроді (система
![]() електрохімічно зворотна) і може бути
відтитрований стандартним розчином
тіосульфату (система
електрохімічно зворотна) і може бути
відтитрований стандартним розчином
тіосульфату (система![]() – незворотна).
– незворотна).
Необхідні прилади, реактиви і посуд
1. Амперометрична установка з двома індикаторними електродами.
2. Платинові електроди, 2 шт.
3. Мірна колба місткістю 100 мл.
4. Піпетка на 20 мл.
5. Мікробюретка місткістю 5 мл.
6. Стаканчик для титрування, 50 мл.
7. Сірчана кислота, 1М розчин.
8. Йодид калію, сухий.
9. Розчин тіосульфату, 0,05 н.
10. Аналізований розчин CuSO410–3М.
Методика виконання роботи
Заданий об’єм аналізованого розчину CuSO4 відбирають у мірну колбу місткістю 100 мл і розбавляють до мітки розчином H2SO4, перемішують. Піпеткою переносять у електролізер для титрування 20 мл цього розчину. Додають приблизно 1 г KI (1 лопатку). Розчину дають постояти 3–5 хв, тому що швидкість реакції уповільнена.
![]()
Занурюють
у розчин платинові електроди, задають
напругу 20 мВ і титрують йод, що виділився
тіосульфатом. Показання струму записують
після приливання кожної порції титранта
(титрант додають по 0,1 мл). Оскільки
зворотна система титрується незворотною,
значення струму спочатку буде зростати,
пройде через максимум, а потім зменшується.
В точці еквівалентності значення струму
наближається практично до нуля. Титрування
проводять 2–3 рази. За результатами
титрування будують криву в координатах
![]() .
Визначають об’єм титрування, що
відповідає точці еквівалентності.
Розраховують вміст міді за формулою
.
Визначають об’єм титрування, що
відповідає точці еквівалентності.
Розраховують вміст міді за формулою
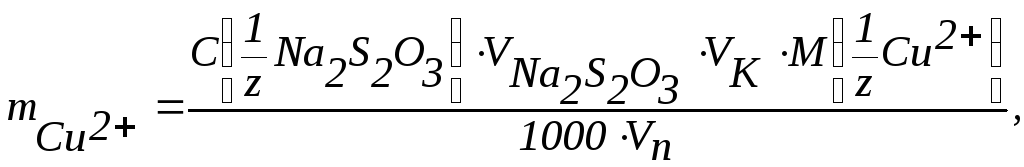
де

Тому,
визначаючи масу міді, ми маємо право
помножити
![]() на
на![]() ,
хоча тіосульфат з міддю безпосередньо
не взаємодіє.
,
хоча тіосульфат з міддю безпосередньо
не взаємодіє.
7.4. Визначення залізу ванадатом амонію Принцип методу
При титруванні заліза (II) ванадатом амонію NH4VO3 у розчині проходить окиснювально-відновний процес:
![]()
який в іонному вигляді можна записати:
![]() (хімічна реакція).
(хімічна реакція).
В електродній реакції бере участь визначувана речовина, що здатна окиснюватися на Pt мікроаноді при накладенні зовнішньої ЕРС=1 В (нас. к.е.):
![]() (електродний
процес).
(електродний
процес).
При зануренні електродів у досліджуваний розчин за рахунок окиснювання заліза (II) у ланцюзі фіксується високий дифузійний струм, величина якого пропорційна концентрації Fe2+ (рис. 7.20). При титруванні кількість заліза (II) зменшується. Знижується і величина дифузійного струму (ділянка АВ, рис. 21). За точкою еквівалентності (ТЕ) значення струму (Iост.) мінімально і постійно (ділянка ВС).

Рис. 7.20. Вольтамперні криві Fe2+ різної концентрації

Рис. 7.21. Крива амперометричного титрування заліза (II) – NH4VO3
Необхідні прилади, реактиви і посуд
1. Амперометрична установка будь-якого типу.
2. Платиновий обертовий електрод
3. Насичений каломельний електрод.
4. Мірний циліндр місткістю 50 мл.
5. Мікробюретка 2–5 мл.
6. Стаканчик для титрування місткість 50 мл.
7. Розчин H2SO4.
8. Розчин NH4VO3, 0,01М.
9. Аналізований розчин солі Мору або сульфату заліза (II).
