
- •Амперометричне (вольтамперометричне) титрування
- •Загальні відомості
- •Органічні сполуки, які визначають амперометричним титруванням
- •Продовження таблиці 1.1
- •Типи кривих амперометричного титрування
- •3. Характеристика реагентів, що використовують в якості титрантів в амперометрії
- •Хіміко-аналітичні й електрохімічні властивості неорганічних титрантів і Na2c2o4
- •Органічні сірковмісні реагенти, які застосовують в амперометричному титруванні
- •Продовження таблиці 3.3
- •4. Індикатори в амперометричному титруванні
- •5. Послідовні (диференційовані) титрування
- •6. Амперометричне титрування з двома індикаторними електродами
- •7. Приклади визначення речовин амперометричним титруванням
- •7.1. Визначення кадмію (II) або цинку (II) з їх сульфатів фероціанідом калію Принцип методу
- •Методика виконання роботи
- •7.2. Визначення свинцю в технічному Pb(no3)2 Принцип методу
- •Методика виконання роботи
- •7.3. Визначення міді (II) на двох індикаторних електродах з використанням йодометричних реакцій
- •Методика виконання роботи
- •7.4. Визначення залізу ванадатом амонію Принцип методу
- •Методика виконання роботи
- •7.5. Диетілдитіокарбамінат натрію в аналізі мідьвмісних продуктів Принцип методу
- •Методика виконання роботи
- •7.6. Амперометричне визначення свинцю розчином ддтк Принцип методу
- •Методика виконання роботи
- •7.7. Визначення міді (II) і кадмію, що спільно присутні у розчині Принцип методу
- •Методика виконання роботи
- •7.8. Визначення цинку або кадмію з їх сульфатів 8-меркаптохіноліном Принцип методу
- •Методика виконання роботи
- •7.9. Визначення заліза (III) 8-меркаптохіноліном на двох індикаторних електродах Принцип методу
- •Методика виконання роботи
- •7.10. Послідовне титрування заліза і міді розчином 8-меркаптохіноліну Принцип методу
- •Методика виконання роботи
- •Список літератури
Методика виконання роботи
До отриманої задачі з невідомим вмістом заліза (II) додають 30 мл 0,5М H2SO4. На електроди накладають ЕРС, яка дорівнює 1,0 В і опускають їх у розчин. Включають перемішування і титрують залізо розчином ванадату амонію точно відомої концентрації. Титрант додають по 0,1 мл, записуючи через кожні 15 с показання гальванометра.
|
Додано, мл...… |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
|
Показання гальванометра |
100 |
100 |
80 |
… |
… |
… |
… |
… |
Титрування проводять до постійного значення струму. Точку еквівалентності визначають графічно.
Визначивши об’єм NH4VO3 за графіком, розраховують масу заліза в грамах.

7.5. Диетілдитіокарбамінат натрію в аналізі мідьвмісних продуктів Принцип методу
О рганічний
сірковмісний реагент диетілдитіокарбамінат
натрію (ДДТК) реагує з металами групи
сірководню і сірчистого амонію з
утворенням міцних внутрішньокомплексних
сполук. Для двовалентних металів хімічну
реакцію, яка перебігає в розчині, можна
записати таким чином:
рганічний
сірковмісний реагент диетілдитіокарбамінат
натрію (ДДТК) реагує з металами групи
сірководню і сірчистого амонію з
утворенням міцних внутрішньокомплексних
сполук. Для двовалентних металів хімічну
реакцію, яка перебігає в розчині, можна
записати таким чином:
Електронна щільність подвійного зв'язку =S і одинарної –S перерозподіляється при координації металу і виходять полуторні зв'язки.
В ольтамперна
крива ДДТК (рис. 22) має дві площадки
граничного струму. При невеликій напрузі
0,4–0,6 В на електроді проходить окиснювання
реагенту до дисульфіду. При більш
високому 0,8–1,0 В спостерігається більш
глибокий процес окиснювання з утворенням
кисеньвмісних продуктів.
ольтамперна
крива ДДТК (рис. 22) має дві площадки
граничного струму. При невеликій напрузі
0,4–0,6 В на електроді проходить окиснювання
реагенту до дисульфіду. При більш
високому 0,8–1,0 В спостерігається більш
глибокий процес окиснювання з утворенням
кисеньвмісних продуктів.
Титрування диетілдитіокарбамінатом натрію звичайно проводять при напрузі 0,8–0,9 В, тому що при такій напрузі підйом струму після точки еквівалентності більш різкий (рис. 7.22, кр. 2 і 3).

Рис. 7.22. Вольтамперна крива ДДТК (1) і криві амперометричного титрування Cu2+ при напрузі 0,3 В (2) і 0,9 В (3)
Розчин диетілдитіокарбамінату при збереженні окиснюється киснем повітря. Для одержання правильних результатів аналізу спочатку стандартизують розчин, а потім використовують його для титрувань.
При
стандартизації (перший етап роботи)
після титрування розчину міді, точно
відомої концентрації, розраховують
складний титр –
![]()
![]() ,
що показує скільки грамів міді реагує
з одним мл титрану. Потім проводять
другий етап роботи – відтитровують
аналізований розчин, і знаходячи за
графіком кількість мл ДДТК, що пішла на
реакції з визначуваним компонентом,
розраховують масу використовуючи
формули:
,
що показує скільки грамів міді реагує
з одним мл титрану. Потім проводять
другий етап роботи – відтитровують
аналізований розчин, і знаходячи за
графіком кількість мл ДДТК, що пішла на
реакції з визначуваним компонентом,
розраховують масу використовуючи
формули:
![]() ,
,
або у випадку аліквотитрування:
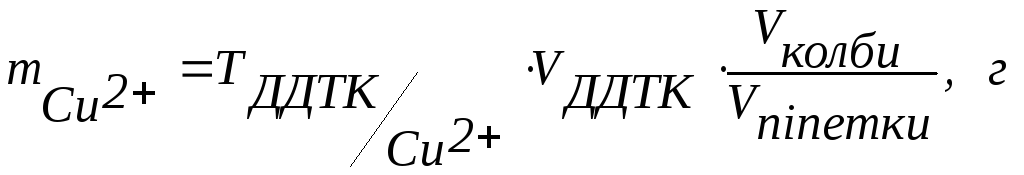
Необхідні прилади, реактиви і посуд
1. Амперометрична установка будь-якого типу з платиновим обертовим електродом і насиченим каломельним електродом порівняння.
2. Мірний циліндр місткістю 50 мл.
3. Мікробюретка 2–5 мл.
4. Стаканчик для титрування місткістю 50 мл.
5. Мірна колба, місткістю 100 мл.
6. Стандартний розчин сульфату міді, 0,002 М.
7. Розчин KCl, 0,1 М.
8. Розчин ДДТК, 0,01 М.
9. Аналізований розчин Cu невідомої концентрації.
Методика виконання роботи
Установка точної концентрації ДДТК. В стаканчик для титрування відбирають піпеткою 5 мл розчину солі міді точно відомої концентрації, додають ~30 мл фонового електроліту – KCl. На електроди накладають напругу 0,8–0,9 В та опускають їх у розчин. Включають перемішування і титрують розчином ДДТК, концентрацію якого потрібно встановити. Після кожного додавання титранту по 0,1 мл записують силу струму в ланцюзі (=10 с). Титрування проводять до різкого стійкого зростання струму в ланцюзі (рис. 7.22, кр. 3). За отриманими даними будують криву амперометричного титрування. Знаходять точку еквівалентності і розраховують титр ДДТК по міді:
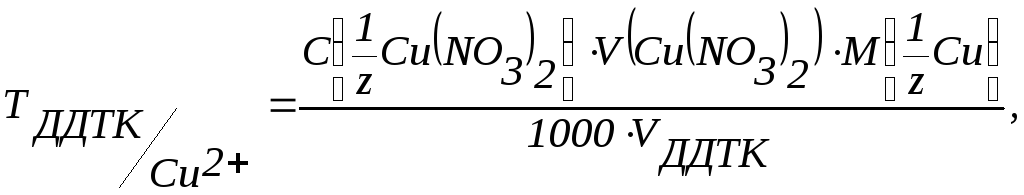
де
 – точна маса міді (г) відібрана на
титрування.
– точна маса міді (г) відібрана на
титрування.
Якщо
масу міді розділити на об’єм, який пішов
на реакцію
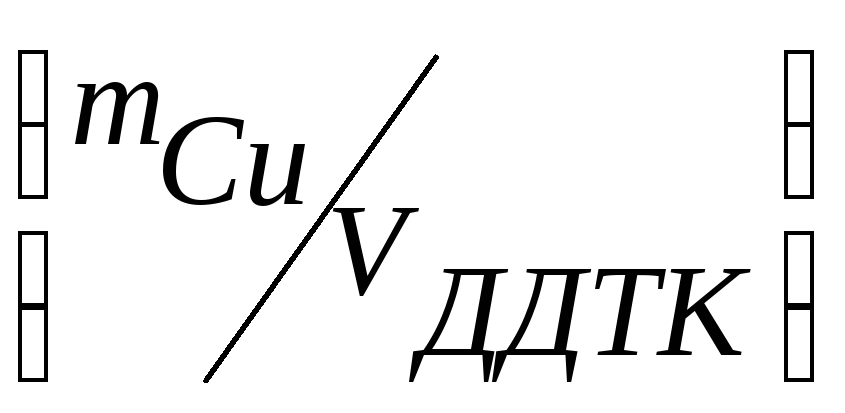 ,
то ми дізнаємося скільки грам міді
реагує з 1 мл титранта, тобто знайдемо
складний титр.
,
то ми дізнаємося скільки грам міді
реагує з 1 мл титранта, тобто знайдемо
складний титр.
Визначення міді в аналізованій задачі. Аналізований розчин розбавляють дистильованою водою в мірній колбі, місткістю 100 мл. Доводять до мітки Н2О і добре перемішують. У склянку для титрування відбирають аліквотний об’єм – 10 мл, додають 25 мл фонового електроліту, накладають на електроди напругу та опускають їх у розчин. Вмикають перемішування. Титрують розчином ДДТК, записуючи показання мікрогальванометра після кожного додавання титранта. Будують криву амперометричного титрування. Знаходять точку еквівалентності. Розраховують масу міді (II) за формулою

