
Лекция 3(химическое равновесие)
.docЛекция 3
Термодинамика химического равновесия.
Химические реакции делятся на обратимые и необратимые. Необратимые протекают до конца, о чем свидетельствует выделение осадка, газа, изменение цвета раствора. Обратимые протекают как в прямом, так и в обратном направлении и характеризуются соответствующими скоростями прямой и обратной реакций. С течением времени наступает такой момент, когда скорость прямой реакции будет равна скорости обратной реакции и наступает химическое равновесие. Vпр = Vобр.
|
Реакция |
Прямая реакция |
Обратная реакция |
|
aA + bB = cC + dD |
aA + bB → cC + dD |
cC + dD → aA + bB |
|
Hb + O2 = HbO2 |
Hb + O2 → HbO2 |
HbO2 → Hb + O2 |
|
N2 + 3H2 = 2NH3 |
N2 + 3H2 → 2NH3 |
2NH3 → N2 + 3H2 |
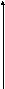
V
Vпр
химическое равновесие
Vобр
t

Рис.: зависимость скорости реакции от времени.
Условия химического равновесия:
-
Кинетическое: при достижении химического равновесия концентрации веществ в системе перестают изменяться и остаются постоянными при неизменных условиях (Т, р).
-
Термодинамическое: при достижении химического равновесия энергия Гиббса становится минимальной и перестает изменяться ∆G = 0.
G
 исх.
в-в Gпрод.
исх.
в-в Gпрод.




хим. равновесие: Gисх. в-в – Gпрод. = 0 = ∆G
Рис.: изменение энергии Гиббса.
Энергия Гиббса системы определяется не только Т – температурой и р – давлением, но и зависит от химического потенциала - . Химическим потенциалом вещества в данной системе называют величину, которая определяет количество энергии Гиббса, приходящееся на 1моль этого вещества.
(х) = G(х) / n(х)
где n – количество вещества (моль). Таким образом, энергия Гиббса зависит и от количества вещества: G(х) = (х) n(х).
В раствороах химический потенциал вещества зависит от концентрации вещества и природы растворителя:
(х) = 0х + RTlnC(х)
где R – универсальная газовая постоянная = 8,314 Дж/мольК;
Т – абсолютная температура опыта (К);
ln – натуральный логарифм;
С(х) – молярная концентрация (моль/л).
С(х) = n(х) / Vр-ра
где Vр-ра – объем раствора (л).
Количественной характеристикой химического равновесия является закон действующих масс.
aA + bB = cC + dD – уравнение реакции в общем виде,
где a,b,c,d – стехиометрические коэффициенты (соответствуют числу моль вещества); А,B,C,D – вещества.
(А) = 0А + RTlnC(А)
(B) = 0B + RTlnC(B)
(C) = 0C + RTlnC(C)
(D) = 0D + RTlnC(D)
Gисх. в-в = а(А) + b(B)
Gпрод. = с(C) + d(D)
∆G = Gпрод. – Gисх. в-в = [с(C) + d(D)] – [а(А) + b(B)]
подставляем соответствующие значения химических потенциалов и получаем:
∆G = ∆G0 + RTln(СсССdD) / (CaACbB),
где (СсССdD) / (CaACbB) – произведение концентраций – Пс.
В случае наступления равновесия ∆G = 0:
∆G0 = - RTlnПс
Произведение концентраций при равновесии – это постоянная величина и ее обозначают Кс – константа химического равновесия, она является характеристикой истинного равновесия. Константа химического равновесия – это есть выражение закона действующих масс. Физический смысл – это есть отношение произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях их стехиометрических коэффициентов – это величина постоянная. При записи выражения для константы химического равновесия используют только равновесные концентрации, которые существуют в момент равновесия (их записывают в квадратных скобках):
Кс = [C]c[D]d / [A]a[B]b
Возьмем конкретную реакцию: N2 + 3H2 = 2NH3, тогда Кс = [NH3]2 / [N2][ H2]3.
[C] = Снач. – Спрореаг.
Значение константы связано с энергией Гиббса:
∆G0298 = - RTlnКс
это уравнение изотермы химической реакции, оно используется для расчетов в момент равновесия. Из уравнения изотермы можно определить направление протекания процесса:
-
при высоких значениях Кс ∆G < 0 – прямая реакция,
-
при низких значениях Кс ∆G > 0 – обратная реакция.
Существует полное уравнение изотермы химической реакции, когда концентрации веществ в системе являются неравновесными:
∆G0298 = - RTlnКс + RTlnПс
∆G0298 = - RTln(Кс/Пс) = RTln(Пс/ Кс)
Проанализируем полное уравнение изотермы реакции. С помощью него мы можем более точно определить направленность процесса:
-
Кс > Пс, ∆G < 0 – прямая реакция.
-
Кс < Пс, ∆G > 0 – обратная реакция.
-
Кс = Пс, ∆G = 0 – химическое равновесие.
Кс, выраженная через концентрацию, может использоваться только для веществ, находящихся в растворенном состоянии. Если вещества будут даны в газообразном состоянии, то необходимо выражать константу равновесия через парциальное давление:
Кр = (РсСРdD) / (РaAРbB)
Если реакция гетерогенная, то в выражение константы подставляют только газообразные вещества. Например:
2NO(г) + O2(г) 2NO2(г), Кс = [NО2]2 / [NО]2[О2].
2С(т) + O2(г) 2СO(г), Кр = Р2(СО) / Р(O2)
В термодинамике различают истинное и ложное равновесие. Признаки истинного равновесия:
-
Равенством скоростей прямой и обратной реакций.
-
Значение энергии Гиббса минимально, ∆G = 0. Значение энтропии максимально, ∆S = 0.
-
Оно характеризуется подвижностью, способностью самопроизвольно восстанавливаться после небольших смещений внешних условий. Например, воздух сжимается при воздействии на него давления, когда же давление исчезает, то он восстанавливается до первоначального состояния.
-
Сохранение своего состояния во времени при отсутствии внешних воздействий.
-
В момент равновесия состояние системы одинаково не зависимо от того, с какой стороны система подошла к нему.
Ложное равновесие, которое имеет сходство с истинным, длительно во времени, но при этом ∆G 0 (гремучая смесь, пересыщенные растворы). Истинное равновесие подчиняется уравнению изотермы, (оно работает только при постоянной температуре, что трудно достижимо в условиях опыта). На практике удобнее пользоваться уравнением изобары химической реакции, так как относительное постоянство давления обеспечивает сама внешняя среда.
(dlnKp/dT)p = ∆H/RT2 – уравнение изобары
Из уравнения следует, что с повышением температуры константа равновесия будет возрастать в эндотермических реакциях, в экзотермических же она будет уменьшаться. Для увеличения константы в экзотермических реакциях необходимо понижать температуру.
После интегрирования уравнение будет иметь следующий вид:
ln(K(T2)/K(T1)) = ∆H(T2 – T1) / RT2 T1
Из этого уравнения вытекает зависимость теплового эффекта от температуры, т.е. можно рассчитать величину теплового эффекта, если известны константы при двух температурах.
∆H =(RT2T1 / (T2 – T1)) ln(K(T2)/K(T1))
Используя это уравнение можно рассчитать константу равновесия при любой температуре, если будет известна ∆H.
Исходя из уравнения изобары, были выведены факторы смещения химического равновесия. Принцип Ле Шателье – если на систему, находящуюся в равновесии произвести воздействие (Т, Р, С), то система будет оказывать противодействие. Например: Hb + O2 HbO2, венозная кровь поступает в легкие, в следствии чего
повышается давление кислорода. В соответствии с принципом Ле Шателье равновесие должно сместиться в сторону понижения давления, т.е. вправо. В левой части концентрация кислорода будет уменьшаться, а в правой – кровь начнет обогащаться кислородом, образуя оксигемоглобин. Артериальная кровь с оксигемоглобином поступает в ткани, и у нее давление оказывается ниже, чем в тканях, в результате чего равновесие смещается влево и кислород выделяется для дыхания ткани. Пример 2: при повышении температуры равновесие процесса сместится в направлении эндотермической реакции, а при понижении температуры в направлении экзотермической реакции. Так для реакции
4HCl(г) + O2(г) 2Н2О(г) + 2Сl2 (г), ∆H = -113кДж/моль
смещение в прямом направлении произойдет, если понизить температуру или увеличить давление, или понизить концентрацию продуктов реакции; для смещения реакции в обратную сторону необходимо повысить температуру, понизить давление, понизить концентрацию исходных веществ.
К биологическим процессам нельзя применить понятие химического равновесия, поскольку процессы, проходящие в живых организмах, необратимы. Но, тем не менее, живые организмы находятся в стационарном состоянии.
Стационарное состояние.
В отличие от химического равновесия стационарное состояние не характеризуется равенством скоростей прямой и обратной реакций. Обычно скорость реакции в одном направлении выше, чем в другом, при чем разность между скоростями постоянна во времени. Отмечается неизменность во времени скоростей притока и удаления веществ и энергии.
Состояние системы, при котором ее параметры со временем не меняются, но происходит обмен веществом и энергией с окружающей средой называется стационарным. Для живых организмов характерно постоянство параметров стационарного состояния во времени, которое называется – гомеостаз.
Сходство химического равновесия со стационарным состоянием заключается в неизменности во времени (сохраняет свои параметры), а отличие между ними заключается в двух признаках:
-
∆G ≠ 0 – для стационарного состояния, ∆G / ∆t = ∆Gi / ∆t + ∆Ge / ∆t – для химического равновесия (величина постоянная).
-
Энтропия при стационарных состояниях минимальна, а при химическом равновесии – максимальна.
Стационарное состояние поддерживается с помощью ауторегулирования, то есть если в системе произошло отклонение от этого состояния, то срабатывают физиологические механизмы и система приближается к новому стационарному состоянию. Аутостабилизация – восстановление и поддержание стационарного состояния (свойство стационарности открытых систем). Если система испытывает ослабление внешнего воздействия, то уровень стационарного состояния сохраняется. В случае усиления внешнего воздействия система переходит от одного уровня к другому. Все уровни стационарного состояния лежат в пределах физиологических норм отклонений.
п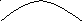
 араметр:
верхняя граница
нормы (спортсмен ставит рекорд)
араметр:
верхняя граница
нормы (спортсмен ставит рекорд)
(Т, р) стационарное состояние


 нижняя
граница нормы (при операции)
нижняя
граница нормы (при операции)
 время(t)
время(t)
Рис.: Стационарное состояние и его отклонения.
Если ауторегулирующие механизмы способны поддерживать стационарное состояние при данном воздействии, то организм адаптируется к этим условиям. В случае нарушения адаптационных механизмов возникают заболевания, в тяжелых случаях происходит гибель организма.
