
Фотометрический и спектрофотометрический анализ
Фотометрический и спектрофотометрический методы количественного анализа основаны на способности определяемого вещества — компонента смеси или газа, их окрашенных аналитических форм поглощать электромагнитное излучение оптического диапазона. Концентрацию поглощающего вещества находят, измеряя поглощение. Поглощение при данной длине волны является, таким образом, материальным воплощением информации о качестве и количестве определяемого вещества и составляет аналитический сигнал.
В практике фотометрического анализа используют УФ, видимую и ИК области спектра. Наибольшее распространение получили фотометрические методы анализа, основанные на поглощении в видимой области спектра, т. е. в интервале длин волн 400— 780 нм. Это объясняется возможностью получения множества интенсивно окрашенных органических и неорганических соединений, пригодных для их фотометрического определения в видимой области спектра с помощью несложных и относительно недорогих приборов.
В зависимости от используемой для определения поглощения в УФ и видимой областях спектра аппаратуры различают фотометрический и спектрофотометрический анализ. Оба эти метода основаны на общем фотометрическом принципе измерения поглощения, но в первом методе измеряется поглощение полихроматического излучения, во втором — монохроматического.
Фотометрические методы обеспечивают удовлетворительную воспроизводимость получаемых результатов, относительное стандартное отклонение Sr ≈ 0,01 - 0,03. Более совершенный спектрофотометрический метод в большинстве практических случаев улучшает этот показатель.
Таким образом, фотометрический анализ — более широкое понятие по сравнению со спектрофотометрическим анализом, но, подчеркнем еще раз, оба метода по существу едины, их объединяет общность теоретических положений.
Если определяемое вещество обладает собственным поглощением в УФ или видимой области, то центральное место в фотометрическом анализе приобретает химическая аналитическая реакция. Химические реакции, используемые в фотометрическом анализе, должны обязательно сопровождаться возникновением, изменением или ослаблением светопоглощения раствора. Как и каждая реакция, используемая в количественном анализе, цветная реакция должна протекать избирательно, быстро, полностью и воспроизводимо. Окраска образующейся аналитической формы должна быть устойчивой во времени и к действию света, а поглощение раствора, дающее информацию о концентрации поглощающего вещества, должно подчиняться закону Бугера-Ламберта-Бера.
В неорганическом фотометрическом анализе наиболее часто применяют реакции комплексообразования ионов определяемых элементов с неорганическими и, особенно с органическими реагентами, реже реакции окисления-восстановления, синтеза и других типов. В органическом фотометрическом анализе чаще применяют реакции образования окрашенных соединений, которыми могут быть азосоединения, полиметиновые и хинониминовые красители, ациформы нитросоединений и др. Иногда используют собственную окраску веществ.
Таким образом, общая схема выполнения фотометрического определения едина и включает следующие стадии:
1) подготовку пробы и переведение определяемого вещества или компонента в раствор в реакционноспособной форме;
2) получение окрашенной аналитической формы определяемого вещества в результате проведения цветной реакции при оптимальных условиях, обеспечивающих ее избирательность и чувствительность;
3) измерение поглощения раствора аналитической формы, т. е. регистрация аналитического сигнала при определенных условиях, отвечающих его локализации и наибольшей интенсивности;
4) проверку результата анализа, оценку его воспроизводимости и выдачу окончательного результата с метрологической оценкой.
В зависимости от характера решаемой практической задачи фотометрическое определение можно выполнять собственно фотометрическим или спектрофотометрическим методом, измеряя светопоглощение раствора на приборе с низкой или высокой степенью монохроматизации, т. е. на фотоэлектроколориметре или на спектрофотометре.
Условия фотометрического определения.
Фотометрический анализ выполняют при оптимальных условиях, обеспечивающих полноту образования аналитической формы в растворе и отсутствие или минимизацию отклонений от закона Бугера—Ламберта—Бера. Важнейшие из них: оптимальное значение рН раствора, достаточный избыток реагента, селективная аналитическая реакция, наилучшие условия измерения поглощения.
Фотометрическое титрование.
Фотометрическое
титрование основано на регистрации
изменения поглощения (или пропускания)
анализируемого раствора по мере
прибавления титранта. По результатам
измерений строят кривую титрования в
координатах
![]() ,
где Vв
— объем добавленного титранта, и по
излому на ней или по скачку находят
конечную точку титрования. Зная расход
титранта, соответствую-щий этому моменту,
вычисляют содержание определяемого
вещества в титруемом растворе по
обычным формулам титриметрического
анализа. При этом исходят из того, что
в момент эквивалентности число молей
эквивалента определяемого вещества
n(А)
в объеме титруемой пробы (т. е. в аликвотной
части анализируемого раствора) равно
числу молей эквивалента титранта
,
где Vв
— объем добавленного титранта, и по
излому на ней или по скачку находят
конечную точку титрования. Зная расход
титранта, соответствую-щий этому моменту,
вычисляют содержание определяемого
вещества в титруемом растворе по
обычным формулам титриметрического
анализа. При этом исходят из того, что
в момент эквивалентности число молей
эквивалента определяемого вещества
n(А)
в объеме титруемой пробы (т. е. в аликвотной
части анализируемого раствора) равно
числу молей эквивалента титранта
![]()
откуда
![]()
где
![]() — фактор эквивалентности реагента В в
реакции с веществом А;
— фактор эквивалентности реагента В в
реакции с веществом А;
![]() —
молекулярная масса А;
—
молекулярная масса А;
![]() — концентрация титранта, моль/л;
— концентрация титранта, моль/л;
![]() —
расход титранта, мл.
—
расход титранта, мл.
Величину поглощения А можно измерять, используя излучение высокой степени монохроматичности, то есть при определенной длине волны λ в случае применения спектрофотометра, или в некотором интервале длин волн при работе с фотометром или фотоэлектроколориметром, когда монохроматизация осуществляется с помощью светофильтров.
Реакции, используемые в титриметрии, должны быть стехиометричными, быстрыми, иметь достаточно большую константу равновесия и удобный способ индикации конечной точки — в данном случае фотометрический. Преимуществом метода является возможность применения реакций, не заканчивающихся в точке эквивалентности (на рисунке кривые 2, 4), последнюю в этом случае можно найти интерполяцией прямолинейных участков кривой титрования до их пересечения. С помощью этого приема можно определять очень слабые протолиты, регистрировать образование малоустойчивых комплексов, то есть проводить титриметрическое определение в тех случаях, когда невозможно добиться успеха при использовании других методов индикации конечной точки титрования.
В фотометрическом титровании могут
быть использованы все химические
реакции, применяемые в титриметрии:
кислотно-основные, окислительно-восстановительные,
реакции осаждения, комплексо-образования.
Для определения ионов металлов наиболее
широко используют реакции
комплексообразования. Обобщение
большого количества материала по
фотометрическому титрованию показало,
что оно возможно, если
фотометрическом титровании могут
быть использованы все химические
реакции, применяемые в титриметрии:
кислотно-основные, окислительно-восстановительные,
реакции осаждения, комплексо-образования.
Для определения ионов металлов наиболее
широко используют реакции
комплексообразования. Обобщение
большого количества материала по
фотометрическому титрованию показало,
что оно возможно, если
![]() .
Чувствительность фотометрического
прибора достаточно высока и способна
обеспечить регистрирование даже малых
изменений поглощения, поэтому
фотометрическое титрование относят к
достаточно чувствительным методам
анализа. Интенсивное поглощение в
УФ и видимой областях спектра, обусловленное
разрешенными электронными переходами
в реактантах титриметрических систем,
позволяет с удовлетворительной
воспроизводимостью и с высокой
чувствительностью определять весьма
малые количества веществ в сильно
разбавленных растворах — до
.
Чувствительность фотометрического
прибора достаточно высока и способна
обеспечить регистрирование даже малых
изменений поглощения, поэтому
фотометрическое титрование относят к
достаточно чувствительным методам
анализа. Интенсивное поглощение в
УФ и видимой областях спектра, обусловленное
разрешенными электронными переходами
в реактантах титриметрических систем,
позволяет с удовлетворительной
воспроизводимостью и с высокой
чувствительностью определять весьма
малые количества веществ в сильно
разбавленных растворах — до
![]() моль/л.
Так как содержание определяемого
вещества в пробе при фотометрическом
титрований находят не по поглощению, а
по расходу титранта, который может быть
измерен с большей, чем поглощение,
точностью, то фотометрическое титрование
отличается от обычной фотометрии лучшей
воспроизводимостью получаемых
результатов.
моль/л.
Так как содержание определяемого
вещества в пробе при фотометрическом
титрований находят не по поглощению, а
по расходу титранта, который может быть
измерен с большей, чем поглощение,
точностью, то фотометрическое титрование
отличается от обычной фотометрии лучшей
воспроизводимостью получаемых
результатов.
Существует два варианта фотометрического титрования — безындикаторный и индикаторный. Безындикаторное титрование (по собственному поглощению) может быть осуществлено в том случае, если хотя бы один из партнеров титриметрической системы — определяемое вещество А, титрант В или продукт реакции С — поглощает излучение в выбранной рабочей оптической области. Например, кривая типа 1 получается при условии поглощения только продукта реакции С. В самом деле, по мере протекания реакции А + В → С, концентрация продукта реакции С нарастает и после достижения конечной точки практически не изменяется, этот момент титрования может быть зарегистрирован на кривой титрования. Кривая 2 отвечает титрованию окрашенного определяемого вещества А бесцветным титрантом В с образованием бесцветного продукта реакции С. Несмотря на то что реакция титрования здесь не заканчивается в конечной точке, последнюю можно найти методом интерполяции, то есть, в этом случае реализуется одно из преимуществ фотометрического титрования.
Если партнеры аналитической реакции не обладают собственным поглощением или оно очень мало, выполняют индикаторное титрование. При этом в титруемый раствор перед титрованием вводят индикатор, образующий окрашенное соединение с определяемым веществом Ind + А → IndA или с избытком титранта Ind + В → IndB. В результате протекания аналитической реакции в момент эквивалентности происходит резкое уменьшение концентрации А или резкое увеличение концентрации Вив растворе протекают следующие реакции
IndA + В → С + Ind
или Ind + В → IndB,
вызывающие изменение состояния индикатора и, следовательно, поглощение титруемого раствора. В этом случае фотометрический прибор регистрирует кривые титрования билогарифмического типа 7, 8. За конечную точку титрования принимают точку перегиба таких кривых.
В ысокая
чувствительность фотометрических
измерений дает возможность регистрировать
даже малые различия в равновесиях
аналитических реакций компонентов
анализируемой смеси с титрантом. Тем
самым достигается ценная для практики
избирательность метода. Например,
можно определять содержание двухтрех
компонентов смеси с помощью одной
процедуры титрования, при этом на
кривой титрования получается
соответствующее число конечных точек,
отвечающих последовательному
оттитровыванию компонентов смеси. Таким
образом, если константы равновесия
нескольких аналитических реакций, чаще
всего для двух определяемых веществ,
неодинаковы и различаются в достаточной
степени, можно выполнить анализ смеси
одним титрованием.
ысокая
чувствительность фотометрических
измерений дает возможность регистрировать
даже малые различия в равновесиях
аналитических реакций компонентов
анализируемой смеси с титрантом. Тем
самым достигается ценная для практики
избирательность метода. Например,
можно определять содержание двухтрех
компонентов смеси с помощью одной
процедуры титрования, при этом на
кривой титрования получается
соответствующее число конечных точек,
отвечающих последовательному
оттитровыванию компонентов смеси. Таким
образом, если константы равновесия
нескольких аналитических реакций, чаще
всего для двух определяемых веществ,
неодинаковы и различаются в достаточной
степени, можно выполнить анализ смеси
одним титрованием.
Аналогичный прием может быть реализован в индикаторном варианте титрования. В данном случае окраска комплексов обоих ионов металлов с используемым индикатором одинакова. Следовательно, только фотометрический способ позволяет установить наличие двух конечных точек титрования, отвечающих последовательно оттитровываемым компонентам смеси.
А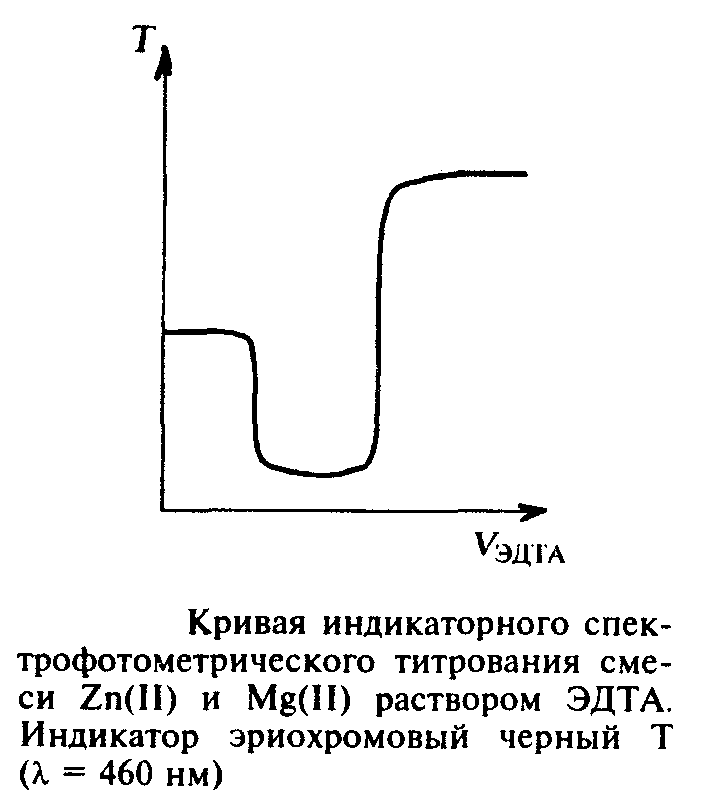 налитические
реакции в методе фотометрического
титрования проводят при оптимальных
условиях, способствующих максимальному
выходу аналитической формы, при длине
волны, соответствующей наибольшему
поглощению того партнера, по окраске
которого (или его соединения с индикатором
при индикаторном титровании) следят за
ходом реакции. При выборе индикатора
для конкретного случая фотометрического
титрования, естественно, следует
соблюдать общие правила, сформулированные
для титриметрических методов анализа,
согласно которым момент изменения
окраски индикатора должен соответствовать
резкому изменению концентрации веществ
А или В, в зависимости от избранного
способа
регистрации конечной точки титрования.
налитические
реакции в методе фотометрического
титрования проводят при оптимальных
условиях, способствующих максимальному
выходу аналитической формы, при длине
волны, соответствующей наибольшему
поглощению того партнера, по окраске
которого (или его соединения с индикатором
при индикаторном титровании) следят за
ходом реакции. При выборе индикатора
для конкретного случая фотометрического
титрования, естественно, следует
соблюдать общие правила, сформулированные
для титриметрических методов анализа,
согласно которым момент изменения
окраски индикатора должен соответствовать
резкому изменению концентрации веществ
А или В, в зависимости от избранного
способа
регистрации конечной точки титрования.
