
Практическая часть.
Метод основан на фотометрическом титровании ионов цинка раствором ЭДТА в присутствии эриохрома черного Т:
![]()
ЭДТА является комплексоном — органическим реагентом, образующим со многими ионами металлов устойчивые комплексные соединения — комплексонаты:
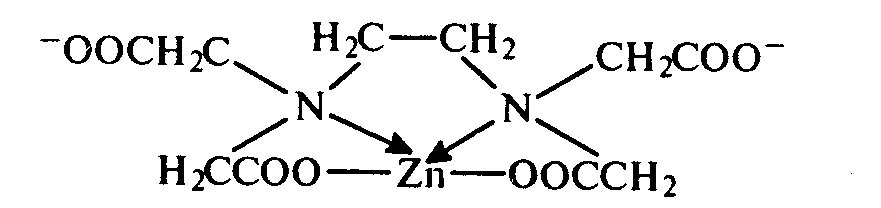
Титрование проводят в среде аммиачного буферного раствора при рН = 9, так как в этих условиях достигается наибольшая устойчивость комплексоната цинка. В качестве металлоиндикатора на ионы цинка используют эриохром черный Т, проявляющий кислотно-основные свойства за счет ионизации комплексообразующих групп.
Гидроксид цинка при рН = 9 осаждается из раствора, что делает само определение невозможным. Чтобы воспрепятствовать этому процессу, в раствор вводят маскирующий комплексообразователь — аммиак. Благодаря этому цинк удерживается в щелочном аммиачном растворе в виде аммиакатов.
Индикатор эриохром черный Т является красителем группы о,о’-диоксиазонафталина и он способен координировать ионы Zn, взаимодействие происходит по о-окси-о’-оксиазогруппировке
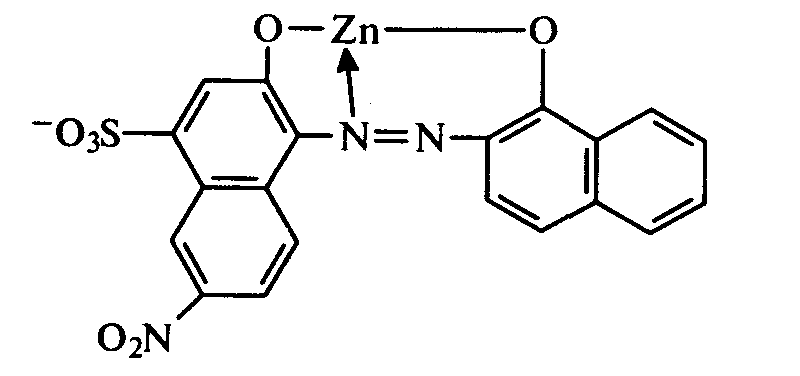
При этом
образуется комплекс, но менее устойчивый,
чем комплексонат цинка. В реальных
условиях титрования это различие
еще более усиливается, что можно показать
расчетом соответствующих условных
констант устойчивости комплексоната
цинка и комплекса цинка с металлоиндикатором
с учетом побочных реакции. В первом
случае происходит взаимодействие ионов
цинка с аммиаком (![]() )
и протонирование ЭДТА (
)
и протонирование ЭДТА (![]() ,
во втором — то же для цинка и еще
протонирование индикатора (
,
во втором — то же для цинка и еще
протонирование индикатора (![]() ):
):
![]()
![]()
Значения констант устойчивости и коэффициентов побочных реакций взяты из справочной литературы.
Ионное состояние эриохрома черного Т сильно подвержено влиянию рН раствора. Значительное различие в условных константах устойчивости комплексов цинка с ЭДТА и с индикатором эриохромом черным Т обеспечивает достаточно большое значение константы равновесия для протекающего в конечной точке процесса разрушения комплекса цинка с индикатором:
![]()
Х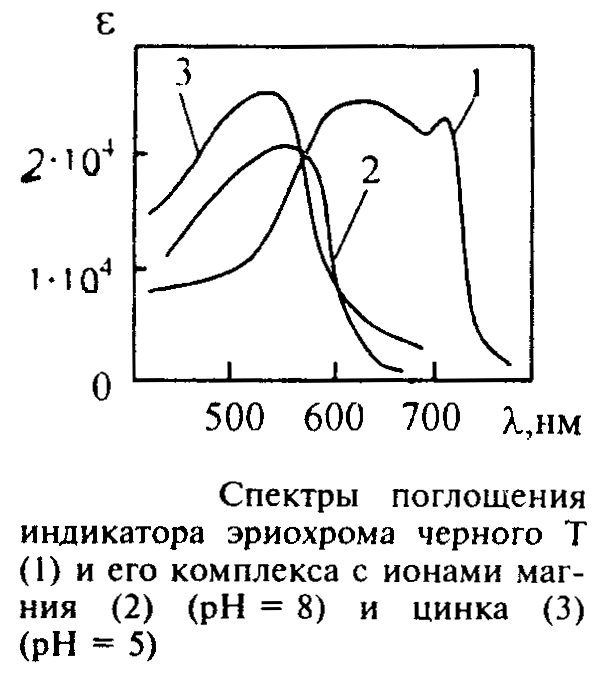 орошая
контрастность цветной реакции
индикатора с металлом, под которой
понимают разность между максимумами
поглощения комплекса цинка с
индикатором и свободного индикатора
(см. рисунок), позволяет использовать
ее для фотометрической индикации
конечной точки титрования. Оптимальной
для фотометрического титрования
цинка будет среда, содержащая 0,1 М NH3
(рН=9). В этих условиях фотометрическому
титрованию ионов цинка раствором ЭДТА
не мешают ионы Ва(II)
, Са(II),
Mg(II),
Sr(II),
так как для них
орошая
контрастность цветной реакции
индикатора с металлом, под которой
понимают разность между максимумами
поглощения комплекса цинка с
индикатором и свободного индикатора
(см. рисунок), позволяет использовать
ее для фотометрической индикации
конечной точки титрования. Оптимальной
для фотометрического титрования
цинка будет среда, содержащая 0,1 М NH3
(рН=9). В этих условиях фотометрическому
титрованию ионов цинка раствором ЭДТА
не мешают ионы Ва(II)
, Са(II),
Mg(II),
Sr(II),
так как для них
![]() .
Если различие в устойчивости комплексов
окажется недостаточным, то для обеспечения
избирательности определения применяют
реакции маскирования.
.
Если различие в устойчивости комплексов
окажется недостаточным, то для обеспечения
избирательности определения применяют
реакции маскирования.
Экспериментальная часть.
Приборы и реактивы:
Абсорбциометр ЛМФ-69, ЛМФ-72 с оранжевым светофильтром
Рабочий раствор сульфата цинка ZnSO4 ▪7H2O (хч) с концентрацией цинка 6,54 мг/мл (0,05 М)
Раствор эриохрома черного Т, 0,1%-ный
Выполнение работы
Установка титра раствора ЭДТА по цинку.
В стакан для фотометрического титрованиям вносят 1 мл стандартного раствора ZnSO4 • 7Н2О, 5 мл раствора NH4Cl, 25 мл раствора аммиака, 0,5 мл раствора эриохрома черного Т и 10 мл дистиллированной воды. Стакан с полученным раствором помещают в прибор и титруют раствором ЭДТА, снимая показания прибора каждый раз после прибавления 0,1 мл титранта (вблизи точки эквивалентности по 0,05 мл). По результатам титрования строят график T — f(V).
Титруют не менее трех проб, находят среднее значение объема титранта (Vэдта) и рассчитывают титр ЭДТА:
![]()
Определение содержания цинка (II) в растворе.
К анализируемому раствору добавляют 5 мл раствора NH4Cl, 25 мл раствора аммиака, 0,5 мл эриохрома черного Т, 10 мл дистиллированной воды и титруют раствором ЭДТА (не менее трех титрований). По результатам строят кривые титрования и находят Vэдта . По среднему значению рассчитывают содержание цинка в растворе. Методом наименьших квадратов находят доверительный интервал результата и стандартное отклонение.
