
- •Характеристика наполнителей
- •Понятие о максимальной плотности упаковки частиц наполнителя.
- •3. Термодинамика смачивания.
- •Смачивание реальных твердых тел
- •Влияние шероховатости поверхности на процессы смачивания.
- •Смачивание неоднородных поверхностей
- •Классификация видов смачивания по природе сил взаимодействия
- •Критическое натяжение смачивания
- •Пропитывание пористых материалов
- •Специфика адсорбции из растворов
- •Классификация пав
- •Адсорбция нпав
- •Адсорбция ипав
- •Адсорбция полимеров
- •Понятие о поверхностных силах 1-го и 2-го рода
- •Электростатическая составляющая расклинивающего давления
- •Структурная составляющая расклинивающего давления u(h)с
- •Адсорбционная составляющая расклинивающего давления u(h)адс
- •Стерическая составляющая расклинивающего давления
- •Возможные варианты энергетических кривых взаимодействия частиц
- •Структуры типа кс-1
- •Структуры типа кс-2
- •Влияние концентрации дисперсной фазы на реологическое поведение структур кс-1 и кс-2
- •3)Как создать в системе кс-1:
- •2.Регулир с неполярными частицами
- •3.Система с неполярной дисп средой и полярными частицами.
- •4.Система с вязкой дисперсионной средой
-
Адсорбционная составляющая расклинивающего давления u(h)адс
за счет изменения энергии молекулярного притяжения частиц при наличии на их поверхности адсорбционных слоев из НПАВ и полимеров.
Может проявляться двояко:
-
наличие адсорбционных слоев может влиять на молекулярное притяжение частиц (эффект экранирования)
-
Слои не позволяют частицам сблизиться на необходимое расстояние.
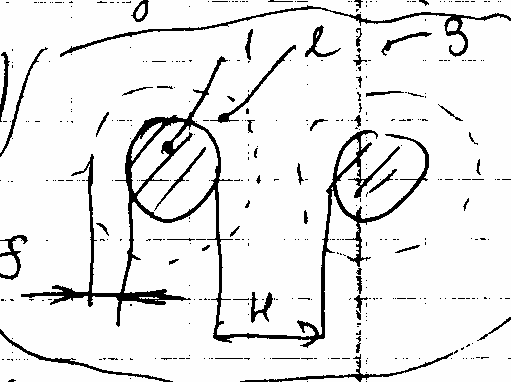
18.1 Механизм эффекта экранирования
Проявляется если:
□ ε2 (слоя) ≠ ε1(частицы) ≠ ε3 (дисперсионной среды)
□ ε2 < ε1 уменьшение. Uм(адс) < Uм(без слоя). Слои ослабляют притяжение.
□ ε2 > ε1 – адсорбционные слои усиливают молекулярное притяжение частиц.
Эффект проявляется на расстоянии 10 нм и не связан с перекрыванием адсорбционных слоев.
18.2 Эффект защиты расстоянием
Проявляется в том случае, когда ε2 ≠ ε1 , и ε2 ≈ ε3 (близки). Адсорбция слабая. Адсорбционные слои получаются «рыхлыми», но сильно сольватированными. Они имеют большую толщину. Перекрывание происходит на больших расстояниях. В результате частицы не могут сблизится.
Чтобы эффекты проявились одновременно, адсорбционные слои должны быть плотными и сильно сольватированными. (концентрация > ККМ).

ε2‘ – диэлектрическая проницаемость УВ части ПАВ. Почти всегда ε2‘<ε1, ε2 ≈ ε3
18.3 Уравнение для расчета адсорбционной составляющей
Uадс = - (r1r2)/(r1 + r2) (A/(H-2δ) + B/(H- δ) + C/H)
A = f(ε2; ε3 )
B = f(ε1; ε2 )
C = f(ε1; ε2; ε3 )
A + B + C = A*
-
Стерическая составляющая расклинивающего давления
Обусловлена эффектами, возникающими при перекрывании адсорбционных слоев.
Механизм:
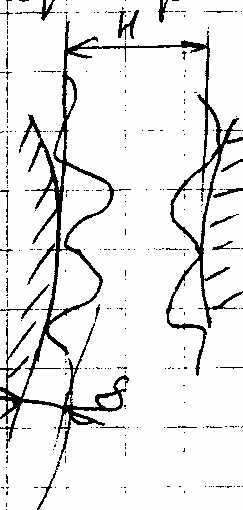
Н>2δ – слои не перекрываются. Uстер = 0, эффект не проявляется.
При сближении возможны 2 случая:
- Н<2δ; Н>δ – адсорбционные слои проникают друг в друга без деформирования. Энергия, требуемая для такого сближения называется свободной энергией смещения.

- Н<δ – возможно за счет деформации адсорбционных слоев. Необходимо затратить энергию; для ее расчета используется
уравнение Фишера:
U = 4/3πRTA2 Cδ2(δ-H/2)2 * (3r + 2δ + H/2)
Cδ кг/м3
А2 моль*м3/кг2
U22 < U23; A2>0 – хороший растворитель
U22 > U23; A2<0 – плохой растворитель
U22 ~ U23; A2≈0 – квазиидеальные растворители

1) Н Uст const
H>2δ, Uст => 0
2) A2 >0, Uст >0
A2<0, Uст<0
A2 = 0, Uст = 0
3) A2 > 0, с ростом А2 Uст – уменьшается
Cδ уменьшится, δ увеличится.

А2<0, А2 будет возрастать => Uст увеличится.
-
Возможные варианты энергетических кривых взаимодействия частиц
20.1 энергетическая кривая лежит в области отрицательных значений энергии

Происходит сближение частиц вплоть до их непосредственного соприкосновения (коагуляция). Такой вариант реализуется при сильном молекулярном притяжении (полярности частиц дисперсной фазы и среды существенно различаются) и слабом электростатическом отталкивании (высокая ионная сила дисперсионной среды, низкое значение поверхностного потенциала).
20.2 Кривая лежит в области положительных значений энергии

На кривой имеется потенциальный барьер, высота которого > 10 – 15 kТ (энергия теплового движения частиц 1,5 kТ). Частицы дисперсной фазы при этом стремятся разойтись на расстояния, на которых энергия отталкивания обращается в 0. При таком характере взаимодействия система является агрегативно устойчи-вой. Данный вид зависимостей реализуется при слабом молекулярном притяжении (полярности частиц и дисперсной фазы и дисперсионной среды близки) и сильном электростатическом отталкивании частиц (высокие потенциалы поверхности частиц и низкая ионная сила дисперсионной среды). Кроме того должно соблюдаться определенное соотношение между размерами частиц и толщиной поверхностных слоев (размеры частиц не должны превышать 5 – 10 мкм.).
20.3 Кривая с двумя энергетическими минимумами

В том случае, если высота энергетического барьера Uмакс > 10-15kТ и глубина второго энергетического минимума Uмин2 > 10-15kТ происходит взаимная фиксация частиц на расстоянии, соответствующем положению второго энергетического минимума. При этом между частицами остается прослойка поверхностных слоев. Такой вид взаимодействия называется агрегацией. Данный вид энергетических кривых характерен для взаимодействия частиц достаточно больших размеров (доли, единицы и десятки мкм).
20.4 Изменение типов энергетических кривых
1) Введение электролита (KCl). С увеличением концентрации происходит переход от кривых отталкивания (энергия в положительной области) к кривым «притяжения»
2) при снижении поверхностного потенциала, повышении ионной силы электростатическое отталкивание ослабевает. Осуществляется переход к кривым «сближения» 20.1.
3) При повышении гидрофобности (Θ > 50) проявляется структурная составляющая – притяжение.
20.5 Типы контактов
1) Коагуляционные. Взаимная фиксация частиц во втором энергетическом минимуме. Взаимодействие – агрегация. Их прочность ~10-11÷ 10-9 Н. Такие контакты могут обратимо разрушаться.
2) Атомные. Образуются, если преобладает сила притяжения. Они соприкасаются по площадкам в несколько 10 или 100 атомов. Прочность составляет 10-6÷10-9 Н. Могут разрушаться обратимо. Возникают при взаимодействии в первом энергетическом минимуме.
3) Фазовые. Поверхности «срастаются» друг с другом. Осуществляется переход из одной частицы в другую. Результат поверхностной реакции, диффузионный механизм. Обязательное условие – контакт частиц, т.е. реализуется в случае кривых «сближения». Сила контакта определяется прочностью частицы. Разрушаются необратимо. Прочность >> 10-6 Н.
Структурирование в дисперсных системах. Реологические свойства.
