
- •В. Р. Зайлалова учебное пособие по курсу «химия нефти и газа»
- •Введение
- •1. Происхождение нефти
- •2. Элементарный состав нефти
- •3. Фракционный состав нефти
- •3.1. Детонационная стойкость горючего
- •3.2. Переработка углеводородного сырья
- •3.2.1. Переработка каменного угля
- •3.2.2. Перспективы развития энергетики
- •4. Групповой углеводородный состав нефти. Классификация нефти
- •5. Молекулярный вес
- •6. Физические свойства нефти
- •6.1. Плотность
- •6.2. Вязкость
- •6.3. Температурные переходы и агрегатные превращения
- •6.4. Тепловые свойства
- •6.5. Оптические свойства
- •6.6. Электрические свойства
- •7. Фазовое равновесие в системе «нефть — газ»
- •8. Классификация углеводородов
- •8.1. Предельные (насыщенные) углеводороды. Алканы (парафины)
- •Физические свойства
- •Химические свойства
- •Способы получения
- •8.2. Предельные углеводороды. Циклоалканы
- •Физические свойства
- •Химические свойства
- •Способы получения
- •8.3. Непредельные (ненасыщенные) углеводороды. Алкены (этиленовые углеводороды)
- •Физические свойства
- •Химические свойства
- •Способы получения
- •8.4. Непредельные углеводороды. Алкадиены
- •Химические свойства
- •Способы получения
- •8.5. Непредельные углеводороды. Алкины (ацетиленовые углеводороды)
- •Физические свойства
- •Химические свойства
- •Способы получения
- •8.6. Ароматические углеводороды. Бензол и его гомологи
- •Химические свойства
- •Свойства бензола
- •Свойства гомологов бензола
- •Способы получения
- •9. Неуглеводородные соединения нефти
- •9.1. Кислородные соединения
- •Азотистые соединения
- •Сернистые соединения
- •10. Смолистые вещества
- •11. Минеральные компоненты нефти
- •12. Методы выделения компонентов
- •12.1. Перегонка
- •12.2 Азеотропная и экстрактивная ректификация, экстракция, абсорбция
- •И селективность растворителей при 60°с
- •12.3. Адсорбция
- •12.4. Кристаллизация
- •12.5. Диффузионные методы разделения углеводородов
- •13. Природные и попутные газы. Применение газа
- •13.1 Природные газы
- •Попутные (нефтяные) газы
- •Применение газа
- •Термические превращения углеводородов нефти
- •14.1. Термодинамика процесса
- •14.2. Кинетика и механизм процесса
- •Энергия связи с—с, кДж/моль: 335; 322; 314; 310; 314; 322; 335
- •14.3. Термические превращения углеводородов в газовой фазе
- •Превращения алканов
- •14.3.2. Превращения циклоалканов
- •14.3.3. Превращения алкенов
- •Суммарную реакцию можно записать уравнением:
- •14.3.4. Превращения алкадиенов и алкинов
- •14.3.5. Превращения аренов
- •15. Термокаталитические превращения
- •15.1. Механизм действия катализаторов окислительно-восстановительного типа
- •15.2. Кислотный катализ
- •15.3. Реакции карбкатионов
- •15.4. Каталитический крекинг
- •15.4.1. Превращения алканов
- •15.4.2. Превращение циклоалканов
- •15.4.3. Превращение алкенов
- •15.4.4. Превращение аренов
- •15.4.5. Катализаторы каталитического крекинга
- •15.4.6. Каталитический крекинг в промышленности
- •15.5. Каталитический риформинг
- •15.5.1. Химические основы процесса
- •15.5.2. Катализаторы риформинга
- •15.5.3. Каталитический риформинг в промышленности
- •16. Гидрогенизация в нефтепереработке
- •16.1. Классификация процессов
- •16.2. Классификация каталитических реакций с водородом
- •16.3. Термодинамика и катализаторы гидрирования
- •Список литературы
- •Содержание
8.2. Предельные углеводороды. Циклоалканы
|
Определение |
Циклоалканы (циклопарафины) — насыщенные УВ, содержащие цикл из трех и более атомов углерода. Относятся к алициклическим УВ
|
|
Общая формула |
CnH2n (n ≥ 3)
|
|
Изомерия и номенклатура
|
циклопропан циклобутан циклопентан циклогексан
Изомерия цепи
|
|
|
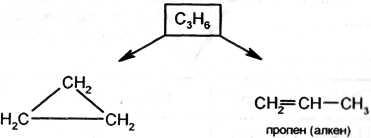
Межклассовая изомерия. Циклоалканы изомерны алкенам
циклопропан
|
Физические свойства




Высшие циклоалканы
(C3H6) (C4H8) (C5H10) (C6H12)
Б/цв. газы Жидкости Жидкости
Плохо растворимы в воде.
Химические свойства
Малые циклы (С3, С4) неустойчивы и легко разрушаются. Обычные циклы (С5—С7) очень устойчивы и не склонны к разрыву в химических реакциях. Для малых циклов характерны реакции присоединения (сходство с алкенами); для обычных циклов — реакции замещения (сходство с алканами).
|
Тип, название реакции |
Примеры реакций |
|
I. Реакции присоединения 1. Гидрирование (образуются алканы) |
+ + Н2 СН3-СН2-СН3
циклопропан пропан |
|
2. Галогенирование (образуются дигалогеналканы) |
+ Br2 Br–CH2–CH2–CH2–Br
Циклопропан 1,3-дибромпропан |
|
3.Гидрогалогени-рование (образуются галогеналканы) |
| | Br H метилциклопропан 2-бромбутан
|
|
II. Реакции замещения Галогенирование (образуются галогенциклоалканы) |
hv циклогексан хлорциклогексан |
|
III. Реакции дегидрирования (образуются ароматические УВ) |
С6Н6 + 3H2
циклогексан бензол |
Способы получения
|
Название способа
|
Уравнения реакций |
|
1. Циклизация дигалогеналканов |
H2C – CH2 – Cl H2C – CH2 | + 2Na + 2NaCl H2C – CH2 – Cl H2C – CH2 1,4-дихлорбутан циклобутан |
|
|
+ H2 циклопентен циклопентан kat 3H2
бензол циклогексан |
8.3. Непредельные (ненасыщенные) углеводороды. Алкены (этиленовые углеводороды)
|
Определение
|
Алкены
(олефины) — это УВ нециклического
строения, в молекулах которых два
атома углерода находятся в состоянии
sp2-гибридизации
и связаны друг с другом двойной
связью (длина связи |
|
Общая формула |
CnH2n (n ≥ 2) |
|
Гомологический ряд, изомерия, номенклатура |
1. CH2 = CH2 этен(этилен); радикал CH2 = CH– винил 2. CH2 = CH – CH3 пропен (пропилен); радикал CH2 = CH – CH2 – аллил 3.C4H8 : CH2 = CH – CH2 – CH3 бутен-1 (бутилен)
CH2 = C – CH3 | 2-метилпропен-1 (изобутилен) CH3
Типы изомерии: а) изомерия цепи; б) изомерия положения двойной связи; в) цис, транс-изомерия; г) межклассовая изомерия (см. «Циклоалканы»). |




 Простейшие
представители (без боковых цепей)
Простейшие
представители (без боковых цепей)
 Ni
Ni
 +
Cl2
+
Cl2
 Pd,300C
Pd,300C



 2.
Гидрирование циклоалкенов или
ароматических УВ
2.
Гидрирование циклоалкенов или
ароматических УВ