
- •Министерство образования и науки Российской Федерации
- •Основы общей химии
- •Глава 1 Первоначальные понятия химии
- •1.1. Предмет химии
- •1.2. Атомно-молекулярное учение
- •1.3. Основные понятия химии
- •1.3.1. Простые и сложные вещества
- •1.3.2. Атомная и молекулярная массы
- •1.3.3. Моль, молярная масса, молярный объем
- •1.3.4. Связь между массой вещества и его количеством
- •1.3.5. Связь между объемом вещества и его количеством
- •1.3.6. Валентность, степень окисления
- •1.4. Уравнения химических реакций
- •2 Моль атомов н - 1 моль молекул н2,
- •1.5. Вопросы для самоконтроля по теме
- •1.6. Примеры комплексных тестов для самоконтроля знаний по теме «Первоначальные понятия химии» Вариант № 1
- •1. 17, 2. 35,5, 3. 71 Г/моль, 4. 71 г, 5. 71?
- •Вариант № 2
- •1. 0,233, 2. 233, 3. 233 Г/моль, 4. 104, 5. 233 г.
- •Вариант № 3
- •1.7. Тесты и задачи для самоподготовки по теме
- •1) Воздух, 2) речная вода, 4) хлорид меди (II), 8) нефть,
- •16) Природный газ, 32) раствор соляной кислоты*.
- •1) Гашеная известь**, 2) соляная кислота, 4) резина, 8) квасцы**, 16) хлорная вода**
- •1) Мел, 2) пирит*, 4) цемент, 8) бензол, 16) глюкоза.
- •1)Гидроксид натрия, 2) оксид фосфора (V), 4) гашеная известь**,
- •8) Бензин, 16) сахароза.
- •1.7.3. Простые и сложные вещества
- •1) В состав нитрата железа входят железо, азот и кислород,
- •1) Молекула водорода, состоящая из двух атомов, 2) две молекулы водорода, 4) два атома водорода, 8) два моль атомов водорода, 16) два моль молекул водорода.
- •1) Имеет размерность г/моль, 2) численно равна значению молярной массы элемента, 4) равна отношению массы атома к массе 1 а.Е.М,
- •8) Может быть выражена в граммах, 16) может быть выражена в атомных единицах массы, 32) является безразмерной величиной.
- •1.7.5. Валентность, степень окисления
- •1.7.6. Расчеты по химическим формулам
- •1.7.7. Моль – единица измерения количества вещества
- •6,02·10 23 Атомов Cu – 64 г,
- •1 Атом Cu – х г;
- •1) 34 Г, 2) 34 г/моль, 4) 1,99 · 1022, 8) 34 а.Е.М., 16) 5,65 · 1023 г.
- •1.7.8. Ответы к комплексным заданиям для тестирования знаний по теме «Первоначальные понятия химии» Вариант № 1
- •Вариант № 2
- •Вариант № 3
- •6,02 ·1023 Молекул 98 г,
- •10 Молекул х г;
1.3.2. Атомная и молекулярная массы
Одной из важнейших характеристик атомов является его масса.
Абсолютной называется масса атома, выраженная в килограммах (граммах).
Абсолютная масса атома (maтома) величина чрезвычайно малая. Так, атом легкого изотопа водорода (протия) имеет массу 1,66 · 10–27 кг.
m(Н) = 1,66 · 10–27 кг, m(Н) = 1,66 · 10–24 г,
атом одного из изотопов кислорода имеет массу 2,67 · 10–26 кг,
m(О) = 2,67 · 10–26 кг, m(О) = 2,67 · 10–23 г,
атом изотопа углерода 12С имеет массу 1,99 · 10–26 кг,
m(С) = 1,99 · 10–26 кг, m(С) = 1,99 · 10–23 г.
В практических расчётах пользоваться такими величинами крайне неудобно. Поэтому обычно пользуются значениями не абсолютных масс атомов, а значениями относительных атомных масс.
Относительная атомная масса обозначается Ar, индекс r – начальная буква английского слова relative, что значит относительный.
В качестве единицы для измерения масс атомов и молекул принята атомная единица массы (а.е.м.).
Атомная единица массы (а.е.м.) представляет собой 1/12 часть массы атома изотопа углерода 12С, т.е.
а.е.м. = ![]() =
=
![]() · 1,99 · 10–26
кг =
· 1,99 · 10–26
кг = ![]() · 1,99 · 10–23
г.
· 1,99 · 10–23
г.
Относительная атомная масса показывает, во сколько раз масса атома данного элемента больше 1/12 части массы атома изотопа углерода 12С, т. е. атомной единицы массы.
Относительная атомная масса является безразмерной величиной, но допускается обозначение ее величины в атомных единицах массы (а.е.м.). Например:
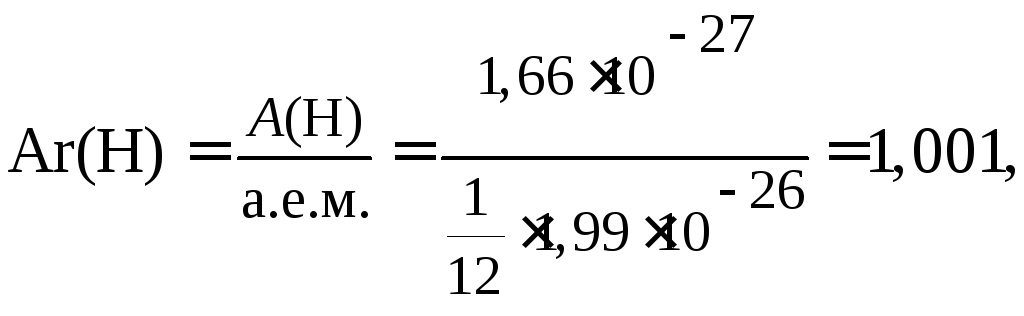
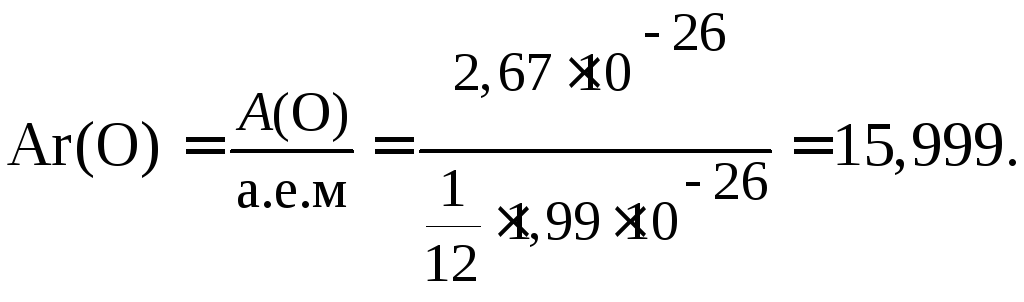
Таким образом, значение относительной атомной массы элемента водорода равно 1,001 или, округленно,
Аr(Н) ≈ 1 а.е.м, а кислорода – Аr(O) = 15,999 ≈ 16 а.е.м.
Значения величин относительных атомных масс элементов приведены в периодической системе Д.И. Менделеева. Эти величины представляют собой усредненное значение массы атома какого-либо элемента с учетом существующих в природе изотопов этого элемента и их количества. Для обычных расчетов следует пользоваться округленными значениями относительных атомных масс элементов (см. табл. 4 приложения).
Аналогично понятиям абсолютная масса атома и относительная атомная масса можно сформулировать понятия абсолютная масса молекулы и относительная молекулярная масса.
Абсолютная масса молекулы (m)мол. – масса молекулы химического вещества, выраженная в килограммах (граммах).
Относительная молекулярная масса (Мr) (или просто молекулярная масса) – масса молекулы, выраженная в атомных единицах массы.
Зная химическую формулу соединения, можно легко определить значение его молекулярной массы, которая определяется как сумма значений атомных масс всех элементов, входящих в состав молекулы вещества.
Например, относительная молекулярная масса серной кислоты Мr(Н2SO4) будет складываться из двух значений относительных атомных масс элемента водорода, одной относительной атомной массы элемента серы и четырех относительных атомных масс элемента кислорода:
Мr(Н2SO4) = 2Аr (Н) + Аr (S) + 4Аr(O) = 2·1 + 32 + 4·16 = 98.
Таким образом, значение молекулярной массы серной кислоты равно 98 или 98 а.е.м.
Молекулярная масса (относительная молекулярная масса) показывает, во сколько раз масса молекулы данного вещества больше 1/12 части массы атома углерода 12С.
В приведенном выше примере значение молекулярной массы серной кислоты равно 98 а.е.м., то есть молекула серной кислоты имеет массу в 98 раз большую, чем 1/12 часть массы атома углерода 12 С.
