
радиационка
.pdf
Природні джерела
Відомо, що людина на протязі життя постійно піддається впливу радіоактивного опромінення, на фоні якого, до речі, проходила і її еволюція.
Природні джерела радіації обумовлюють основну частину опромінення населення. Накопичена на протязі всього життя людини доза за рахунок природного радіаційного фону не перевищує, як правило, 0.1 Зв, за рахунок всіх основних джерел – 0.5 Зв.
Джерела опромінення, що обумовлюють природний фон радіоактивності, поділяються на такі, що обумовлюють зовнішнє опромінення (вони знаходяться поза організмом) та такі, що є причиною внутрішнього опромінення (джерело знаходиться всередині організму внаслідок інкорпорації).
Природний радіоактивний фон обумовлений космічними джерелами та випромінюванням природних радіоактивних речовин, що містяться в у воді, в ґрунті, в породах, з яких складаються гори, та ін. В різних регіонах внесок цих компонентів розрізняється в значній мірі.
З усіх джерел природного опромінення найбільш суттєвим впливом (3/4 річної індивідуальної еквівалентної дози опромінення від земних джерел та Ѕ від природних) характеризується газ радон. Він утворюється при розпаді урану238 (радон-220) та торію-232 (радон-222, період напіврозпаду 3.82 діб.). Радон-222 має внесок в підсумкову дозу опромінення в 20 разів більший, ніж радон–220. Радон не має органолептичних ознак (запаху, смаку), є в 7.5 разів важчим за повітря, вивільнюється з земної кори. До приміщень він надходить через фундаменти та підлогу або з будівельних матеріалів та води. В приземному шарі повітря концентрація радону становить від 5 до 20 Бк/м3,в приміщеннях – 40-60 Бк/м3. Цей газ є альфа-випромінювачем, вражає тканини легенів. В експериментах на тваринах показано, що надходження чистого радону в високих дозах викликає ураження кровотворних органів, а присутність радону та його дочірніх продуктів (ДП) – променеве ураження органів дихання з наступним розвитком раку легень. ДП утворюються при втраті атомами
радону β-часток і самі є РР: 218Ро, 214Рв, 214Ві, 214Ті. Вони відіграють основну роль
в канцерогенезі. Продукти подальшого радіоактивного розпаду радону переходять в стійкий ізотоп свинець-206. Існує комплекс заходів для зменшення впливу радону в приміщеннях.
В основній більшості регіонів Землі природний радіоактивний фон складає 0.0001 Гр з певними коливаннями, що обумовлені глибиною залягання уранових та торієвих руд. В Україні деяке підвищення природного фону стосується місць, що мають радонові джерела, наприклад, Миронівка, Хмільник. Використання деяких будівельних матеріалів, польоти на літаках на великій висоті і навіть користування телевізором підвищують рівень природного опромінення організму. Радіоактивні речовини, що попадають до продуктів харчування з повітря, ґрунту та води є джерелами внутрішнього опромінення. Значний внесок в сумарне природне опромінювання людини вносять РР, що містяться в її тілі (тобто інкорпоровані). Вони надходять з їжею, водою, повітрям. Тканини містять радіоактивний калій, уран, торій, вуглець та ін. При цьому до 90% радію концентрується в кістках, де визначається також до 60% торію. Калій-40 міститься в м’язах, нервовій тканині, серці, печінці. Відомо, що радіоактивний свинець та полоній концентруються в продуктах моря і обумовлюють дещо більші дози природного опромінення у людей, що вживають такі продукти. Якби радіоактивні речовини, що надходять до організму людини або тварини, накопичувалися в ньому, радіоактивність живого організму була б

надзвичайно велика. Але внаслідок постійного перебігу процесів обміну, ці речовини виводяться з сечею, калом, потом, внаслідок чого інтенсивність внутрішнього опромінення стабілізується.
Штучні джерела ІВ
Штучні джерела ІВ збільшують колективну дозу опромінення населення на 10-30%.
В наш час іонізуючі випромінювання використовуються в промисловості (полімеризація, радіаційна вулканізація, контроль технологічних процесів за допомогою радіонуклідів,
винайдення дефектів в металевих конструкціях з використанням γ-випромінювання),
енергетиці , сільському господарстві (знищення шкідників, затримка проростання картоплі), харчовій промисловості (радіаційна стерилізація). Використання ІВ випромінювань значно розширило також діагностичні та лікувальні можливості в багатьох галузях охорони здоров'я.
Впливу штучних джерел ІВ підлягає персонал атомних електростанцій, атомних підводних човнів, шахтарі уранових копалень, медичний персонал та пацієнти
рентгенодіагностичних та рентгенотерапевтичних, спеціалісти γ- та
рентгенодефектоскопічних установок. Професійне опромінення персоналу АЕС за 25 років роботи складає 0.25 Зв. Професійне опромінення в сполученні з опроміненням у побуті не перевищує за життя 1 Зв.
При виконанні службових обов’язків та в побуті людина піддається впливу також рентгенівського випромінювання від електронно-променевих трубок, електронних мікроскопів та електронно-вакуумних приладів. Джерелом нейтронного опромінення можуть бути атомні реактори, а також нейтронна зброя.
В свою чергу, забруднення радіонуклідами зовнішнього середовища внаслідок аварій (напр., на Чорнобильській АЕС) може привести до масових уражень персоналу та населення прилеглих територій, до розвитку специфічної патології. Потрапляючи в навколишнє середовище, радіонукліди штучного походження забруднюють ґрунт, з якого за харчовими ланцюгами надходять до організму людини. Найбільш небезпечні цезій-137 та стронцій-90, що накопичуються у внутрішніх органах та є причиною внутрішнього опромінювання.
Ці обставини обумовлюють актуальність вивчення питань патогенезу та лікування променевих уражень, профілактики їх віддалених наслідків і роблять необхідною підготовку лікарів всіх спеціальностей з питань радіаційної медицини .
Уявлення про радіоактивність та радіоактивні перетворення
Іонізуючим є випромінювання, взаємодія якого з опроміненим середовищем приводить до утворення в ньому з нейтральних атомів та молекул таких часток, що несуть електричний заряд, тобто іонів. Здатність іонізувати опромінене середовище залежить від кількості енергії, що її поглинає одиниця маси опроміненої речовини.
Іонізація речовини супроводжується зміною її фізико-хімічних властивостей. ІВ викликає в живому організмі зворотні та незворотні зміни, певні біологічні наслідки.
Джерелом ІВ можуть бути радіоактивні речовини (РР), що розташовані в періодичній системі Д.І.Менделєєва після номера 83, а також різні пристрої, що випромінюють або ж здатні до випромінювання ІВ (рентгенівські та електронно-променеві трубки, прискорювачі часток, електронні мікроскопи та ін.)

Найменшою часткою, що зберігає хімічні властивості речовини, є атом, що складається з позитивно зарядженого ядра, яке складається з протонів та нейтронів і є в 100 тис. разів менше за атом, та електронів на орбітах навколо ядра. Кількість протонів (позитивно заряджених часток) в ядрі відповідає заряду ядра і визначає хімічну належність атома. Електрично нейтральні нейтрони можуть існувати в ядрі в різних кількостях. Атоми, ядра яких мають однакову кількість протонів, але різну кількість нейтронів, називаються ізотопами. Вони відрізняються за атомною масою, але мають однаковий заряд ядра та хімічні властивості. Вони називаються ізотопами тому, що знаходяться в одній і тій же клітині таблиці Д.І.Менделєєва. Ядра всіх ізотопів називаютьсянуклідами. Кількість електронів (негативно заряджених часток)на орбітах навколо ядра дорівнює кількості протонів в ядрі. Перехід електронів з однієї орбіти на іншу супроводжується поглинанням (з внутрішніх оболонок на віддалені) або випромінюванням енергії. При поглинанні енергії відбувається збудження атома або повний відрив електрона від атома. В цьому випадку на місці електронейтрального атома утворюється позитивно заряджений залишок атома та негативно заряджений електрон. Такий стан називається іонізацією, а названі частки – іонами. При збудженні ядра його компоненти переходять на вищі енергетичні рівні, а повернення їх на вільні
(нижчі) супроводжується випромінюванням γ-квантів. З збільшенням кількості протонів
в ядрі зменшується його стійкість за рахунок зростання сил відштовхування). Ядра набувають здатності до мимовільного розпаду, тобто стаютьрадіоактивними. Мимовільний розпад речовини, що супроводжується виділенням енергії, зміною атомного номера та масового числа – радіоактивність.
Коротка характеристика основних випромінювань
При перетвореннях радіоактивних речовин (РР), що обумовлені радіоактивністю, енергія виділяється в вигляді корпускулярного (α, β–частки, протони, електрони та ін.)
та квантового (γ-, нейтрони, рентгенівське) випромінювань. β-розпад характерний для
природних радіоактивних елементів з великими порядковими номерами. Він приводить до зменшення порядкового номеру речовини на дві одиниці та масового числа на чотири одиниці. Електронний β-розпад характерний як для природних так і для штучних
радіоактивних елементів. γ-випромінювання – електромагнітне (фотонне) випромінювання при ядерних перетвореннях або анігіляції часток.
Корпускулярні випромінювання зумовлюють іонізацію речовин за рахунок безпосереднього контакту з атомами з віддачею їм значної частки енергії. Випромінювання без електричного заряду (γ-, нейтронне, рентгенівське)під час
зштовхування передають свою енергію речовині – ядру, електронам, збудження яких призводить до іонізації інших атомів. Інтенсивність іонізації оцінюється лінійною щільністю іонізації (ЛЩІ) – кількістю пар іонів, що утворюються на одиницю шляху (1см) на сліді руху частинки. ІВ характеризуються різною проникною властивістю, що поряд зі здатністю д іонізації обумовлюють їх вплив на організм:
α-частки (ядра гелію) здатні до пробігу в повітрі на відстань 20 см, де утворюють 10 000-20 000 пар
•іонів на мм, пробіг в тканинах - до 50 мкм; β-частки (електрони, позитрони) розповсюджуються в повітрі на відстань до 15м, утворюючи 5-10
•пар іонів на 1мм, в тканини проникають на глибину 1 см, утворюючи 5-10 пар іонів на 1 мм; нейтрони – елементарні частки, що не мають електричного заряду ЛЩІ нейтронів до 3000, їх пробіг в повітрі дорівнює кілометрам, а проникна спроможність у тканинах - метрам. При взаємодії
•нейтронів з речовиною відбувається їх розсіювання або виникають ядерні реакції γ-кванти (електромагнітні хвилі довжиною від 0.1 до 0.001 нм) в повітрі долають сотні метрів,
•утворюючи 1 пару іонів на 1мм, а в живу тканину проникають на десятки сантиметрів. рентгенівське випромінювання - сукупність гальмівного і характеристичного випромінювань,
•діапазон енергії яких дорівнює 1кеВ - 1МеВ.

Основні характеристики радіоактивних перетворень
Розпад РР підкоряється закономірностям, найбільш суттєвою з яких є те, що РР розпадаються не одночасно, в одиницю часу розпадається лише певна їх частка. Проміжок часу, на протязі якого розпадеться половина атомів певної РР, називається періодом напіврозпаду (Т 1/2). З урахуванням цього показника розрізняють короткоіснуючі ізотопи, Т1/2 яких складає від секунд до діб, та довгоіснуючі з Т1/2 від місяців до мільярдів років. В разі інкорпорації поряд з
процесами фізичного розпаду відбувається зменшення активності за рахунок біологічних процесів, яке визначається біологічнимперіодом напіввиведення (часу, за який з організму виводиться половина радіонуклідів). Цей період, на відміну від періоду напіврозпаду, є величиною непостійною і залежить від органу, тканини, раціону харчування, віку людини та ін.
Найважливішою характеристикою РР є її активність – число перетворень за одиницю часу. Сучасною одиницею активності є бекерель (Бк), що відповідає одному ядерному перетворенню на секунду. Позасистемною одиницею активності є кюрі (Кі). 1Бк=2.710- 11Кі. Важливо пам’ятати, що маса препарату не може визначати його радіоактивність. Для визначення кількості (концентрації) РР в одиниці маси, об’єму або площини визначається питома активність (наприклад, в овочах – Бк/кг, у молоці, повітрі – Бк/л, на будь-якій поверхні – Бк/м2).
Чим повільніше відбувається розпад РР, тим більша його маса, що має певну величину активності.
Методи визначення радіоактивності
Існує кілька методів визначення радіоактивності, серед яких виділяють:
Іонізаційний, що оснований на вимірюванні безпосереднього ефекту взаємодії
1.випромінювання з речовиною.
Сцинтиляційний – полягає в вимірюванні інтенсивності світлових сполохів, що
2.виникають в люмінесцентних речовинах при проходженні через них заряджених часток.
Фотографічний – полягає в змінах фотоемульсії під впливом іонізуючого
3.випромінювання
Калориметричний – базується на вимірюванні кількості тепла, що виділяється в
4.детекторі при поглинанні енергії ІВ.
Хімічний, що оснований на вимірюванні виходу радіаційно-хімічних реакцій, які мають
5.перебіг під впливом ІВ в рідинах або твердих хімічних системах.
6.Нейтронно-активаційний- базується на процесі пружного розсіювання нейтронів. Розрахунковий. При ньому дозу опромінення визначають з використанням
7.математичних обчислень.
8.Біологічний являє собою сукупність трьох методів реєстрації:
o виживання живих об’єктів;
o морфологічних та біохімічних змін в тканинах;
o грубої оцінки ступеня променевих уражень (епіляційна доза, еритемна доза тощо).
При радіаційних аваріях можливості фізичної дозиметрії  обмежені внаслідок нерівномірності опромінення, переважанням локальних уражень. В цих випадках використовуються знання з біологічної дозиметрії.
обмежені внаслідок нерівномірності опромінення, переважанням локальних уражень. В цих випадках використовуються знання з біологічної дозиметрії.
Navigation: Глава 1. Фізика випромінювань > Іонізуючі випромінювання >
Біологічна дозиметрія
Біологічні маркери радіаційного ураження – це зміни в біологічних системах внаслідок впливу ІВ. Вони можуть бути кількісно виміряні.
Виділяють біомаркери опромінення, дози, чутливості та хвороби.
Ідентифіковані такі біологічні маркери ІВ:
•клініка ГПХ,
•цитогенетичні зміни в лімфоцитах периферичної крові,
•гематологічні порушення,
•біохімічні маркери,
•ERS-спектроскопія біологічних проб,
•цитогенетичні та фізіологічні зміни шкіри.
Існує велика кількість біологічних маркерів із стійкою залежністю доза-ефект, але індивідуальна вариабельність і залежність від нерадіаційних факторів, супутньої патології дозволяють розглядати лише деякі з них як біологічні дозиметри. Цитогенетичні зміни в лімфоцитах периферичної крові людини та електронна спінова резонансна (electron spin resonance/ ERS) є єдиними достовірними методами біодозиметрії (БД).
Проведення БД ускладнене внаслідок гетерогенності опромінення. Методи біологічної дозиметрії на відміну від фізичної дозиметрії не можуть бути використані для оцінки доз менших за 0.1 Гр. Незабаром після радіаційної аварії використовуються методи БД, що основані на вимірюванні частоти нестабільних хромосомних аберацій (дицентриків та центричних кілець), порівняння яких із стандартної кривою доза-ефект, отриманою in vitro, дозволяє визначити дозу опромінення.
Біологічна дозиметрія з використанням хромосомних
аберацій лімфоцитів запропонована в 1962 р. M.A.Bender і P.C.Gooch, які виявили достатні кореляції між частотою дицентриків та поглиненою дозою опромінення. Радіаційні ефекти в лімфоцитах, опромінених in vivo і in vitro, однакові, для визначення дози використовуються калібровочні криві, побудовані після опромінення in vitro зразків крові відомими дозами. Фонова частота дицентриків в неопроміненій крові становить 510-4-410-3 (1-2 на 2000 клітин). Ця частота підвищується із зростанням дози в лінійноквадратичній залежності для випромінювань з низькою ЛПЕ та в лінійній – для нейтронів та випромінювань з високою ЛПН. З використанням лінійно-квадратичної моделі залежності цитогенетичного ефекту від дози опромінення можлива точність БД до 15-30% в діапазоні від 0.15 до 4.0 Гр. Достовірні результати визначаються лише при проведенні аналізу аберацій в метафазах першого мітозу.
БД з використанням частоти аберації клітин кісткового мозку можлива в діапазоні доз від 0.3 до 5.0 Гр, але також не пізніше 96 годин, після яких закінчується елімінація аберантних клітин з проліферуючого пулу внаслідок їх репродуктивної загибелі.
Для ретроспективної дозиметрії, що здійснюється через тривалий час після опромінення, доцільне використання методів, що враховують лише стабільні радіаційні ураження біомаркера. Таким методом є аналіз стабільних аберацій (транслокацій), частота яких постійна на протязі великих періодів часу після опромінення. Вірогідність виходу стабільних (транслокації) та нестабільних (дицентрики) хромосомних аберацій після опромінення однакова, але транслокації не підпадають відбору при проліферації
клітин. Метод флуоресцентної гібридизації in situ (fluorescence in situ hybridization/FISH) може використовуватись на протязі кількох десятиріч після опромінення.
Ретроспективна дозиметрія для визначення радіаційних уражень, акумульованих в тканинах кісток, зубів, волоссі, нігтях, використовує електронний парамагнітний резонанс /ЕПР (ESR).
Границя визначення дози за допомогою методів FISH та ESR становить біля 0.1 Гр.
Цитогенетичні методи дослідження лімфоцитів периферичної крові використовуються для біологічного визначення поглиненою дози випромінювання. До цих методів належать: аналіз хромосомних аберацій для нестабільних аберацій (дицентрики та кільця), мікро ядерний тест в цитокінезі блокованих лімфоцитів, передчасна концентрація хромосом та тест на транслокації методом FISH
Дозиметрична інформація може бути отримана при використанні комбінації методів. Таблиця*

Біологічні маркери/дозиметри радіаційного ураження в різних умовах опромінення
Опромінення всього |
|
Локальне опромінення |
|
Хронічне опромінення |
|
тіла |
|
|
|
|
|
Клінічна картина |
|
Аналіз хромосомних |
|
Тест на транслокації |
|
|
|
|
|||
Час виникнення та |
|
аберацій (дицентриків) |
|
Тест на стабільні |
|
вираженість симптомів |
|
разом з аналізом дисперсії. |
|
хромосомні аберації |
|
променевої хвороби. Має |
|
Може бути визначена доза |
|
методом флуоресцентної |
|
значення при сортуванні |
|
опромінення частини тіла |
|
гібридизації in situ за |
|
постраждалих |
|
|
|
допомогою специфічних |
|
|
|
|
|
хромосомних зондів |
|
|
|
|
|
|
|
|
|
|
|
|
|
Гематологічні маркери |
|
Маркери ураження шкіри |
|
ESR – дозиметрія, що |
|
а) кількість лімфоцитів |
|
а) транзиторна еритема |
|
базується на аналізі |
|
через 48-72 години після |
|
б) епіляція |
|
стійких СО3—радикалів в |
|
опромінення (100-500 в 1 |
|
в) стійка еритема (3-4 |
|
емалі зуба є біологічним |
|
мм3 відповідає вкрай |
|
тижні) |
|
дозиметром як при |
|
несприятливому прогнозу; |
|
г) зменшення товщини |
|
гострому аварійному |
|
<100 в 1 мм3 – прогноз |
|
волосся |
|
опроміненні, так і при |
|
фатальний; |
|
д) цитогенетичні ураження |
|
хронічному опроміненні. |
|
б) кінетика зменшення |
|
в фолікулярних клітинах |
|
Опромінення в минулому |
|
кількості нейтрофільних |
|
є) опіки шкіри (великі дози) |
|
у тих, хто вижив після |
|
гранулоцитів: чим раніше |
|
|
|
атомного бомбардування, |
|
вона зменшиться до 500 в |
|
|
|
також може бути оцінене |
|
1мм3, тим гірший прогноз. |
|
|
|
за допомогою ESR |
|
|
|
|
|
|
|
|
|
|
|
|
|
Цитогенетичний аналіз |
|
Репродуктивна система |
|
Аналіз хромосомних |
|
Хромосомні аберації: |
|
а) розподіл клітин сперми |
|
аберацій з відповідними |
|
· аналіз дицентриків; |
|
на різних стадіях |
|
поправками на їх |
|
· мікроядерний тест; |
|
сперматогенезу за |
|
елімінацію може |
|
· передчасна конденсація |
|
допомогою проточної |
|
забезпечити приблизну |
|
хромосом для оцінки |
|
цитометрії (інвазивно) |
|
індикацію поглиненої |
|
кількості розривів; |
|
б) зменшення кількості |
|
дози. Цей метод має |
|
· тест на транслокації |
|
сперми на 60-й день після |
|
тенденцію до недооцінки |
|
методом забарвлення |
|
опромінення (олігоспермія / |
|
дози та в значному |
|
хромосом |
|
аспермія) |
|
ступені залежить від |
|
|
|
|
|
міжіндивідуальних |
|
|
|
|
|
варіацій |
|
|
|
|
|
|
|
Біохімічні маркери |
|
Опромінення голови |
|
Мутація в локусі |
|
а) значення величини |
|
Зміни патерна ЕЕГ |
|
глікофорина А |
|
креатин/ креатинін в сечі |
|
Ефект може спостерігатися |
|
призводить до |
|
підвищується в залежності |
|
при доза опромінення |
|
дозозалежної модифікації |
|
від дози опромінення; |
|
більших за 0.25 Гр |
|
протеїнів мембрани |
|
б) екскреція амінокислот |
|
внаслідок змін електричної |
|
еритроцитів. Це може |
|
типу в-аміноізомасляної |
|
активності головного мозку |
|
бути виявлено за |
|
кислоти |
|
|
|
допомогою |
|
|
|
|
|
флуоресцентних антитіл |
|
|
|
|
|
|
|
ESR- |
|
Ураження клітин |
|
при використанні |
|
спектроскопіякісткової |
|
кісткового мозку в |
|
проточної цитометрії |
|
тканини та емалі зуба |
|
пробах, що отримані з |
|
|
|
|
|
різних ділянок тіла |
|
|
|
|
|
|
|
|
|
* Наводиться за: В.Г.Бебешко, Д.А.Базыка, К.Н.Логановский (2004)
Іонізація, коли відбувається передача енергії ІВ до опроміненого об’єкта, є початковим етапом численних процесів, що виникають в біологічному середовищі.
Navigation: Глава 2. Біологічні ефекти опромінювання >
Механізм ураження ІВ: пряма та непряма дія
Біологічні ефекти опромінення (БЕО) – метаболічні, анатомічні та функціональні розлади, обумовлені змінами на молекулярному та клітинному рівнях, а також на рівні органу та організму в результаті опромінення.

БЕО обумовлені багатьма факторами, в т.ч. рівнем проникної та іонізуючої здатності випромінювань. Згідно лінійній безпороговій моделі впливу на організм ІВ будь-яка мала доза опромінювання небезпечна для організму.
Взаємодія іонізуючого випромінювання з організмом відбувається за законами фізики. Збудження та іонізація молекул, що мають місце при дії ІВ на організм, розглядаються як фізична стадія процесу (10-15-10-13 с), наслідком якої є фізико-хімічна стадія, коли проходить перерозподіл надлишку енергії та утворення активних продуктів з коротким строком життя – іонів та радикалів (10-13-10-11с). Взаємодія іонів та радикалів між собою та з оточуючими молекулами з формуванням продуктів радіолізу – суть хімічної стадії (10-11-10-6 с), коли змінюється перебіг біологічних реакцій і визначається тяжкість пошкоджень.
Результатом іонізації води, вміст якої в біологічних тканинах становить 60-70%, є утворення вільних радикалів (Н+, ОН-, Н202), що є потужними окислювачами.
Пряма дія ІВ, таким чином, полягає в іонізації та збудженні молекул тканин та органів з розривом молекулярних зв’язків та утворенням вільних радикалів (водних та органічних). Вільні радикали та окислювачі внаслідок високої хімічної активності змінюють молекули білку, ферментів та інших структурних елементів, деформують процеси обміну речовин, пригнічують активність ферментативних систем. Виникають нові хімічні сполуки, що не властиві організму – токсини, що і обумовлюють так звану непряму дію ІВ. Вона полягає в окисленні вільними радикалами молекул, що енергію безпосередньо не поглинали.
В розвитку інтоксикації при променевій хворобі певну роль відіграють аутотоксини – ендогенні речовини (протеїни середньої молекулярної маси, гістаміноподібні речовини, гормони катаболічного ряду та ін.) та антитіла до них (Федорич О.В.,1998) В разі інкорпорації РР променеве ураження може розглядатися як радіаційний ендотоксикоз, що супроводжується порушенням процесів вільнорадикального окислення, накопичення «первинних» та «вторинних» радіотоксинів, зниженням імунітету та функцій природних органів детоксикації, ступінь яких визначається кількістю та тривалістю присутності радіонуклідів в організмі.
Вивчені та описані зміни, що виникають на макромолекулярному рівні (ушкодження нуклеїнових кислот, ферментів), які певним чином впливають на стан клітини та клітинної популяції. На рівні клітинних популяцій процеси, обумовлені опроміненням, залежать від відносної величини пула стовбурових клітин, радіочутливості клітин, клітинної проліферації та швидкості утилізації зрілих елементів.
В опроміненій клітині в залежності від того, в який період її життєвого циклу відбулося опромінювання, можна спостерігати затримку поділу, пригнічення синтезу ДНК, ушкодження мембран. Променеві реакції в вигляді порушень метаболізму, тимчасового пригнічення клітинного поділу, що розвиваються зразу після опромінення, вважаються фізіологічними і легко компенсуються клітинами. Летальний ефект опромінювання (клітинна загибель) – втрата клітиною здатності до проліферації, при цьому втрата клітиною функцій або життєздатності необов’язкова. Середня доза, необхідна для порушення репродуктивної здатності, як правило, значно менша за ту, що викликає розлад Хромосомні аберації (фрагментація хромосом, формування дицентриків, кільцевих хромосом, поява внутрішньо – та між хромосомних обмінів) – головна причина репродуктивної загибелі клітини. метаболізму або функціональної активності клітини.
******** Здесь –схема повреждающего действия радиации************
Існує теорія так званого радіаційного гормезису, згідно з якою можлива інверсна біологічна реакція організму на малі дози опромінення. Дози до 0.5 Гр, помилково віднесені до „малих", нібито здатні викликати не лише запобіжний ефект відносно подальшого опромінення більш значними дозами, але обумовлює стимулюючий вплив на деякі функції організму, зменшують можливості виникнення деяких пухлин, збільшують тривалість життя.
Navigation: Глава 2. Біологічні ефекти опромінювання >
Радіочутливість тканин

Критичний орган – орган, тканина або все тіло, опромінення яких в певних умовах спричиняє найбільшу шкоду здоров'ю опроміненого або його нащадків.
З урахуванням зменшення радіочутливості гранично допустимі дози визначаються для 3 груп критичних органів:
1.все тіло, гонади и червоний кістковий мозок;
2.щитовидна залоза, м'язи, печінка, жирова тканина, нирки, легені, кришталик;
3.кісткова тканина, шкіра.
При зовнішньому опроміненні чутливість різних тканин до опромінення (радіочутливість) значно відрізняється. І. Бергоньє та Л.Трибендо (1906) визначили, що існує прямо пропорційна залежність між радіочутливістю (РЧ) та проліферативною активністю тканин та зворотна залежність від ступеню їх диференційованості. РЧ організму визначається РЧ тканин, органів та систем, але не може розглядатися як їхня сума. Таким чином найбільша РЧ характерна для кісткового мозку, найменша – для клітин нервової системи. Червоний кістковий мозок та інші елементи кровотворної системи втрачають здатність нормально функціонувати при дозі 1 Гр, але якщо не відбудеться тотального ураження всіх клітин, то можливе поступове відновлення кровотворення. Опромінення яєчок в дозі 0,1 Гр викликає тимчасову, а в дозі 2Гр – стійку стерильність у чоловіків. Однократне опромінення яєчників жінки в дозі 3 Гр також приводить до її стерильності. Радіочутливим органом травної системи є тонкий кишечник за рахунок значної чутливості стовбурових клітин кишкового епітелію З клітин, що не діляться, дуже чутливими є лімфоцити, що масово гинуть в перші години після опромінення. Це пов’язане з змінами в структурі і функціях біологічних мембран, активності ферментів, що регулюють обмін речовин. Так вплив радіації порушує ефективність системи контролю над активністю ферментів, що обумовлює розпад ДНК (внаслідок дії нуклеази ) та загибель клітини.
Посилення функції тканини чи органа обумовлює підвищення радіочутливості (напр., в період лактації зростає радіочутливість молочної залози). Ефект від ушкодження ІВ підвищується за умови зростання інтенсивності обмінних процесів в організмі, при зниженні обміну радіорезистентність підвищується.
Для радіоактивних нуклідів, що інкорпоровані, критичними органами є ті, в яких вони вибірково накопичуються. Таким чином, критичним органом для стронцію є кістки, для вуглецю - жирова тканина, для йоду – щитовидна залоза. В цьому випадку опромінення критичних органів відбувається безперервно на протязі ефективного періоду виведення
РР
Відомий також так званий „кисневий ефект", який полягає в тому, що біологічні наслідки променевої дії зменшуються при зниженні парціального тиску кисню і, навпаки
– біологічний ефект опромінення тим більший, чим інтенсивніше кровопостачання тканини і надходження кисню внаслідок цього.
Відомі механізми можливого захисту від зовнішнього опромінення:
•захист часом,
•екраном,
•відстанню,
•активністю.
Особливості внутрішнього опромінення |
Top Previous Next |
|
Як уже згадувалось, в залежності від локалізації джерела випромінювання опромінення може бути зовнішнім або внутрішнім. Внутрішнє опромінення є результатом інкорпорації РР, тобто надходження їх усередину організму:
•інгаляційним шляхом,
•через рот,
•через ушкоджені покрови.

Приблизно 2/3 ефективної еквівалентної дози опромінення від природних джерел обумовлені інкорпорованІ РР.
В певних ситуаціях (проживання на забрудненій радіонуклідами території) має місце сполучений вплив зовнішнього та внутрішнього опромінення. В цьому випадку переважною є дія зовнішнього чинника, але треба зважати на те, що внутрішнє опромінення може бути тривалим, в той час як пряма дія зовнішніх джерел випромінювання на організм припиняється, якщо людина виходить з зони радіоактивного забруднення.
Внутрішнє опромінення (ВО) має свої особливості. Інкорпоровані радіонукліди можуть
швидко та рівномірно розподілятися в організмі (3Н, 24Na, 137 Сs). Інші радіонукліди депонуються вибірково (226 Ra, 89Sr, 90Sr, 210 Ро, 137І та ін.). При однаковій кількості
радіонуклідів ВО в багато разів небезпечніше, ніж зовнішнє в зв’язку з відсутністю механізмів захисту. При ВО найбільша небезпека ураження характерна для α- джерел,
потім – β і γ-джерел, тобто в зворотній в порівнянні з зовнішнім опромінюванням послідовності. β- частки уражають слизові оболонки, що обумовлює набагато слабкіший
захист внутрішніх органів в порівнянні з шкірою, де ефекти β- опромінення
розглядаються як вкрай незначні. Найбільшу небезпеку становлять ізотопи йоду, цезію, стронцію, плутонію, барію, плутонію, молібдену, телуру та ін.
ВО обтяжує перебіг радіаційних уражень.
Клінічний перебіг променевих уражень внаслідок інкорпорації РР визначається
•дозою, що обумовлена інкорпорованими РР;
•розчинністю РР та їх здатністю до всмоктування;
•шляхами надходження до організму;
•швидкістю розпаду та виведення з організму.
Легкий ступінь гострої променевої хвороби може розвитися в разі інкорпорації 15-60 мКі РР.
Navigation: Глава 2. Біологічні ефекти опромінювання >
Стохастичні ефекти
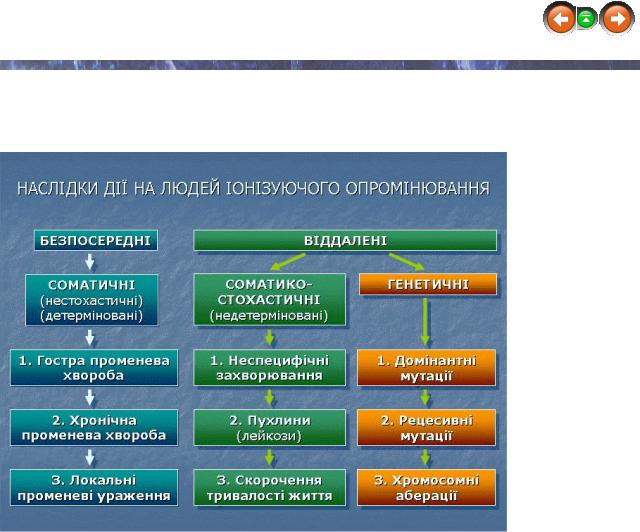
Наслідками впливу ІВ можуть бути соматичні, соматико-стохастичні та генетичні ефекти.
Радіаційний ефект називають соматичним, якщо від спостерігається безпосередньо у опроміненої особи. Соматичний ефект може бути стохастичним(випадковим, ймовірним) та нестохастичним (обов’язковим, детерміністичними).
Стохастичний ефект – безпороговий ефект радіаційного впливу, ймовірність якого існує за будь-яких доз ІВ і зростає із збільшенням дози, тоді як відносна важкість їх проявів від дози опромінення не залежить. До цих ефектів належать соматичні стохастичні ефекти (лейкоз, новоутворення, що виникають через роки після опромінення, скорочення тривалості життя) та генетичні зміни, що проявляються у нащадків опроміненого (домінантні і рецесивні генні мутації та хромосомні аберації),
тобто стохастичні ефекти – віддалені наслідки опромінення.
Стохастичні ефекти можуть бути визначені розрахунковими методами при вивченні стану здоров’я та доз опромінення в великих статистичних вибірках на протязі тривалого часу. Теоретично причиною такого ефекту може бути ураження лише однієї клітини в організмі. Утворення клонів клітин, що з’явилися в результаті відтворення зміненої, але живої клітини, може відбутися після латентного періоду різної тривалості і сприяти утворенню злоякісної пухлини.
Вважають, що вірогідність виникнення променевого соматичного канцерогенезу зростає з зростанням дози, можливо, без граничної величини, нижче якої вірогідність дорівнює нулю. Тобто процес, що обумовлює виникнення пухлини, може початися за будь якої дози, якою б малою вона не була. При цьому вірогідність захворювання пропорційна
отриманій дозі. (Модель лінійної залежності „доза-ефект" без граничного значення величини дози).
Скорочення тривалості життя при променевому старінні спричинена передчасністю всіх розладів, які спостерігаються при природному старінні неопромінених людей. Крім накопичення „помилок" в коді молекули ДНК, що виникають внаслідок опромінення, радіаційне старіння обумовлене накопиченням продуктів обміну, спотвореного впливом ІВ, в т.ч. - радіотоксинів. Ці низькомолекулярні біологічно активні речовини мають сильну окислювальну здатність і спричиняють перекисне окислення ліпідів. Активні вільні радикали за рахунок великої реактивності обумовлюють неферментативне окиснення, в т.ч. ліпідів. При цьому ліпідна пероксидація проявляється порушенням мембран та ферментативних систем. Прискорене радіаційне старіння проявляється змінами в енергетиці клітини, зменшенням кількості мітохондрій і активності дихальних ферментів, порушенням співвідношення окисного фосфорилювання і гліколізу та інше.
Генетичні зміни обумовлені домінантними та рецесивними генними мутаціями та хромосомними абераціями. Відомі 2 категорії аберацій хромосомного типу: нестабільні (ацентрики, дицентрики, центричні кільця) та стабільні (симетричні хромосомні транслокації, інверсії, вставки, делеції хромосом).
Кластогенні фактори – (КЛФ) субстанції, що ушкоджують хромосоми. До цих субстанцій, серед іншого, входять прооксиданти. КЛФ ініціюються різними факторами, серед яких – опромінення. Вони виявлені в плазмі крові у осіб, що піддавалися випадковому впливу ІВ, отримували радіотерапію, постраждали при атомних бомбардування та при ліквідації наслідків атомних аварій. Наявність КЛФ – підвищений фактор ризику пізніх ефектів опромінення. Не тільки пухлини, але й інші хвороби можуть бути наслідками оксидативного стресу, оскільки існує вірогідність ушкодження ДНК радикалами оксигенних дериватів.
Navigation: Глава 2. Біологічні ефекти опромінювання >
Нестохастичні ефекти
Неминучим результатом дії великих доз радіації є нестохастичні ефекти (обов’язкові), важкість яких обумовлена (детермінована) величиною отриманої дози. До цих ефектів належать гостра променева хвороба, хронічна променева хвороба та локальні променеві ураження.
