
- •Предисловие.
- •1 Модуль, общая, неорганическая и физическая химия.
- •Тема 1. Способы выражения концентрации раствора.
- •Тема 2. Термодинамика.
- •Тема 3. Химическое равновесие.
- •Тема 4. Осмос.
- •Тема 5. Поверхностное натяжение, пав, пнв, пив и адсорбция.
- •Тема 6. Химическая кинетика.
- •Тема 7. Электролиты. РН.
- •Тема 8. Буферные растворы.
- •Тема 9. Комплексные и малорастворимые соединения…
- •Тема 10. Потенциал, эдс.
- •Тема 11. Ультрамикрогетерогенные системы. Мицеллы.
- •2 Модуль, Органика
- •Тема 1. Номенклатура.
- •Тема 2. Электронное строение.
- •Тема 3. Реакции sr, ae, se.
- •Тема 4. Реакции sn. Свойства соединений с σ – связью…
- •Тема 5. Реакции альдегидов, кетонов, карбоновых кислот и их производных.
Тема 4. Осмос.
Введение. Очень легкая тема. Расчеты строятся на формуле сосм=i·c, где сосм – осмолярность,c– молярная концентрация, аi– изотонический коэффициент Вант-Гоффа, собственно самая соль этой темы.iравен количеству ионов, на которые распадается электролит при диссоциации. Например, дляNaCli=2, дляCaCl2 i=3 (кальций и два иона хлора), дляNa2SO4 тожеi=3, дляK3PO4i=4. Для слабых электролитов (HNO2,CH3COOH)iявляется дробным числом больше одного но меньше 2, приблизительно 1,3. Для неэлектролитов (С6Н12О6, сахароза, мочевина (NH2)2CO)i=1. Чем больше с иi, тем больше осмолярность. Осмотическое давление рассчитывается π=сосмRT, где π – осмотическое давление, кПа,R=8,31, Т = температура в градусах Кельвина.
Типичные вопросы:
Верные-неверные утверждения
Пример:

Очередная угадайка.
Как с этим бороться:
Никак. Как всегда никак. По примеру: А-верно, если прочитать введение, следующий вопрос и подумать, то можно догадаться почему, В-верно, часто это вижу, и таки да, чем больше степень дисперсности, тем больше осмотическое давление. Аналогично еще попадаются гидролизующийся белок, там с течением времени осмотическое давление возрастает и полимеризующаяся какая то фигня, там наоборот, осмотическое давление падает. С-неверно, такие размеры у ультрамикрогетерогенных систем, микрогетерогенные 10-4– 10-5.D-неверно, в изотоническом растворе эритроциты сохраняют форму и размер. В гипотоническом они набухают (лизис), в гипертоническом сморщиваются (плазмолиз). Зато все остальное – элементарно.
Изо-, гипо- и гипертонические растворы.
Пример:
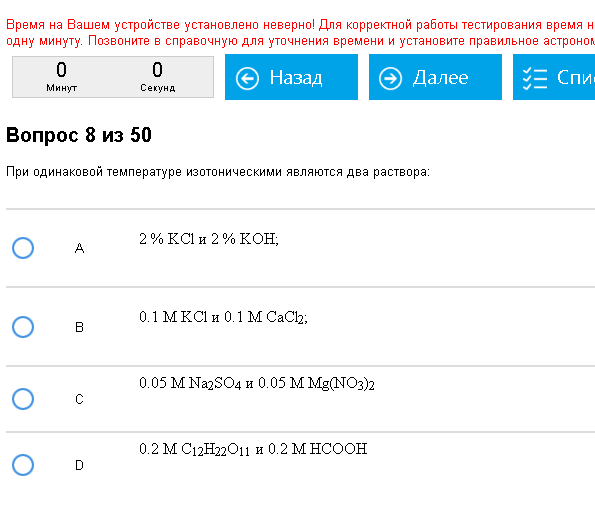
Верно – С. 0,05*3=0,05*3.
Как с этим бороться:
Изотонические растворы – растворы с одинаковой осмолярностью. Если у одного раствора давление больше то он гипертонический, а у другого раствора меньше и он гипотонический. В основном стоит задача найти пару изотонических растворов. Лихо определяем коэффициенты iдля приведенных веществ, перемножаем их на данные концентрации (цифры там обычно такие, что все это можно и в уме сделать), получаем осмолярности, сравниваем, находим два одинаковых – ура-ура.
Изменение осмотического давления (осмолярности) в ряду.
Пример:

Коэффициенты i по веществам равны 1, 2 и3, ряд осмолярностей получается 0,2*1<0,2*2<0,2*3, возрастает.
Как с этим бороться:
Полный аналог предыдущего по способу решения, чуть иная форма. Определяем коэффициенты i, перемножаем их на концентрации и смотрим, как меняется осмолярность в полученном ряду.
Пока неизвестный науке тип вопроса.
Пример:
?
нету.
Как с этим бороться:
Пока неизвестно.
Тема 5. Поверхностное натяжение, пав, пнв, пив и адсорбция.
Введение. Опять какая-то зловещая муть, плохо поддающаяся систематизации.
Типичные вопросы:
Выбрать ПАВ (ПНВ, ПИВ) из списка веществ.
Пример:

Из представленного ПАВ будет гексановая кислота и бутиламин, ПНВ-глицерин, ПИВ-гидроксид калия, он то и нужен.
Как с этим бороться:
ПАВ – понижают поверхностное натяжение с ростом концентрации, ПНВ – не влияют, ПИВ - увеличивают. К ПАВ относятся органические вещества, содержащие гидрофильную и гидрофобную части (это где то в другом месте еще было нужно) – то есть органические вещества, состоящие из радикала (метил, этил, пропил, …) и полярной группы – амин, спирт, кислота, и т. д. Еще ПАВ – желчь и фосфолипиды. К ПНВ относятся органические вещества с только полярными группами – глицерин, углеводы (сахароза, глюкоза). К ПИВ относятся неорганические электролиты, хлориды натирев и калиев всяких. И т.д.
Адсорбция (возможно, σ) ПАВ по величине радикала.
Пример:
Сорян, забыл заскринить.
Как с этим бороться:
Пример проявления правила Дюкло-Траубе. С ростом радикала поверхностная активность повышается, поверхностное натяжение понижается, а адсорбция этих ПАВ усиливается. Такие дела. На всякий случай, радикалы в порядке возрастания: метил, этил, пропил, бутил, пентил, гексил, гептил, октил, нонил, децил.
Адсорбция, влияние Р, Т и с.
Пример:

.
Как с этим бороться:
Нужно иметь в виду, что на адсорбцию влияют:
При ↑Т адсорбция уменьшается, а с ↓Т, естественно, увеличивается.
При ↑Р адсорбция повышается, а с ↓Р - уменьшается.
При ↑с адсорбция повышается до определенного значения, а с ↓с - понижается.
На величину предельной адсорбции не влияет только масса адсорбента.
Полярное-неполярное, адсорбция.
Пример:
?
Видел один раз, подумал, что не так важно.
Как с этим бороться:
Скажу как есть, потому что вариант такого вопроса видел только один. На неполярном адсорбенте лучше всего адсорбируются неполярные адсорбаты из полярной среды, ну и наоборот, на полярном лучше всего адсорбируется полярное из неполярного.
Пока неизвестный науке тип вопроса.
Пример:
?
нету.
Как с этим бороться:
Пока неизвестно
