
- •Предисловие.
- •1 Модуль, общая, неорганическая и физическая химия.
- •Тема 1. Способы выражения концентрации раствора.
- •Тема 2. Термодинамика.
- •Тема 3. Химическое равновесие.
- •Тема 4. Осмос.
- •Тема 5. Поверхностное натяжение, пав, пнв, пив и адсорбция.
- •Тема 6. Химическая кинетика.
- •Тема 7. Электролиты. РН.
- •Тема 8. Буферные растворы.
- •Тема 9. Комплексные и малорастворимые соединения…
- •Тема 10. Потенциал, эдс.
- •Тема 11. Ультрамикрогетерогенные системы. Мицеллы.
- •2 Модуль, Органика
- •Тема 1. Номенклатура.
- •Тема 2. Электронное строение.
- •Тема 3. Реакции sr, ae, se.
- •Тема 4. Реакции sn. Свойства соединений с σ – связью…
- •Тема 5. Реакции альдегидов, кетонов, карбоновых кислот и их производных.
Тема 8. Буферные растворы.
Введение. Средней запутанности тема. Буферный раствор – система, сохраняющая рН примерно постоянным при добавлении небольших количеств кислот и щелочей и разбавлении. Достигается это за счет особой, химической магии. Буферный раствор содержит пару веществ: сопряженную-кислоту и сопряженное-основание. Если к буферному раствору добавляют злую сильную кислоту, ее нейтрализует сопряженное-основание, а если к этому же раствору добавляют сильную щелочь, то ее нейтрализует уже сопряженная-кислота. При этом сами сопряженные кислота и основание друг друга не нейтрализуют, они же сопряженные. Подробнее, с примерами – методичка.
Типичные вопросы:
Интервал буферного действия.
Пример:

Просто, очень просто.
Как с этим бороться:
Просто. Интервал буферного действия – это область рН от рКа-1 до рКа+1. То есть если рКа=6, то интервал от 5 до 7. И т. д. Трабл может получиться, если у кислоты несколько рКа. В этом случае находим буферную систему в таблице примеров в голубой методичке, а из формулы справа узнаем, какая константа должна использоваться для расчетов. Например, гидрофосфатная – по рКа2. Фэйл – если такой системы нет в этой таблице.
Частица в буферной системе.
Пример:

Гидрофосфат коварен.
Как с этим бороться:
Вопрос относится к предыдущей теме про электролиты. Если частица способна отдавать Н+, то кислота, принимать – основание. Вот и гадайте на примере НРО4. Отдать способен, ведь есть же РО4. И принять способен, потому что Н2РО4тоже существует. Значит, и кислота и основание. Хотя таковое гадание делать просто удается далеко не всегда. Глядя на диполярную форму глицина+NH3CH2COO- сразу и не поймешь, могут ли отрываться вся эта куча водородов и может ли присоединяться еще один лишний. Такие дела.
Какие системы являются буфферными.
Пример:
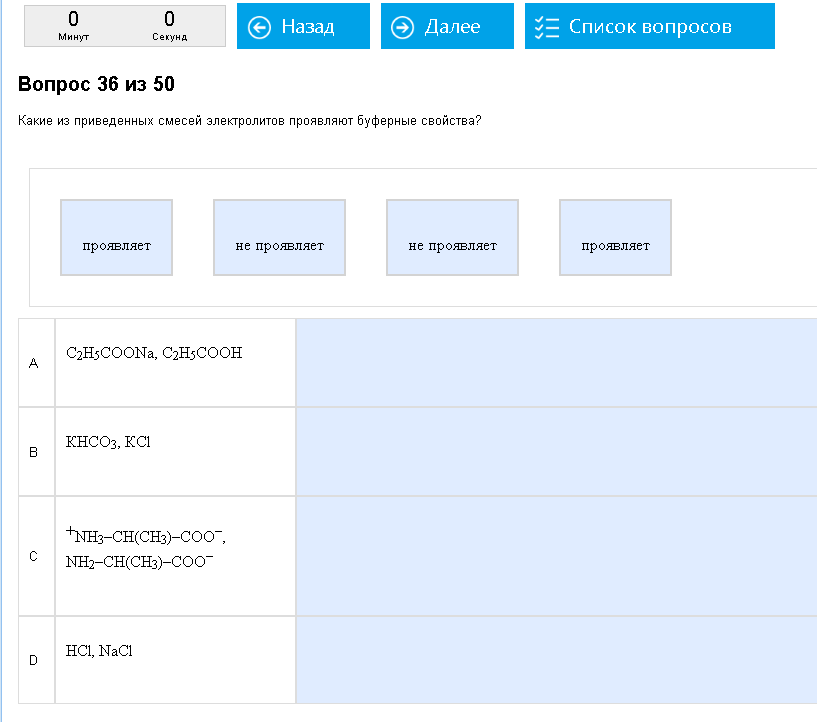
Такие вот примеры.
Как с этим бороться:
Буферными будут системы, состоящими из сопряженной-кислоты и сопряженного-основания. Это пара веществ, отличающимися на 1 Н, у кислоты есть, у основания нету. NH3/NH4,CH3COOH/CH3COO,H2PO4/HPO4, и так далее. Естественно, водород не может отсутствовать просто так, он или чем то замещен, или еще как-то, поэтому можно ожидать что типаCH3COOH/CH3COONaи т.д. Исключения – сильные кислоты. СистемаHCl/NaCl, по внешним признакам похожая на буферную, на самом деле не буферная.
Виды буферных систем.
Пример:

Какая то путанная хрень.
Как с этим бороться:
Слабая кислота – вы должны узнавать ее, если честно изучили предыдущую тему. Слабые основания – тоже, в таком же случае. Амфолиты – это буферные системы на основе аминокислот, это самые большие формулы. Кислая и средняя соль – то что осталось, но! Не перепутайте со слабой кислотой, у кислых солей кислоты многоосновные (Н3РО4, Н2СО3), а под слабыми кислотами обычно дают только одноосновные. (СН3СООН).
Неведомый тип вопроса.
Пример:
?
нету
Как с этим бороться:
Бояться и надеяться на лучшее.
Тема 9. Комплексные и малорастворимые соединения…
Введение. Тема, которую никто никогда толком не понимал, поэтому не буду давать обобщений, перейдем сразу к примерам.
Типичные вопросы:
Концентрация комплексообразователя, устойчивость комплексов, константа устойчивости, константа нестойкости.
Пример:

Какая то
очередная
хуйня
очень
сложное задание.
Как с этим бороться:
Чем больше Куст (константа устойчивости) или чем меньше Кнест, тем:
устойчивее комплекс;
меньше концентрация иона комплексообразователя.
Блин, капец как внимание! Не перепутайте,
что увеличивается, а что уменьшается!!!
Это очень просто сделать. Читайте
внимательно условия мелким шрифтом
написанные, это важно. В примере нужно
расположить комплексы в порядке повышения
устойчивости, а из теории известно, что
чем меньше Кнест, тем устойчивее комплекс.
Значит, комплекс с самой большой Кнест
будет первым и самым неустойчивым, а
дальше в порядке уменьшения Кнест.
Отдельная проблема – сравнение таких
ебанутыхоригинальных цифр.
Сначала сравнивают степени десяток.
Поскольку матан знает мало кто, на всякий
случай напоминаю, что -10 это меньше, чем
-8, но зато +10 больше +8. Если степени
одинаковые, то сравнивают уже числа
перед десяткой.
Виды комплексных соединений.
Пример:
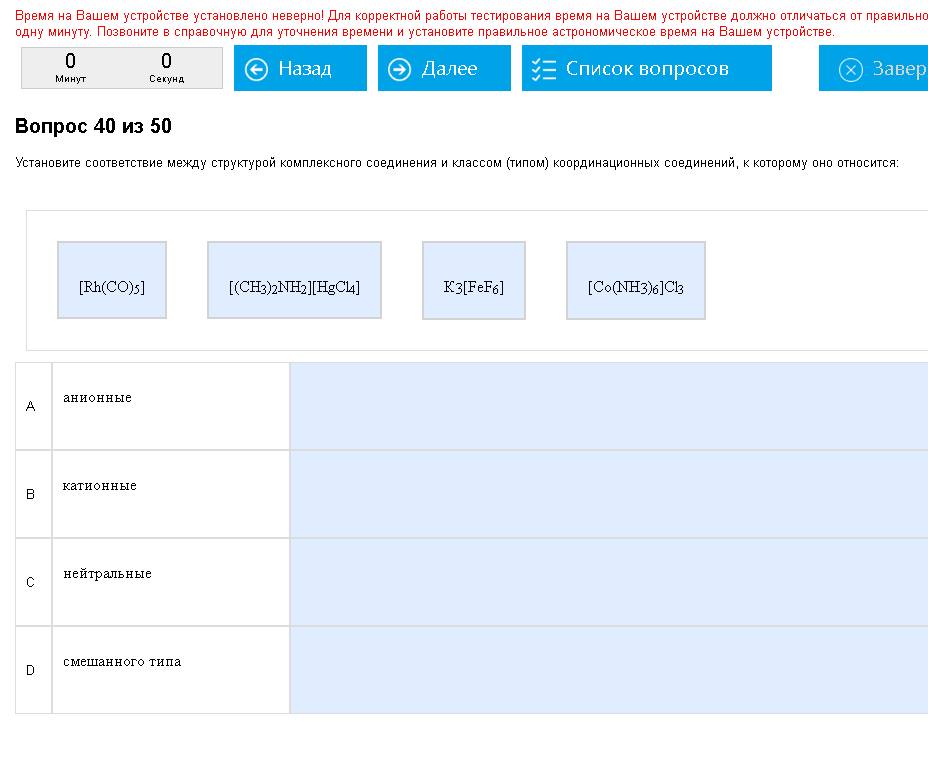
 Блять!
Сколько можно косячить?.
Блять!
Сколько можно косячить?.
Как с этим бороться:
Нейтральные – комплексы не содержащие т.н. внешней сферы, то есть за квадратными скобками ничего нет. Катионные – содержат внешнюю сферу-анион (ОН, Cl..), анионные – содержат внешнюю сферу-катион (К,Na…), смешанные – двое квадратных скобок. Еще попадались аква-комплексы – содержат Н2О уже в квадратных скобках, циано содержатCN-ион, хелатные –en(этилендиамин), амино-комплексы содержатNH3.
Более полное осаждение иона.
Пример:
Пример.
Что то я не заскринил
Как с этим бороться:
Для более полного осаждения надо добавлять второй ион или тот электролит, который его содержит. Например, для более полного осаждения Caиз насыщенного раствораCaSO4 надо было бы добавить что-нибудь, где естьSO4,H2SO4например.
Растворимость малорастворимых веществ при добавлении хорошо растворимых.
Пример:


.
Как с этим бороться:
Если добавляют электролит, содержащий такой же ион, какой есть в малорастворимом веществе, растворимость уменьшается (как в примерах – к насыщенному раствору AgIдобавилиAgNO3 и т.п.). Если ионы разные – растворимость практически не изменяется.
Неизвестный тип вопроса.
Пример:
?
нет.
Как с этим бороться:
Пока непонятно.
