
_2_2_2014_doc
.pdf
114
Процесс окисления этилена до ацетальдегида проводят в присутствии каталитической системы, представляющей собой смесь хлоридов PdII/CuII. В основе процесса лежит стехиометрическая реакция окисления этилена комплексом PdII, которая протекает по следующему механизму:
[PdCl ]-2 + C H |
- Cl- |
[PdCl3(C2H4)]-1 |
+ H2O; - Cl- |
[Pd(H O)Cl (C H )] + H2O |
||||||||
4 |
2 |
4 |
|
|
|
|
|
2 |
2 |
2 |
4 |
(3.50) |
|
|
|
|
|
|
|||||||
|
|
|
CH2 |
H |
|
Æ |
Æ Ì |
|
Ñ |
|
|
|
(H O)Cl Pd |
|
|
CH CH OH]- |
+ H+ |
||||||||
+ |
O |
|
[(H O)Cl Pd |
|
||||||||
|
2 |
2 |
|
2 |
2 |
|
2 |
2 |
|
|
||
|
|
|
CH2 |
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
Pd0 + Cl- + HCl + CH3CHO + H2O |
|||||||
Реакция протекает в водном растворе соляной кислоты. Анионный |
||||||||||||
плоскоквадратный комплекс [PdCl4]- |
последовательно |
обменивает один |
||||||||||
Cl--лиганд |
на |
этилен, а |
второй |
на |
молекулу |
воды. Н2О, |
в отличие от |
|||||
Cl-, не образует дополнительных донорных -связей с орбиталями палладия, делая тем самым этилен более электрофильным (трансвлияние) и, следовательно, более доступным для внешней нуклеофильной атаки молекулой воды из раствора. В результате взаимодействия с водой образуется гидроксиэтильный лиганд. Образовавшийся комплекс обладает сильной ассиметрией жесткости/мягкости, так как мягкий центральный атом окружен жесткими и средне-жесткими лигандами (на схеме 3.50 они обозначены соответствующими начальными буквами), поэтому он быстро распадается по механизму восстановительного элиминирования с восстановлением Pd2+ до Pd0 и окислением гидроксиэтильного лиганда до продукта реакции - ацетальдегида.
В присутствии ионов Cu2+ протекает быстрая окислительновосстановительная реакция, приводящая к регенерации активной формы палладия:
|
Pd0 |
+ 2Cu+2 Pd+2 + 2Cu+ |
(3.51) |
Одновалентные ионы меди в кислой среде, в свою очередь, легко |
|||
окисляются кислородом: |
|
||
2Cu+ |
+ |
0,5O2 + 2H+ H2O + 2Cu2+ |
(3.52) |
Таким образом, можно сказать, что каталитический цикл в данном процессе состоит из последовательности двух некаталитических окислительно-восстановительных реакций, приводящей к образованию ацетальдегида и регенерации исходной формы соединений палладия и меди. Причем, непосредственного взаимодействия этилена с молекулярным кислородом не происходит. Кислород расходуется на окислительную регенерацию катионов Cu2+, а не на прямое окисление этилена до ацетальдегида.
115
3.3.3.ПРИСОЕДИНЕНИЕ ПРОТОНОДОНОРНЫХ ВЕЩЕСТВ К ОЛЕФИНАМ И АЦЕТИЛЕНАМ
Комплексы «мягких» переходных металлов (таких, как Hg(II), Cu(I), Rh(I), Pd(II)) катализируют присоединение протонодонорных веществ (НХ) к олефинам и ацетиленам. Общая схема катализа:
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
LmM + HX |
|
LmM |
|
|
|
|
LmM |
|
|
|
|
|
LmM |
|
|
|
H |
|
LmM + |
|
|
|
|
H |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
X |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
|
|
||||
|
|
|
|
|
X |
|
|
|
|
|
X |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(3.53) |
||||
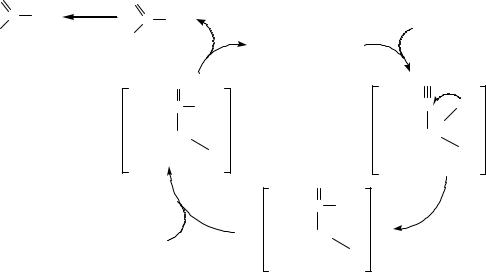
Механизм включает в себя стадию окислительного присоединения реагента НХ, за которым следует координация непредельного соединения в комплекс металла. Далее протекает внедрение непредельного лиганда по связи М-Н. Затем происходит образование продукта и регенерация катализатора по реакции восстановительного элиминирования.
Аналогично протекает реакция и для олефинов. Особенно эффективен катализ комплексами мягких переходных металлов реакции присоединения мягких (слабых) кислот.
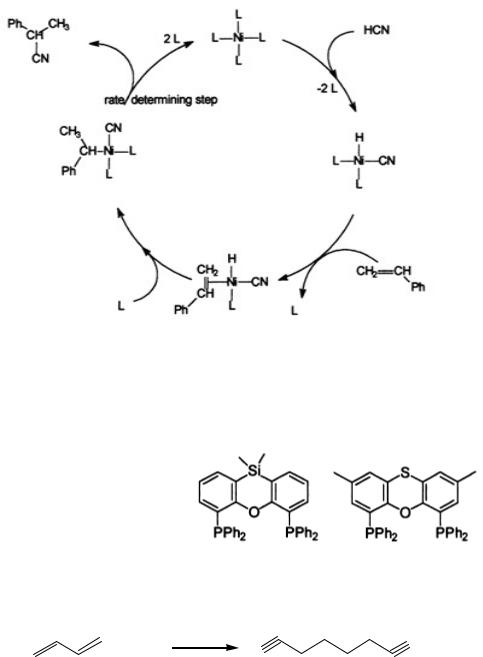
Механизм гидроцианирования олефинов был подробно изучен (McKinney, R. J.; Roe, D. C. “The Mechanism of Nickel-Catalyzed Ethylene Hydrocyanation.
Reductive Elimination by an Associative Process.” J. Am. Chem. Soc., 1986, 108, 5167) на примере присоединения HCN к этилену:
L = |
|
|
O |
||
P
OO

116
Каталитический цикл начинается с 16-электронного трехкоординированного d10 комплекса Ni0, включающего два фосфитных лиганда и этилен. Молекула синильной кислоты по механизму окислительного присоединения входит в координационную сферу комплекса. Далее протекает диссоциация лиганда и комплекс переходит в более устойчивое четырех-координированное состояние. Затем происходит внедрение этилена по связи Ni-H, сопровождающееся координированием еще одной молекулы этилена для обеспечения стабильного плоско-квадратного 16-электронного состояния комплекса. После этого следует присоединение второго фосфитного лиганда, который благодаря своим электроноакцепторным свойствам облегчает последующее восстановительное элиминирование. Стадия восстановительного элиминирования является лимитирующей в этом
механизме. |
|
|
заключается |
в |
облегчении |
Электронное |
влияние |
лигандов |
протекания лимитирующей стадии – восстановительного элиминирования, поэтому фосфитные лиганды делают комплекс более реакционноспособным, чем фосфиновые.
Стерическое влияние бидентантных лигандов в гидроцианировании связано с характеристикой, введенной Толманом – «углом захвата». Бидентантные лиганды с углом захвата, близким к тетраэдрическому, дестабилизируют плоско-квадратную конфигурацию комплекса NiII и обеспечивают по завершению лимитирующей стадии образование наиболее устойчивой тетраэдрической 18-электронной формы комплекса Ni0, тем самым увеличивают выход и/или скорость реакции (W. M. N. van Leeuwen in Homogeneous Catalysis: Understanding an Art., Kluwer Academic Press, Dordrecht, Netherlands, 2004, p.229-237). Пример – гидроцианирование стирола:
117
В данной реакции наибольшую активность обеспечивали лиганды с углом захвата 105-106о (Piet W. N. M. van Leeuwen, Paul C. J. Kamer and Joost N. H.
Reek «The bite angle makes the catalyst», Pure Appl. Chem., Vol. 71, No. 8, pp. 1443-1452, 1999):
Примером промышленного процесса гидроцианирования является получение адиподинитрила:
+ 2HCN |
[L Ni0] |
N |
(3.55) |
|
m |
||||
|
N |
|
||
|
|
|
Этот способ является альтернативой другому - получению адиподинитрила дегидратацией диаммониевой соли адипиновой кислоты.
3.3.4.СИНТЕЗЫ НА ОСНОВЕ ОКИСИ УГЛЕРОДА
Из реакций окиси углерода, катализируемых гомогенными комплексами переходных металлов, промышленное значение имеют: карбонилирование метанола, карбоксилирование ацетилена и олефинов и гидроформилирование олефинов.
3.3.4.1. Карбонилирование метанола с получением уксусной кислоты
118
Реакция карбонилирования метанола протекает по следующему
суммарному уравнению: |
|
CH3OH + CO CH3COOH |
(3.56) |
Промышленным катализатором данной реакции служит анионный комплекс родия [RhI(CO)2I2]-, который образуется в реакционной массе из RhCl3 и HI под давлением СО. Реакция протекает в присутствии промотора СН3I.
Каталитический цикл:
O |
|
+ H2O |
O |
|
|
|
|
HI + C |
CH3 |
C CH3 |
|
|
|
|
|
|
|
[RhI(CO) I ]- |
CH3I |
|
|||
HO |
|
|
|
|
|||
|
|
I |
|
|
|
||
|
|
|
|
|
2 2 |
|
|
|
|
|
O |
- |
|
O |
- |
|
|
|
C CH |
|
C CH3 |
||
|
|
|
|
|
|
||
|
|
|
3 |
|
|
|
|
|
|
|
(CO) I RhIII |
|
|
(CO)I2RhIII |
|
|
|
|
2 2 |
|
|
I |
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
O |
- |
|
|
|
|
|
|
C CH3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
CO |
|
(CO)I2RhIII |
|
(3.57) |
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
Каталитический цикл начинается со стадии окислительного присоединения йодистого метила к комплексу родия. Следующей стадией является реакция внедрения СО по связи Rh-СН3, приводящая к образованию ацильного лиганда и к освобождению вакансии в координационной сфере. Вакантное координационное место занимает молекула СО. Каталитический цикл замыкается стадией восстановительного элиминирования йодистого ацила с регенерацией исходной формы катализатора. Продукт реакции - уксусная кислота - образуется по реакции гидролиза йодангидрида. Регенерация промотора протекает по реакции нуклеофильного замещения:
HI + CH3OH CH3I + H2O |
(3.58) |
Интересно заметить, что в каталитическом цикле нет стадии прямого взаимодействия метанола с СО, как это отображается в суммарной реакции (3.56).
3.3.4.2.Карбоксилирование непредельных соединений
Мягкие и средне жесткие комплексы переходных металлов, из которых наиболее активными являются Со, Pd, Rh, катализируют реакции карбоксилирования непредельных соединений с получением карбоновых кислот и их производных, имеющих на один углеродный атом больше, чем в исходном реагенте:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
119 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
H |
|
|
|
O |
||
R |
|
|
C |
|
|
CH + CO + HX |
|
|
R |
|
|
C |
|
|
C |
|
|
C |
(3.59) |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
H |
|
|
|
|
|
|
|
|
|
H2 |
|
H2 |
|
|
|
O |
||||||
R |
|
C |
|
CH2+ CO + HX |
|
|
R |
|
|
C |
|
|
C |
|
|
C |
(3.60) |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
X
Каталитически активными в этой реакции являются гидридные комплексы. Каталитический цикл на примере реакции карбоксилирования этилена в водной среде выглядит следующим образом:
|
|
|
|
PdCl2L2 |
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
|
|
H2C |
H2C CH2 |
|
|
|
|
|
|
|
CHCl |
|
|
|
|
|
H3C |
H2 |
C |
O |
|
|
H2C CH2 |
|
|
C |
OH |
|
|
|
|
|
||
|
|
|
HPdClL2 |
|
|
|
||
|
|
|
|
|
|
|
||
|
H2 |
O |
|
|
|
HPdClL2 |
|
|
H3C |
C |
PdClL |
|
|
|
|
||
C |
|
|
|
|
||||
|
|
|
|
2 |
|
H2C |
CH2 |
|
|
|
|
|
|
|
|
||
|
|
OH |
H |
|
|
|
|
|
H2O |
|
|
O |
|
|
|
H2 |
|
|
|
H |
|
|
H3C |
PdClL2 |
||
H3C |
C2 |
C PdClL |
|
C |
||||
|
|
|
|
2 |
O |
|
|
|
|
|
|
|
|
|
|
CO |
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
H2 |
|
|
(3.61) |
|
|
|
|
|
PdClL2 |
|
|||
|
|
|
|
H3C C |
|
|
||
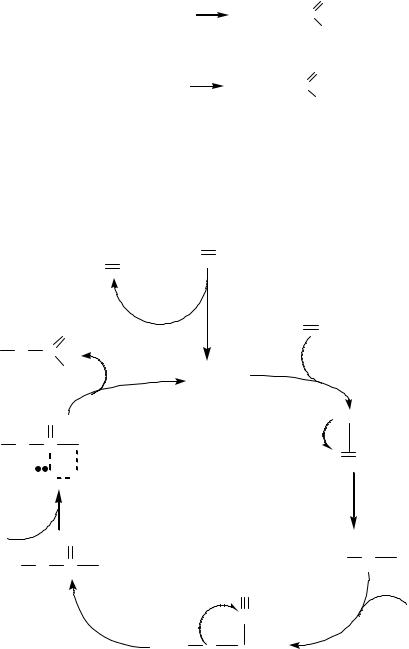
Сначала образуется каталитически активный гидридный комплекс |
||||||||
палладия по |
реакции |
гетеролитического |
присоединения (c разрывом |
|||||
связи С-Н в этилене и замещении Cl- на Н- в координационной сфере). Далее следует, собственно каталитический цикл, начинающийся с присоединения этилена на вакантное координационное место. Затем протекает реакция внедрения этилена по связи Pd-H. На освободившееся координационное место присоединяется молекула СО, которая затем внедряется по связи Pd-C2H5 с образованием пропионильного лиганда. Следующая, завершающая цикл стадия - гетеролитическое присоединение гидрида, сопровождающееся внешней нуклеофильной атакой молекулой воды на карбонильный углерод пропионила. На этой стадии в раствор выходит продукт реакции - пропионовая кислота и регенерируется исходная форма катализатора.

120
В зависимости от природы протонодонорного реагента (НХ в реакцииях (3.59), (3.60)), вступающего в реакцию на последней стадии каталитического цикла (3.61), реакция карбоксилирования приводит к образованию различных продуктов:
НХ: |
H2O |
ROH |
RNH2 |
RCOOH |
Продукт: |
Кислоты |
Эфиры |
Амиды |
Ангидриды |
На реакции карбоксилирования этилена в присутствии метанола основан новый промышленный способ получения метилметакрилата (ММА) под названием Alfa-process (компания Lucite). Катализатором служит комплекс Pd(L-L)dba, где L-L это 1,2-bis(di-t- butylphosphinomethyl)benzene, а dba это – dibenzylideneacetone. В результате реакции с селективностью 98% образуется метилпропионат (МП). На второй стадии этой технологии МП уже гетерогеннокаталитически в газовой фазе вступает в реакцию конденсации с формальдегидом, давая ММА (селективность 95%) и воду.
Практическое значение для промышленного органического синтеза также имеют следующие две реакции карбоксилирования ацетиленовых углеводородов, катализируемые тетракарбонилом никеля(0).
Карбоксилирование ацетилена в водной среде приводит к образованию акриловой кислоты (способ, альтернативный гетерогеннокаталитическому окислению акролеина):
HC |
|
CH + CO + H2O |
Ni(CO)4 |
H C=CH-COOH |
(3.62) |
|
|
||||
|
|
||||
|
|
||||
|
|
|
|
2 |
|
Карбоксилирование метилацетилена в водно-метанольном растворе с образованием метилметакрилата (способ, альтернативный кислотнокаталитическому получению из ацетонциангидрина):
CH3 |
|
C |
|
CH + CO + MeOH |
Ni(CO)4 |
H2C=CH-COOMe |
|
|
|
||||
|
|
|
||||
|
|
(3.63)
CH3
3.3.4.3.Гидроформилирование алкенов с получением альдегидов
Гидроформилирование -олефинов приводит к образованию альдегидов, имеющих на один атом углерода больше, чем исходный олефин. Альдегиды получаются как линейного, так и разветвленного строения:
|
|
|
|
|
|
н- |
|
|
|
H2 |
H2 |
O |
|||||||
|
|
|
|
|
|
R |
|
|
CH |
||||||||||
|
|
H |
|
|
|
|
C |
|
|
C |
|
||||||||
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
H |
|
|
|
|
|||||||
R |
|
C |
|
CH2+ CO + H2 |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
изо- |
R |
|
|
C |
|
|
CH3 |
||||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(3.64) |
|||
|
|
|
|
|
|
|
|
|
|
HC |
O |
||||||||
|
121 |
Интересно отметить, что реакция гидроформилирования |
была |
открыта случайно в 1938 году Отто Роеленом (Otto Roelen) во |
время |
его экспериментов по оптимизации процесса Фишера-Тропша на кобальтсодержащих гетерогенных катализаторах [17]. Он обнаружил в качестве примесей альдегиды, содержащие на один атом углерода больше, чем используемые в качестве исходных реагентов олефины и установил, что
катализаторами |
являются |
гомогенные |
гидрокарбонилы |
кобальта, |
смываемые с поверхности гетерогенного катализатора. |
|
|||
Впромышленном синтезе находят применение в качестве
катализаторов, гидридно-карбонильные |
комплексы |
только двух |
металлов |
- CoI и RhI - модифицированные различными лигандами. |
|
||
Рассмотрим механизм катализа на примере комплекса HCoI(CO)4 |
|||
(3.65). Образование каталитически |
активного |
гидридного |
комплекса |
происходит по реакции гомолитического присоединения водорода к октакарбонилу дикобальта Сo02(CO)8. Образовавшийся HCoI(CO)4 является координационно насыщенным, поэтому для продолжения каталитического цикла необходима диссоциация одной молекулы СО. На освободившееся координационное место присоединяется олефин. Далее следует внедрение олефина по связи Со-Н с образованием алкильного лиганда. Внедрение может протекать как по правилу Марковникова, так и против в зависимости от природы комплекса (см. п. 3.3.2). При этом образуется либо вторичный, либо первичный алкил, соответственно. Затем следуют стадии координирования еще одной молекулы СО и внедрение СО по связи металл-алкил. При этом образуется ацильный лиганд либо линейного, либо разветвленного строения. Образовавшийся комплекс взаимодействует далее с комплексом HCoI(CO)4 по реакции, обратной гомолитическому присоединению, в результате чего образуется продукт реакции - альдегид и би-ядерный комплекс Сo02(CO)7. Последний присоединяет молекулу СО, и на этом каталитический цикл завершается.
Активность комплексов родия в реакциях гидроформилирования в 100-10000 раз выше, чем у кобальта. С позиций концепции ЖМКО это можно объяснить тем, что более мягкий RhI гораздо легче координирует мягкий лиганд - олефин, а также, тем, что стадия образования продукта протекает гораздо быстрее, так как при этом устраняется ассиметрия жесткости/мягкости между мягким центром (RhI) и жестким ацильным лигандом.
(3.65)
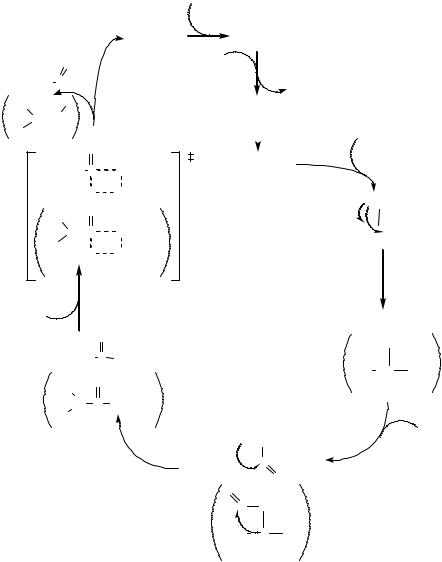
Co2(CO)7
O RCH2CH2 CH
H3C  O
O
CH CH
R  O
O
RCH2CH2 C Co(CO)3
|
H |
Co(CO)4 |
|
H3C |
O |
|
|
CH C |
Co(CO)3 |
||
R |
|||
H |
Co(CO)4 |
||
|
|||
HCo(CO)4 |
|
|
|
|
|
O |
RCH2CH2 C Co(CO)3
H3C O
CH C Co(CO)3
R
CO
Co2(CO)8
H2
HCo(CO)4
HCo(CO)4
 CO
CO
HCo(CO)3
RCH2CH2Co(CO)3
C
 O
O
O
 C Co(CO)3
C Co(CO)3
H3C CH R
122
H2C C
C R
R
H
HCo(CO)3
H2C C
C R
R
H
RCH2CH2Co(CO)3
Co(CO)3
H3C CH R
CO
Влияние строения олефина
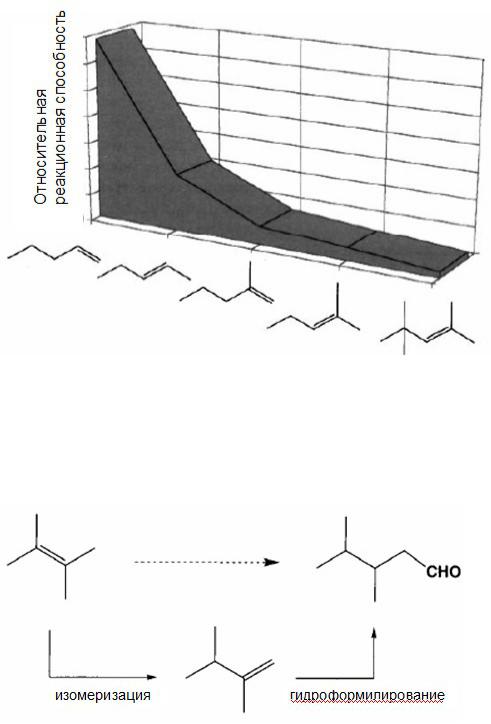
В реакцию гидроформилирования вступает большинство ненасыщенных соединений. Однако промышленное применение нашли только процессы с участием первичных олефинов. Положение двойной связи сильно влияет на реакционную способность олефинов, что наглядно демонстрируется на диаграмме относительной реакционной способности различных по строению олефинов (ниже):
123
Гидроформилирование по четвертичному атому углерода при двойной связи практически не протекает (правило Кеулеманса - Keulemans rule). Это подтверждается, например, исключительным образованием 3,4-диметилпентаналя при гидроформилировании 2,3-диметил-2-бутена. Данная реакция пртекает двух-стадийно: сначала изомеризация и только потом гидроформилирование:
3.3.5.СОЗДАНИЕ С-С СВЯЗИ. РЕАКЦИИ КРОСС-СОЧЕТАНИЯ, КАТАЛИЗИРУЕМЫЕ КОМПЛЕКСАМИ ПАЛЛАДИЯ.
Комплексы Pd0 катализируют ряд реакций кросс-сочетания, приводящие к образованию новых С-С связей. Механизм катализа основан на том, что палладий имеет две устойчивые степени окисления 0 и +2 и легко переходит из одной в другую.
Все многообразие реакций кросс-сочетания можно свести к двум большим группам:
