
_2_2_2014_doc
.pdf
124
I)Реакции сочетания органогалогенидов (обычно арил- и винил, а также аллил- и бензилгалогенидов) с металлоорганическими соединениями. Они протекают по схеме:
II)Ко второй группе относятся реакции сочетания органогалогенидов (обычно арил- и винил, а также аллил- и бензилгалогенидов) с углеводородами, имеющими непредельные С-С связи (алкенами и алкинами). Общей схемой для них являются следующие:
К первой из вышеперечисленных групп относятся несколько именных реакций, различающихся используемым металлом в металлоорганическом реагенте:
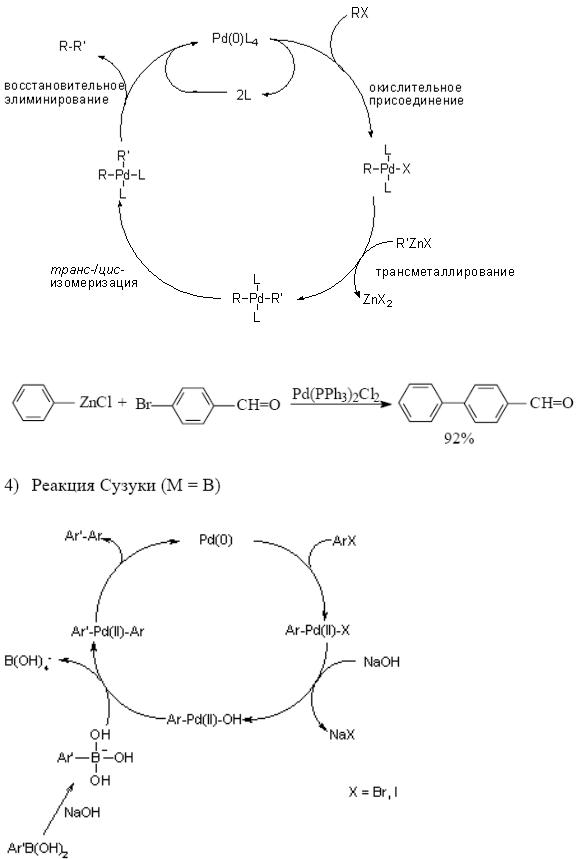
Каталитический цикл реакции Негиши:
125
Пример:
Каталитический цикл реакции Сузуки:
Пример:
126
Каталитический цикл всех реакций, входящих в эту группу включает последовательность следующих ключевых реакций:
Как правило, лимитирующей стадией является трансметаллирование. Но в случае мало реакционноспособных галогенпроизводных (арил-,
винилхлориды, алкилгалогениды и сульфонаты) лимитировать |
может |
стадия окислительного присоединения. |
|
Роль основания в реакции Сузуки заключается в превращении мало |
|
реакционноспособной бороновой кислоты RB(OH)2 в намного |
более |
активный анион боронат, например: [RB(OH)3]– – который, собственно, и вступает в реакцию трансметаллирования.
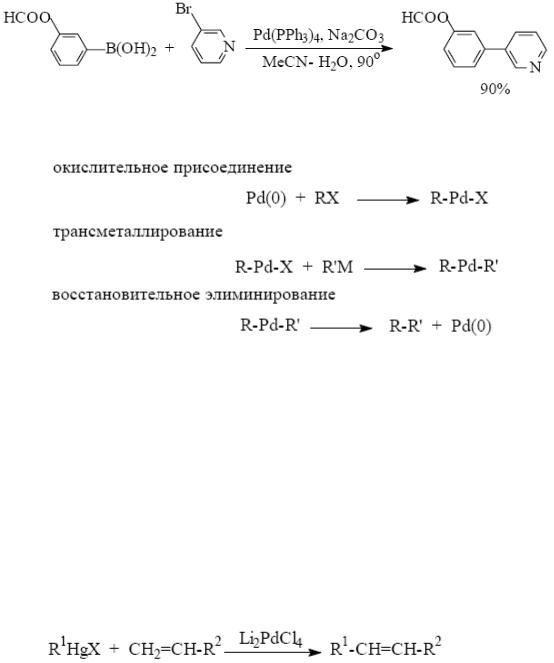
К группе реакций (II) относятся реакции Хека и Соногашира. Примечательно, что новую реакцию кросс-сочетания Роберт Хек открыл в 1968 г. Это была реакция ртутноорганических соединений с алкенами,
протекающая в присутствии комплексов палладия(II), (R. F. Heck, J. Am. Chem. Soc., 1968, 90, 5518; (b) R. F. Heck, Org. React., 1982, 27, 345):

127
Недостатком реакции является использование ртутьорганического соединения и комплекса палладия в стехиометрических количествах.
В настоящее время ртутьорганические соединения не используют в реакции Хека, а ключевой интермедиат – RPdX (R – арил, винил) получается in situ по реакции окислительного присоединения RX к комплексу Pd(0). Каталитический цикл реакции Хека включает стадии окислительного присоединения, внедрения и восстановительного элиминирования:
128
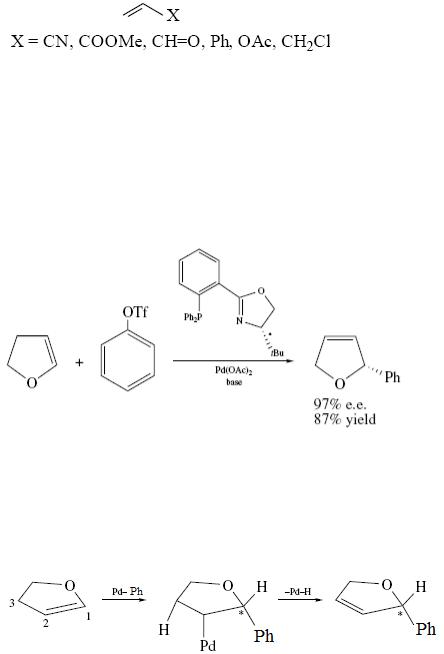
Реакция Хека региоселективна: атом палладия присоединяется преимущественно к наиболее замещенному атому углерода. Поэтому основным продуктом реакции терминального алкена является алкен с внутренним положением двойной связи. Наибольшая селективность наблюдается в случае алкенов, содержащих электроноакцепторные заместители при двойной связи:
Это объясняется тем, что электроноакцепторные группы,
оттягивая на себя электронную плотность -связи увеличивают электрофильность дальнего от себя атома углерода при кратной связи. Это обеспечивает направление нуклеофильной атаки лигандом на стадии внедрения именно по этому атому углерода.
Используя оптически активные лиганды реакции кросс-сочетания можно осуществлять с высокой энантио-селективностью. В качестве примера рассмотрим реакцию сочетания дигидрофурана с фенилтрифлатом, протекающую по механизму реакции Хека:
В каталитическом цикле данной реакции на стадии внедрения протекает нуклеофильная атака фенильным лигандом по атому С1 в дигидрофуране, т.к. в молекуле дигидрофурана свободная пара
электронов кислорода заставляет смещаться электронную плотность - связи к углеродному атому С2:
После внедрения по син-механизму вращение образовавшегося лиганда затруднено из-за взаимодействия с оптически активным
лигандом. В следствии этого -элиминирование по син-механизму возможно только с участием водорода при углероде С3. В результате получается продукт с сохранением оптической активности.
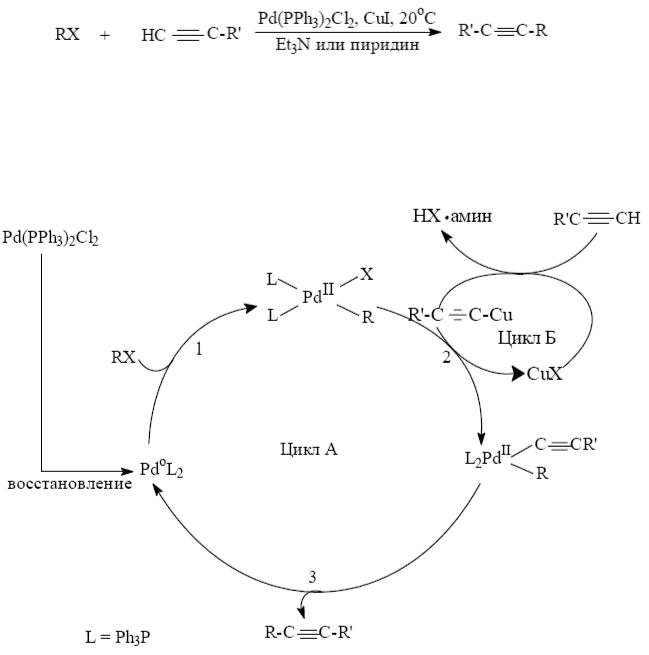
Ещё одна синтетически важная реакция кросс-сочетания – сочетание арилгалогенидов с терминальными алкинами (реакция Соногашира), например:
129
Механизм этой реакции включает два каталитических цикла. Цикл А состоит из уже известных нам реакциий – окислительного присоединения (1), переметаллирования (2) и восстановительного элиминирования (3). Цикл Б основан на обнаруженной способности CuI катализировать стадию переметаллирования в присутствии амина за счет промежуточного образования ацетиленида меди.
Реакции кросс-сочетания имеют незаменимое практическое значение
впромышленном синтезе лекарственных препаратов, биологически-
активных веществ, материалов для электроники. В 2010 году Ричард Хек, Эичи Негиши и Акира Сузуки были удостоены Нобелевской премии за открытие соответствующих реакций.
130
Список литературы:
1.Н.Н.Лебедев, М.Н.Манаков, В.Ф.Швец, Теория химических процессов основного органического и нефтехимического синтеза, Стр. 180-201.
2.Н.Н.Лебедев, Технология основного органического и нефтехимического синтеза, (все процессы, катализируемые комплексами переходных металлов).
3.Г. Хенрици-Оливэ, С. Оливэ, Координация и катализ.
4.Б.Гейтс, Дж. Кетцир, Г.Шуйт, Химия каталитических процессов.
5.Jens Hagen. Industrial Catalysis, A Practical Approach. Second, Completely Revised and Extended Edition. WILEY-VCH Verlag GmbH & Co. KGaA. 2006.
6.Fundamentals of Molecular Catalysis. Current Methods in Inorganic Chemistry Volume 3. Edited by Hideo Kurosawa and Akio Yamamoto. ELSEVIER, 2003.
7.Piet W. N. M. van Leeuwen, Paul C. J. Kamer and Joost N. H. Reek. The bite angle makes the catalyst. // Pure Appl. Chem., Vol. 71, No. 8, pp. 1443±1452, 1999.
8.C. P. Casey, G. T. Whiteker. Isr. J. Chem. 30, 299 (1990).
9.Homogeneous Catalysis: Mechanisms and Industrial Applications. Sumit Bhaduri, Doble Mukesh. Copyright _ 2000 John Wiley & Sons, Inc.
10.Catherine E. Housecroft,A. G. Sharpe. Inorganic chemistry. 2nd edition. Prentice Hall, 2004.
11.О.В.Крылов, Гетерогенный катализ, Учебное пособие для вузов М.: ИКЦ "Академкнига", 2004. - 679 с
12.Дядченко В.П., Трушков И.В., Брусова Г.П., Лукашев Н.В., Синтетические методы в
органической химии: Учебное пособие. Химический факультет МГУ им. М.В. Ломоносова,
кафедра |
органической |
химии |
(2004). |
URL: |
http://www.chem.msu.su/rus/teaching/djadchenko-synthmethods/
13.Homogenous Catalysis: Understanding the Art. Piet W.N.M. van Leeuwen. Kluwer Academic Publishers. 2004. P.407.
14.O'Connor, C.; Wilkinson, G. Tetrahedron Lett. 1969, 18, 1375.
15.Applied Homogeneous Catalysis with Organometallic Compounds: A Comprehensive Handbook in Three Volumes, 2nd, Completely Revised and Enlarged Edition. Edited by B. Cornils and W. A. Herrmann. Wiley-VCH Verlag GmbH, D-69469 Weinheim, 2002.
16.Ewen, J. A. J. Am. Chem.Soc. 1984, 106, 6355.
17.(a) Chemische Venvertungsgesellschaft Oberhausen m.b.H. (0. Roelen), DE 849.548 (193811952) and US 2.327.066 (1943). (b) 0. Roelen, Chem. Exp. Didakt. 1977, 3, 119.
18.R. A. Sheldon, Recl. Truv. Chim. Pays-Bas 1973, 253, 367.
19.K. B. Sharpless, T. R. Verhoeven, Aldrichim. Acta 1979, 12, 63.
131
20.H. Mirnoun. Angew. Chem., Int. Ed. Engl 1982, 2, 734.
21.H. Mirnoun, J. Mol. Catal. 1980. 7, 1.
22.H. Mirnoun, M. Mignard, P. Brechot, L. Saussine, J. Am. Chem. Soc. 1986. 108. 3711.
23.H. Mirnoun. Catal. Today 1987. 1. 297.
24.H. Mirnoun in Comprehensive Coordination Chemistry (Eds.: G. Wilkinson, R. D. Gillard, J. A. McCleverty), Vol. 6, Pergamon, Oxford, 1987, pp. 317410
