
-
Промышленные процессы катализируемые кислотами
Этерификация
Получение сложных эфиров: Этилацетат, Бутилацетат и пр.
Уравнение реакции: ROH + R'COOH ROOCR' + H2O
Катализаторы: H2SO4; Бензолсульфокислота (БСФК); Толуолсульфокислота (ТСФК); HCl.
Концентрация катализатора: 0,1 - 1 %.
Механизм реакции:
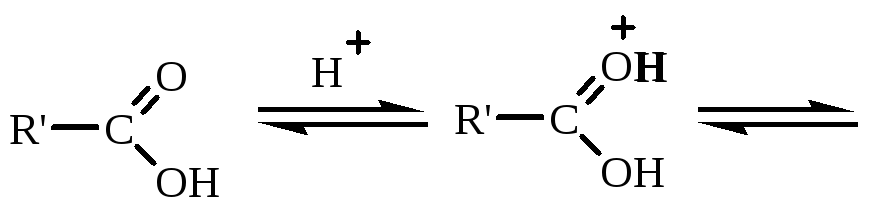
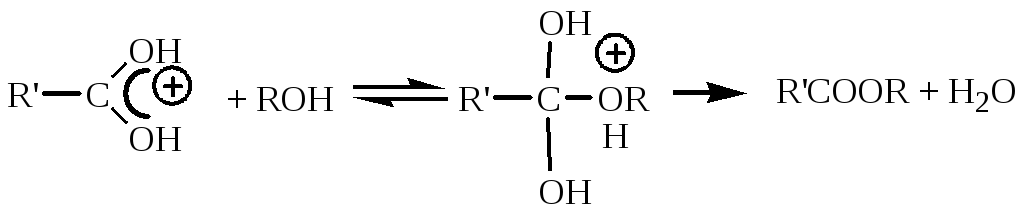
Описание периодического процесса:
Периодический процесс этерификации проводят в единичном реакторе 1 либо в реакторе 2 (Рис. 2.5) без мешалки (перемешивание обеспечивается кипением смеси). В начале процесса в реактор загружают (поток А): исходные реагенты (спирт и карбоновую кислоту), катализатор и азеотропообразователь. Последний необходим для удаления выделяющейся в ходе реакции воды, что позволяет непрерывно смещать равновесие реакции в сторону образования продуктов и достигать высокой степени конверсии исходных реагентов. В качестве азеотропообразователя чаще всего используют бензол, толуол, продукт реакции - сложный эфир или исходный реагент - спирт. Используемый азеотропообразователь должен образовывать гетероазеотроп, для удобства отделения воды (отстаиванием) и возврата азеотропообразователя в зону реакции.
После загрузки всех компонентов реактор нагревают до состояния кипения. Давление в реакторе как правило атмосферное. В ходе реакции пары азеотропа (С) конденсируются в холодильнике, конденсат собирается в сепараторе, где он расслаивается на водный и органический (азеотропообразователь) слой. Органический слой непрерывно возвращается в реактор (F или Е в зависимость от плотности относительно воды), а водный непрерывно удаляется из реакторного узла (G или D). Иногда воду частично возвращают в реактор. Последнее бывает необходимо в случае использования образующегося эфира в качестве азеотропообразователя, и если при этом содержание воды в азеотропе по отношению к эфиру больше, чем образуется по реакции.
После окончания реакции смесь охлаждают и отправляют на выделение продукта (В). На первой стадии выделения продукта катализатор из смеси удаляют обработкой 5-10% водным раствором соды. Кислоты-катализаторы переходят в результате реакции нейтрализации в водный раствор в виде натриевых солей.
Описание непрерывного процесса:
Непрерывный процесс этерификации проводят в каскаде реакторов 1 либо в реакторе 2 без мешалки (перемешивание обеспечивается кипением смеси). Перед запуском непрерывного процесса реактора заполняют азеотропообразователем с растворенным в нем катализатором и нагревают до кипения.
Если азеотропообразователь не является продуктом данной реакции, то процесс организован следующим образом: В реактор непрерывно подают смесь реагентов и катализатора (А) с такой скоростью, чтобы за время пребывания в реакторах достигалась желаемая степень конверсии (как правило Х>99%). С верха реакторов непрерывно отбирается пар азеотропа (С), который конденсируется в конденсаторах и разделяется сепараторах на водный и органический слой. Органический слой непрерывно возвращается в реактор, а водный непрерывно удаляется из реакторного узла. С низа реактора отводится конечная реакционная смесь (В', В), которая отправляется на выделение продукта. Процесс выделения протекает через те же стадии, что и при периодическом процессе.
В случае использования продукта реакции в качестве азеотропообразователя, процесс имеет некоторое отличие: Проводят его в аппарате 2. Перед запуском процесса реактор заполняется смесью сложного эфира и исходного спирта, и добавляется катализатор. Во время процесса попадающая в реактор эквимольная смесь реагентов без катализатора (А) полностью превращается в продукты реакции (Х=100%). Вода и сложный эфир в виде паров азеотропа непрерывно удаляются из реактора (С). После конденсации и расслоения эфир отбирается из сепаратора в виде конечного продукта (G). Вода либо отбирается полностью (D), либо частично возвращается в реактор (Е) для полного удаления образующегося по реакции эфира. Таким образом из реактора не выводится жидкая реакционная смесь (В=0), и следовательно, изначально загруженный катализатор не удаляется во время процесса из реактора, и нет необходимости непрерывно подавать его с исходными реагентами. Преимущество данного варианта процесса в том, что на выходе из реакторного узла получается продукт не содержащий катализатора и не требуется очистка от него. Расходные нормы по катализатору (а следовательно, затраты на катализатор и на его утилизацию) гораздо ниже, чем в других вариантах проведения процесса.
Получение диоктилфталата (ДОФ).
Уравнение реакции:
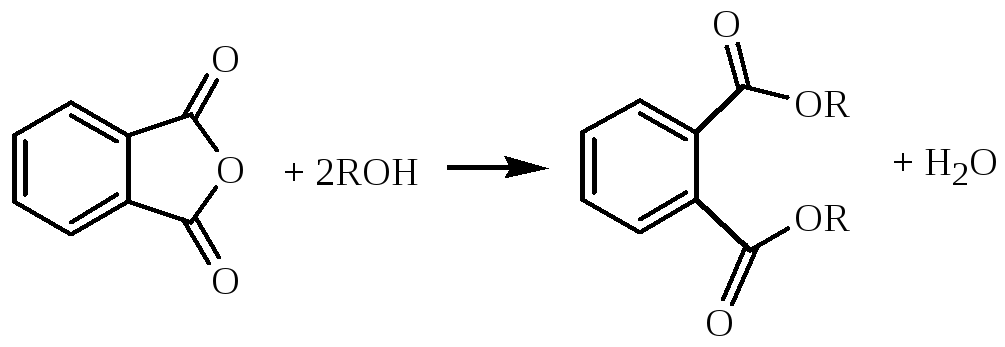 где R
= C8H17-
где R
= C8H17-
Катализатор: Ti(OC4H9)4
Концентрация катализатора: 0.5 - 5 %.
Механизм реакции:
1-я стади - алкоголиз фталевого ангидрида с получением кислого эфира фталевой кислоты. Проводят некаталитически.
2-я стадия - этерификация кислого эфира:
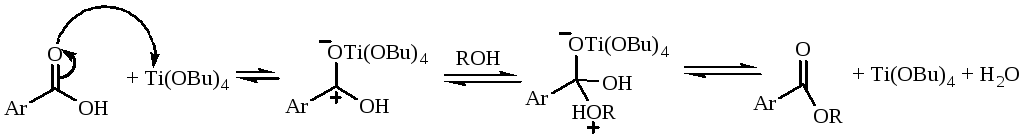
Побочная реакция:
R-CH2-CH2-OH R-CH=CH2 + H2O
Описание периодического процесса:
Периодический процесс получения диоктилфталата проводят в единичном реакторе 1 (Рис. 2.5) без мешалки (перемешивание обеспечивается кипением смеси). В начале процесса в реактор загружают реагенты (спирт и фталевый ангидрид) без катализатора (А). Спирт берется в избытке от стехиометрии, так как выполняет в процессе еще и роль азеотропообразователя, а так же для обеспечения высокой степени конверсии карбоксильных групп (Х>99,9).
После загрузки всех компонентов реактор нагревают до кипения. За время нагрева смеси протекает некаталитический алкоголиз фталевого ангидрида и образуется кислый эфир. Давление в реакторе атмосферное либо вакуум до 100 мм. рт. ст. для облегчения удаления паров выделяющейся воды. Температуру в ходе процесса повышают до 220оС. После начала кипения смеси в реактор вводят катализатор (А). В ходе реакции пары азеотропа спирт-вода (С) конденсируются в холодильнике, конденсат собирается в сепараторе, где он расслаивается на водный и спиртовой слой. Спирт непрерывно возвращается в реактор (F), а вода удаляется из реакторного узла (D).
После окончания реакции в реактор подают острый пар. Это необходимо для: 1) высокой степени удаления спирта от продукта (отпарка); 2) гидролиза тетрабутоксититана до оксида титана. Оксид титана выпадает в виде хлопьев, которые отделяют от продукта фильтрованием.
Описание непрерывного процесса:
Непрерывный процесс получения диоктилфталата проводят в тарельчатой колоне 3. В верх реактора непрерывно поступает нагретая до температуры верха реактора смесь (А) кислого эфира, спирта и катализатора. Спирт берут в избытке от стехиометрии. Нагрев куба колонны через теплообменное устройство (Т/Н) обеспечивает кипение. На тарелках колоны протекает реакция этерификации, а пары азеотропа спирт-вода непрерывно удаляются с верха (С). Пары конденсируются в холодильнике, конденсат собирается в сепараторе, где он расслаивается на водный и спиртовой слой. Спирт непрерывно возвращается в реактор (F), а вода удаляется из реакторного узла (D).
С низа колонны отбирается конечная смесь (В), состоящая из продукта, спирта и катализатора. Смесь направляется на стадию очистки от катализатора и выделения продукта, которую осуществляют тем же методом, что и в периодическом процессе.
Галогенирование
Получение 1,2-дихлорэтана
Уравнение реакции: C2H4 + Cl2 ClCH2CH2Cl
Катализатор: FeCl3
Механизм реакции:
![]()
Побочная реакция: ClCH2CH2Cl + Cl2 ClCH2CHCl2 + HCl и т.д.
Описание процесса:
Процесс хлорирования этилена проводят в непрерывном режиме в колонном тарельчатом реакторе 3 (Рис. 2.5). Реактор заполнен продуктом реакции - дихлорэтаном. Перед началом непрерывного процесса смесь нагревают до 70-100оС, после чего нагрев отключают и начинают процесс (подачей реагентов). Давление в реакторе поддерживают выше атмосферного, так чтобы температура кипения смеси была в указанном выше диапазоне. В стационарном режиме работы в низ реактора непрерывно подают газообразные этилен и хлор (Y). Этилен подают в 5%-ном избытке от стехиометрии для того, чтобы достичь полной конверсии Cl2. Катализатором реакции служит FeCl3 , который непрерывно образуется из чугунных брусков, загруженных на нижнюю полку реактора, при контакте с хлором. Реакция присоединения хлора к этилену - высоко экзотермичная, поэтому подвод тепла не нужен. Избыточное тепло снимается за счет кипения 1,2-дихлорэтана, пары которого вместе с остаточным этиленом (С) поступают в конденсатор. 1,2-Дихлорэтан конденсируется и отводится (D) на стадию выделения чистого продукта. Газообразный этилен со следами HCl (G) отмывают водой от хлористого водорода, и возвращают этилен на рецикл. С низа колоны отводят (В) высококипящие полихлориды с катализатором.
Утилизацию катализатора проводят следующим образом: Поток (В) обрабатывают водой. При этом происходит гидролиз хлорида железа с образованием HCl и гидроксида железа. HCl поглащают водой с получением соляной кислоты (либо нейтрализуют до хлористого натрия), а хлопья гидроксида железа отфильтровывают.
Получение хлорбензола
Уравнение реакции: C6H6 + Cl2 C6H5Cl + HCl
Катализаторы: FeCl3
Механизм реакции:

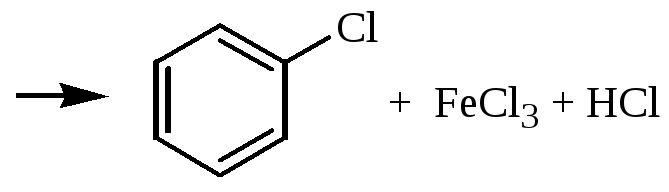
Побочная реакция: C6H5Cl + Cl2 C6H4Cl2 + HCl
Описание процесса:
Процесс хлорирования бензола проводят непрерывном режиме в колонном тарельчатом реакторе 3 (Рис. 2.5). Перед пуском процесса реактор заполняют бензолом и нагревают до 90-100оС, после чего нагрев отключают и начинают процесс. Давление в реакторе поддерживают выше атмосферного, так чтобы температура кипения смеси была в указанном выше диапазоне.
В стационарном режиме работы в верх реактора подают бензол (А), а в низ - газообразный хлор (Y). Катализатором реакции служит FeCl3 , который непрерывно образуется из чугунных брусков, загруженных на нижнюю полку реактора, при контакте с хлором. Реакция протекает при большом избытке бензола по отношению к хлору. Это необходимо по двум причинам. Во-первых, реакция высоко экзотермическая, и избыточное тепло снимается за счет кипения бензола. Во-вторых, чем выше избыток бензола, тем выше селективность процесса (за счет снижения доли побочной реакции образования дихлорбензола).
Пары бензола вместе с HCl (С) поступают в конденсатор. Бензол конденсируется и возвращается в реактор (Е), а газообразный HCl отправляют (G) на поглощение водой с образованием соляной кислоты.
С низа реактора отводится смесь, содержащая бензол, некипящие при данных условиях хлорбензол и дихлорбензол, а так же катализатор. Эту смесь очищают от катализатора тем же способом, как и при производстве 1,2-дихлорэтана, и отправляют на выделение продукта.
Алкилирование
Получение алкилбензолов
Алкилбензолы получают по реакции алкилирования бензола хлорпарафинами или олефинами. Продукты алкилирования бензола можно разделить на низшие (главным образом этилбензол и изопропилбензол) и высшие, называемые еще - линейные алкилбензолы (ЛАБ). Эти группы отличаются используемыми алкилирующими агентами.
Для получения этилбензола и изопропилбензола (кумола) в промышленности используют только, соответственно, этилен и пропилен.
Для получения ЛАБ используют либо хлорпарафины, либо высшие -олефины.
Уравнения реакции:
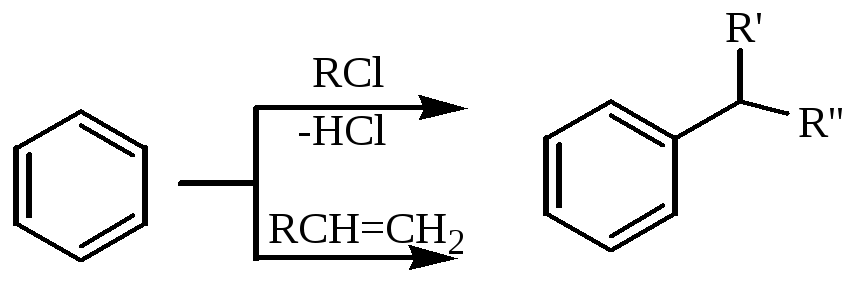
Катализаторы:
При алкилировании хлорпроизводными - AlCl3;
При алкилировании олефинами - (AlCl3 + HCl), H2SO4 , HF , BF3
Механизм образования карбокатиона:
При алкилировании хлорпроизводными
![]()
При алкилировании олефинами, в случае использования AlCl3, катализ осуществляется образующимся комплексом Густавсона:
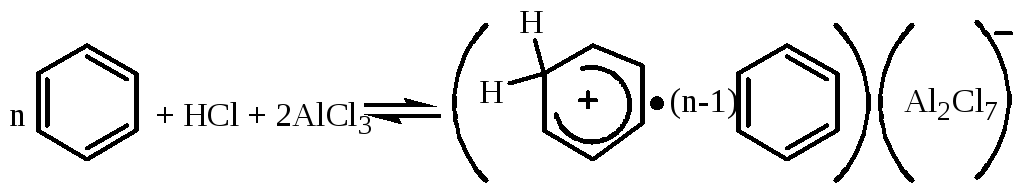
который, по сути, является источником протона.
Комплекса Густавсона не растворим в углеводородах, содержание его в реакторе составляет 10-20% от реакционной массы.
Образование карбкатиона происходит в результате присоединения протона кислоты-катализатора по двойной связи:
![]()
Образовавшиеся в результате взаимодействия с катализатором карбокатионы вступают в реакцию электрофильного замещения в бензольное кольцо с образованием продукта реакции и регенерацией протона (механизм см. п. 2.1.3.3. уравнение (2.66))
Побочные реакции: - образование диалкилбензолов
- изомеризация промежуточных карбокатионов
- полимеризация олефина
Описание периодического процесса:
Периодический процесс получения ЛАБ проводят в единичном реакторе 1 (Рис. 2.5) с мешалкой, для обеспечения интенсивного перемешивания. Перед началом процесса в реактор загружают весь исходный бензол и катализатор и нагревают смесь до рабочей температуры (40 - 60оС). Давление в реакторе - атмосферное. После достижения заданной температуры в реактор начинают дозировать алкилирующий агент (А). Постепенная подача алкилирующего агента необходима для избежания перегрева смеси вследствии экзотермичности реакции. Перегрев может привести к снижению селективности процесса и качества продукта и, даже, к выбросу реакционной массы. Интенсивное перемешивание исключает местные перегревы реакционной смеси. При алкилировании хлопроизводными из реактора постоянно отводится газообразный HCl (С, G), который поглощают водой с получением соляной кислоты. Испаряемая органическая масса (С) после конденсации возвращается в реактор (Е). После окончания процесса смесь отправляют (В) на стадию очистки от катализатора и выделения продукта.
В случае использования комплекса Густавсона в качестве катализатора удается его рециркулировать. Нерастворимый в органике комплекс (представляющий собой тяжелую жидкость) отделяют отстаиванием и возвращают в процесс. Следы катализатора, оставшиеся в органике гидролизуют водой. Выделяющийся при этом HCl улавливают водой или нейтрализуют раствором соды, а выпавший гидроксид алюминия отфильтровывают.
Описание непрерывного процесса:
В непрерывном режиме ЛАБ получают в каскаде реакторов 1 с мешалками. На вход первого реактора каскада непрерывно подают (А) весь поток бензола и катализатора. Алкилирующий агент подают дробно в каждый из реакторов каскада (А, A'), чтобы обеспечить оптимальный тепловой режим. Смесь проходит через каскад реакторов, где протекает реакция алкилирования. На выходе из последнего реактора конечная масса (В') отбирается и отправляется на отделение катализатора, которое осуществляется тем же способом, что и в периодическом процессе.
Непрерывный процесс получения низших алкилбензолов помимо каскада реакторов 1 удобно также проводить в колонных реакторах типа 3, так как интенсивное перемешивание в данном случае осуществляется барботажем газообразного олефина, подаваемого в низ реактора (Y). Бензол и катализатор подают противотоком к олефину в верх реактора (А). Из куба реактора отбирают конечную смесь (В), которую очищают от катализатора описанным выше способом.
Нитрование ароматических соединений
Получаемые продукты: Нитробензол, тринитротолуол и др.
Уравнение реакции: C6H6 + HNO3 C6H5NO2 + H2O;
Катализатор: Концентрированная серная кислота.
Механизм реакции:
образование иона нитрония
![]()
электофильное замещение с регенерацией протона

Описание процесса:
Нитрование ароматических соединений осуществляют чаще всего смесью азотной и серной кислот. Последняя одновременно является катализатором, водоотнимающим средством и веществом, препятствующим окислительным процессам (под действием азотной кислоты). Нитрогруппа в ароматическом кольце оказывает сильное дезактивирующее действие, поэтому введение каждой последующей нитрогруппы протекает значительно медленнее предыдущей. Это позволяет с высокой селективностью получать продукты с желаемой степенью нитрования.
Нитрование ароматических соединений является необратимой реакцией и протекает с высоким экзотермическим эффектом (151 кДж на одну нитрогруппу). Часть теплового эффекта обусловлена тепловыделением за счет разбавления нитрующей смеси реакционной водой и меняется в зависимости от концентрации используемой серной кислоты.
Процесс нитрования ароматических соединений проводят в непрерывном режиме в каскаде реакторов 4 при температуре 40-90оС и атмосферном давлении. При этом реакционная масса состоит из двух несмешивающихся жидкостей: органическая фаза и нитрующая смесь. Исходный углеводород подают в первый каскад реактора (А), а свежую нитрующую смесь в последний (В). После каждого реактора установлен сепаратор, в котором эти несмешивающиеся фазы разделяются, и органическая фаза направляется в следующий реактор каскада, а отработанная нитрующая смесь в предыдущий. Таким образом, эти два потока движутся в каскаде противотоком. При этом наиболее жесткие условия нитрования (наибольшая концентрация нитрующей смеси) создаются в последнем реакторе каскада, что обеспечивает наиболее полную степень нитрования исходного вещества. Важным фактором является интенсивное перемешивание, создаваемое мешалками реакторов, которое обеспечивает большую поверхность контакта фаз (что увеличивает скорость процесса) и повышает эффективность теплопередачи (что снижает риск местных перегревов).
Отработанную нитрующую смесь (С) отделяют от органической фазы отстаиванием, укрепляют добавлением серного ангидрида (для связывания воды) и свежей азотной кислоты и направляют снова в процесс.
Гидратация, дегидратация, гидролиз, алкоголиз
Получение метилметакрилата (ММА)
Схема реакции:
![]()
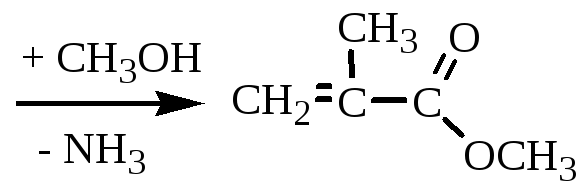
Катализатор: 100%-ная серная кислота.
Концентрация катализатора: 1,5-кратный мольный избыток к ацетонциангидрину.
Упрощенный механизм реакции: реакция протекает через ряд последовательных стадий, которые приведены ниже.
- Гидролиз и дегидратация ацетонциангидрина до сульфата метакриламида
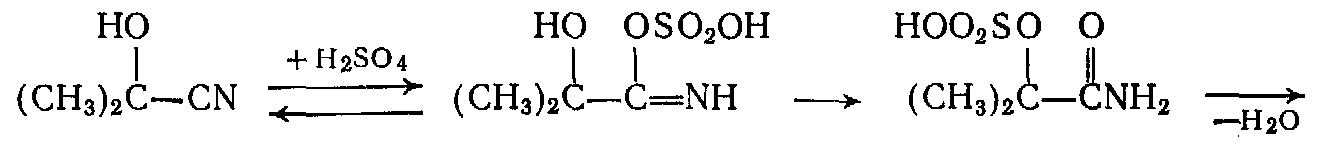

- Алкоголиз метакриламида до метилметакрилата
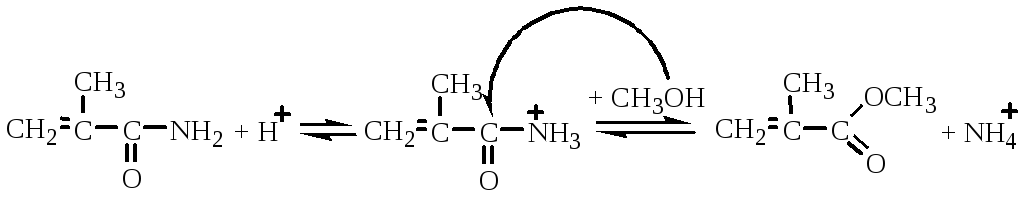
Побочные реакции: кислотно-каталитические реакции образования диметилового эфира, метилового эфира -гидроксиизомаслянной кислоты и полимеризации по двойной связи.
Описание процесса
Процесс получения ММА из ацетонциангидрина (АЦГ) проводят непрерывно в реакторном узле, представляющем собой последовательно соединенные каскад из двух реакторов (1) и одного реактора (3) (Рис. 2.5). АЦГ и 100%-ую серную кислоту в мольном соотношении 1:1,5 подают в каскад реакторов 1 (поток А). В первом реакторе выделяется большое количество тепла, поэтому он снабжен змеевиком для охлаждения, способным обеспечивать температуру в реакторе 80 - 85оС. Второй реактор каскада 1, напротив, греют паром до температуры 130 - 135оС. В первом реакторе в основном протекает экзотермическая реакция присоединения серной кислоты к АЦГ с образованием соответствующего имида, а во втором - эндотермическая реакция дегидратации.
Смесь выходящая из каскада 1 (поток в') направляется в тарельчатую колону 3 (поток А). На входе в колону к смеси добавляется необходимое количество воды и метанола. В этом аппарате протекает кислотно-каталитическая реакция образования метилового эфира (алкоголиз). Кипятильник в кубе колоны обеспечивает отгонку азеотропной смеси ММА-вода-метанол с верха колоны (С), а водно-органический раствор сульфата аммония выводится из куба (В). Конденсат с верха колоны (D) направляют на выделение товарного продукта.
Кубовую жидкость (В) перерабатывают следующим образом. Сначала отгоняют ММА, а оставшийся кислый раствор сульфата аммония донейтрализовывают аммиаком и, после очистки от органических примесей и упаривания, реализуют получающийся (NH4)2SO4 как удобрение.
Получение капролактама
Уравнение реакции:

Катализатор и его концентрация:
20%-ный олеум, взятый в таком соотношении к исходному сырью, чтобы содержание SO3 в конечной смеси было 1,5%. Расходование серного ангидрида до серной кислоты обусловлено наличием воды в поступающем в реактор сырье со стадии образования циклогексаноноксима из циклогексанона и гидроксиламина. Воду необходимо связывать, так как с ее участием протекают реакции гидролиза оксимов до кетонов, а лактамов до аминокислот.
Механизм реакции:
Реакция перегруппировки оксима (перегруппировка Бекмана) протекает при катализе сильными минеральными кислотами (специфический кислотный катализ, механизм А-1).
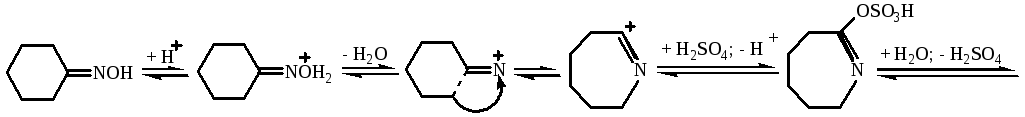
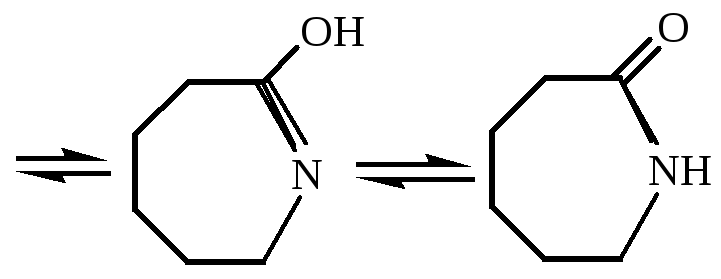
Описание процесса:
Реакцию перегруппировки проводят при 125оС и атмосферном давлении. Реакция сильно экзотермическая. Тепловой эффект составляет 235 кДж/моль. Высокая вязкость смеси при столь высоком тепловыделении заставляет применять реактор специальной конструкции - проточно-циркуляционный реактор циклонного типа 7 (Рис.2.5). Сырой оксим (А) подается в осевом направлении в циклонную часть реактора, где смешивается с циркулирующей реакционной смесью (С), подаваемой циркуляционным насосом в циклон в тангенциальном направлении. Режим работы циклона обеспечивает хорошее равномерное смешивание и предотвращает местные перегревы. Тепло реакции снимается в выносном теплообменнике. Олеум (Y) подается в систему перед входом в теплообменник для того, что бы в нем удалялось основное количество тепла реакции. Через боковой перелив реактора отводится конечная реакционная масса (В) на стадию выделения продукта.
Содержащуюся в конечной смеси серную кислоту с серным ангидридом нейтрализуют аммиачной водой до сульфата аммония, который после удаления органики и упаривания воды можно использовать в качестве минерального удобрения.
