- •Теоретические основы металлокомплексного катализа
- •Строение и свойства комплексов переходных металлов
- •Ключевые реакции в гомогенном металлокомплексном катализе
- •Правило 16/18-электронов
- •Координирование (присоединение, диссоциация и замещение лигандов)
- •Окислительное присоединение и восстановительное элиминирование (redox-реакции).
- •Внедрение (по связи металл-лиганд)
- •Внешняя нуклеофильная и электрофильная атака
- •Механизмы реакций, катализируемых комплексами переходных металлов
- •Гидрирование
- •Изомеризация олефинов
- •Олигомеризация и полимеризация
- •Диспропорционирование (метатезис)
- •Окисление
- •Радикально-цепное окисление (гомолитический механизм)
- •Гетеролитический механизм окисления
- •Эпоксидирование олефинов органическими гидроперекисями
- •Окисление этилена до ацетальдегида
- •Присоединение протонодонорных веществ к олефинам и ацетиленам
- •Синтезы на основе окиси углерода
- •Карбонилирование метанола с получением уксусной кислоты
- •Карбоксилирование непредельных соединений
- •Гидроформилирование алкенов с получением альдегидов
- •Промышленные процессы металлокомплексного катализа
- •Особенности технологии процессов металлокомплексного катализа
- •Оксосинтез
- •Карбонилирование метанола
- •Cелективное окисление этилена в ацетальдегид (wacker-process)
- •Окисление циклогексана (производство циклогексанола и циклогексанона)
- •Эпоксидирование олефинов (халкон-процесс)
- •Олигомеризация этилена (shop-process)
-
-
-
Теоретические основы металлокомплексного катализа
Значительная доля гомогенно-каталитических промышленных процессов основана на реакциях катализируемых комплексами переходных металлов. Химия металлоорганических соединений переходных металлов в последние десятилетия бурно развивается в том числе и потому, что они вызывают интерес, как потенциальные катализ
аторы промышленных процессов. Катализ комплексами переходных металлов основан на вовлечении лигандов координационной сферы в химические превращения каталитического цикла. Отличительными чертами металлокомплексного катализа являются высокие скорости реакций, высокая селективность и умеренные температуры.
-
Строение и свойства комплексов переходных металлов
Переходными металлами называют элементы с частично заполненными d- и f-оболочками. Для промышленного металлокомплексного катализа практическое значение имеют комплексы d-элементов, поэтому долее под переходными металлами будут подразумеваться именно они. Переходные металлы в таблице Менделеева начинаются с элемента 3-ей побочной группы 4 периода - Sc.
Особенностью электронного строения переходных металлов является то, что их атомы имеют близкие по энергии одну ns-, три np- и пять (n-1)d-орбиталей. Пространственное изображение орбиталей дано на рисунке 3.1. Эти девять орбиталей и находящиеся на них электроны способны образовывать координационную связь с ионами и нейтральными молекулами.
Комплексы переходных металлов состоят из центрального атома и координационной сферы, образованной координированными с центральным атомом лигандами.
В зависимости от электронного строения, центральный атом может координировать определенное количество лигандов. Это число называется координационным числом. Наиболее распространенными значениями координационного числа являются 4, 5 и 6, которым соответствуют 5 вариантов пространственной координации лигандов (Рис. 3.2):
координационное число 4 - тетраэдр и квадрат;
координационное число 5 - тетрагональная пирамида и тригональная бипирамида;
координационное число 6 - октаэдр .
Центральный атом комплекса способен образовывать координационную связь с молекулами, атомами и ионами либо акцептируя у них электроны на свои вакантные d-орбитали, либо отдавая свои электроны с внешних орбиталей на вакантные орбитали лиганда. По типу связи с центральным атомом лиганды делят на две группы: - и -лиганды.
-Лиганды бывают трех типов:
-
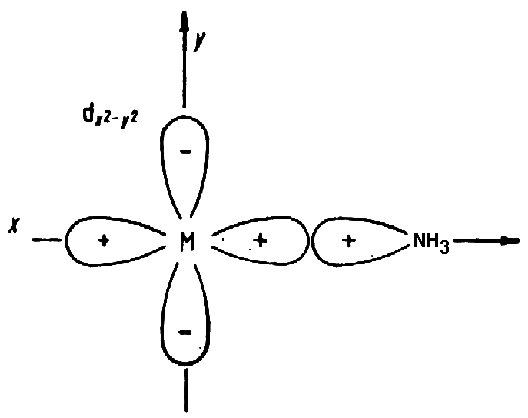
-Лиганды, имеющие одну свободную электронную пару и не имеющие энергетически доступных вакантных электронных орбиталей. К этому типу относятся H-, :NH3, R- (алкил) и др. Такие лиганды образуют с центральным атомом одну -связь. (Рис. 3.3 (1)).
-
-Лиганды, имеющие несколько свободных пар электронов. К этому типу относятся HO-, Cl-, F- и др. Такие лиганды способны образовывать дополнительную -связь с вакантными орбиталями атома металла.(Рис. 3.3 (2)).
-
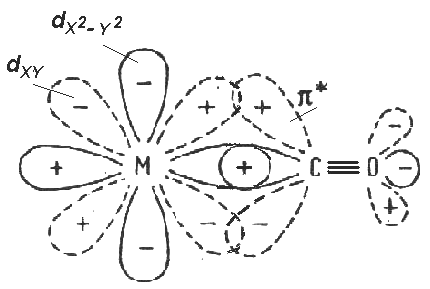
-Лиганды, которые помимо свободных пар электронов имеют энергетически доступную вакантную -орбиталь (например *-антисвязывающая орбиталь в молекулах СО, NO). Они образуют дополнительную -связь за счет передачи электронов металла на вакантную *-орбиталь лиганда (такое явление называют обратным -связыванием). Обратное -связывание приводит к ослаблению связи С-О в молекуле монооксида углерода, делая ее значительно более реакционноспособной.(Рис. 3.3 (3)).
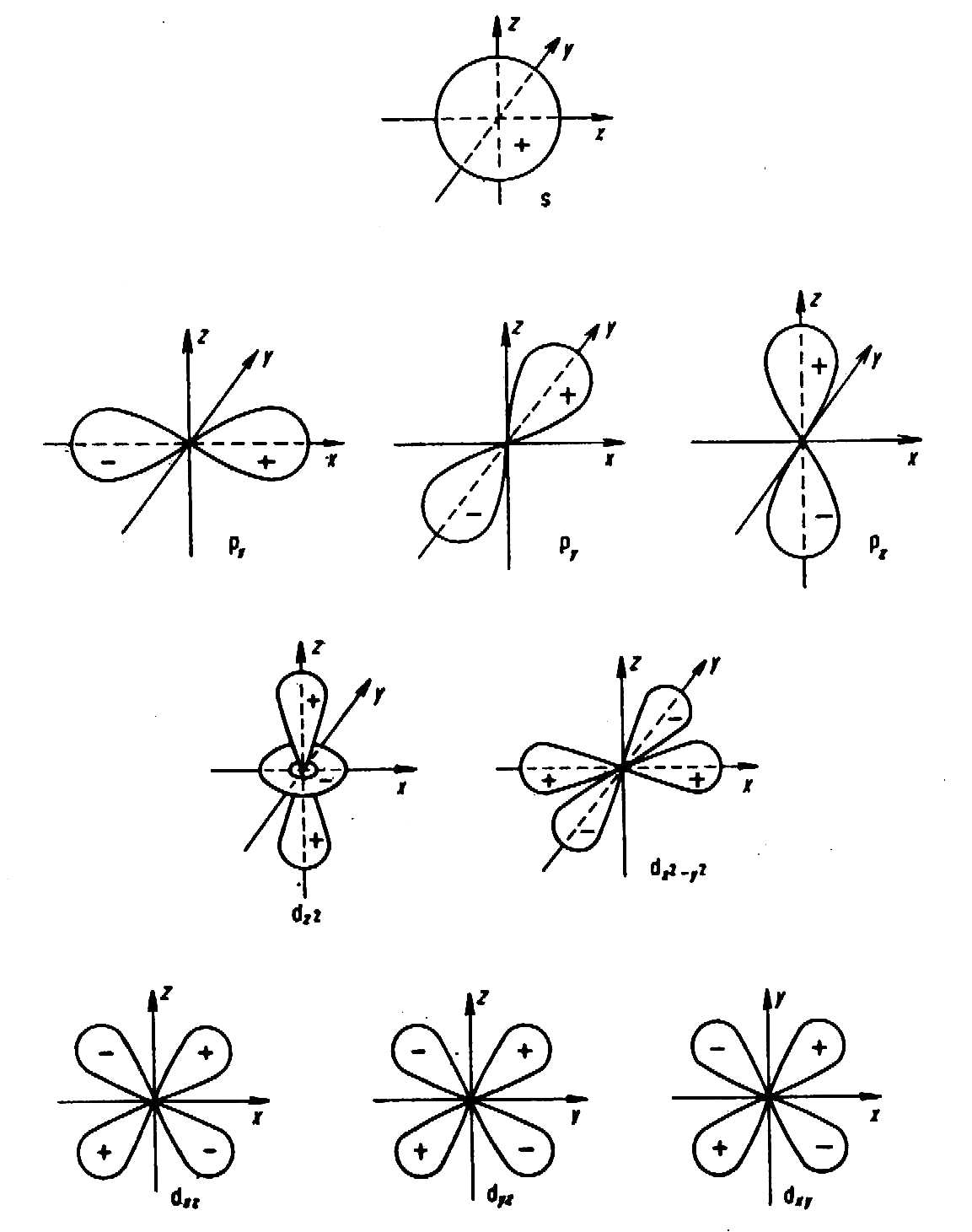
Рис 3.1. Пространственное изображение атомных орбиталей.

Рис 3.2. Пространственное расположение лигандов в комплексах переходных металлов: а) Тетраэдр; б) Квадрат; в) Тетрагональная пирамида; г) Тригональная бипирамида; д) октаэдр.
|
1) Образование -связи между вакантной dX2-Y2 орбиталью металла и свободной парой электронов аммиака.
|
|
|
|
2) Образование -связи между вакантной dX2-Y2 орбиталью металла и свободной парой электронов на pX орбитали хлора и -связи между вакантной dXY орбиталью металла и свободной парой электронов на pY орбитали хлора.
|
|
|
|
3) Образование -связи между вакантной dX2-Y2 орбиталью металла и свободной парой электронов на sp-гибридной орбитали углерода и образование -связи между парой электронов на dXY орбитали металла и свободной разрыхляющей *-орбиталью молекулы СО. |
|
|
Рис 3.3. Различные типы -лигандов и образуемые ими связи с центральным атомом комплекса.
-Лиганды имеют донорные пары -электронов, которые образуют -связь с вакантной орбиталью металла. Это алкены, алкины, диены, ароматические соединения . С алкенами координационная -связь образуется за счет электронов -связи и свободной d-орбитали металла (Рис. 3.4). Кроме того образуется дополнительная -связь за счет d-электронов металла и *-антисвязывающей орбитали олефина. Оба типа связи приводят к ослаблению двойной связи в олефине, что делает ее более реакционно-способной.
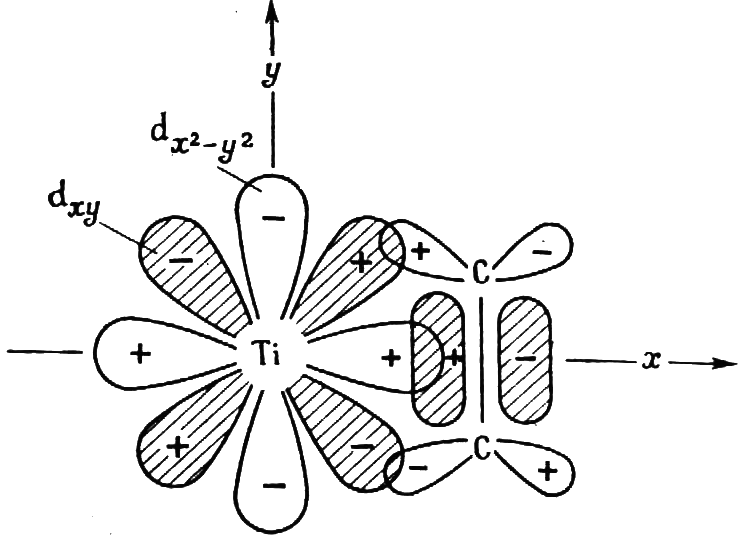
Рис 3.4. Образование - и -связей между этиленом и атомом титана.
Аллильные лиганды способны образовывать как -, так и -связь с атомом металла и обратимо перегруппировываться в координационной сфере:
 (3.1)
(3.1)
При перегруппировке -аллильного лиганда в -аллильный - один электрон -связи и 2 электрона -связи аллила делокализуются и аллильная группа ведет себя по отношению к металлу, как система с тремя валентными электронами на трех валентных -орбиталях.
Помимо аллильного лиганда существуют и другие, которые способны предоставлять, в зависимости от степени делокализации, различное количество электронов на образование связи с центральным атомом. Наряду с упомянутой выше номенклатурой, кслассифицирующей такие изомерные лиганды на - и -лиганды, существует еще одна, предложенная Коттоном. По этой номенклатуре лигандам, способным изомеризоваться из - и -форму, добавляется приставка n-, где (гапто-) - буква греческого алфавита (начальная буква в греческом слове “хватать”), а индекс n показывает сколько электронов лиганда образует связь с центральным атомом. Например:
(1-С3Н5)Mn(CO)5 - моно-гаптоаллилпентакарбонилмарганец (-аллильный лиганд)
(3-С3Н5)Mn(CO)4 - три-гаптоаллилтетракарбонилмарганец (-аллильный лиганд)
(5-С5Н5)2Fe - ди(пента-гаптоциклопентадиенил)железо
Как уже было показано выше, атом металла и координированные вокруг него лиганды могут образовывать различные типы связей. Но для упрощения описания металлокомплексных каталитических реакций, формально всегда считают, что атом металла имеет заряд 0 или >0, а лиганды всегда либо нейтральны, либо отрицательно заряжены. То есть, к примеру, лиганд (Н) - это всегда гидрид - Н-, а алкил (R) - всегда карбанион - R-.