
- •Гомогенный кислотно-основный катализ
- •Теоретические основы кислотно-основного катализа
- •Определение кислот и оснований
- •Количественная характеристика кислотно-основных взаимодействий.
- •Механизмы кислотно-основного катализа и факторы, определяющие его эффективность.
- •Нуклеофильный катализ
- •Кислотный катализ
- •Электрофильный катализ
- •Основный катализ
-
Механизмы кислотно-основного катализа и факторы, определяющие его эффективность.
Разделяют четыре типа гомогенных катализаторов действующих по механизмам кислотно-основного взаимодействия: 1) нуклеофильные; 2) кислотные; 3)основные; 4)электрофильные.
-
Нуклеофильный катализ
Механизм нуклеофильного катализа
Нуклеофилы - это анионы и молекулы, которые предоставляют свою пару электронов для образования новой связи. Наиболее распространенными нуклеофильными катализаторами являются такие анионы, как:
-
Галоген-анионы: I-, Br-, F-;
-
Оксианионы: RO-, ArO-, HCO3-, HO-, RCOO-;
-
Другие анионы: CN-, HOO-;
Из нейтральных молекул наиболее распространены азотсодержащие: аммиак, амины, пиридин, имидазол.
По конечному продукту эти нуклеофильно-каталитические реакции делятся на реакции присоединения и замещения.
В реакциях присоединения роль катализатора выполняет анион Y-, являющийся основанием, сопряженным с кислотой-реагентом HY. За счет того, что Y- обладает значительно более сильным нуклеофильным действием, чем исходный реагент (HY), он легко присоединяется по кратным связям, а промежуточно образующийся анион реагирует затем с HY с регенерацией катализатора (Y- ):
![]() (2.27)
(2.27)
Примером может служить реакция получения ацетонциангидрина:
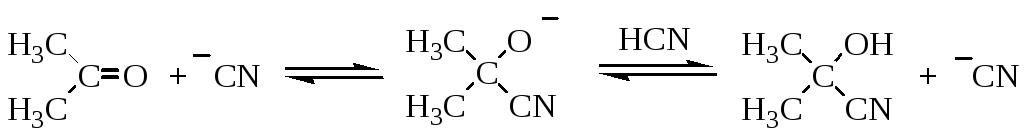
Часто в нуклеофильных каталитических реакциях за счет образования водородной связи между субстратом и реагентом значительно активируется разрываемая связь, что ускоряет стадию присоединения катализатора. Так происходит в реакциях оксида этилена с протонодонорными реагентами (кислоты, фенолы, спирты, амины и др.):
![]() (2.28)
(2.28)
Реакции замещения (RZ + Y RY + Z) при нуклеофильном катализе в простейшем случае заключаются в чередовании двух реакций:
RZ + Nu RNu + Z RNu + Y RY + Nu (2.29)
Примером может служить реакция гидролиза Cl- и Br-производных при катализе I-, который сочетает в себе свойства активного нуклеофила и легко замещаемой группы:
RCl + I- RI + Cl-
RI + 2H2O ROH + H3O+ + I-
Факторы, влияющие на активность нуклеофильных катализаторов.
В общем виде реакции нуклеофильного катализа сводятся к двум схемам. Одна из них включат стадию образования комплекса между реагентами (за счет водородной связи) и его реакцию с нуклеофильным катализатором и образование продукта (Р):
K +Y-(k1)
RZ + HY HYZR ------- Y- + Р (2.30)
При другом механизме вначале образуется промежуточный комплекс (RNu) нуклеофила (Nu) с одним из реагентов (RZ). А дальше протекает реакция превращения промежуточного комплекса в продукт (Р) с регенерацией катализатора:
k-1 k1 k2
RZ + Nu RNu(+Z) RNu(+Y) Р + Nu (2.31)
Скорость образования продукта (т.е. наблюдаемая скорость суммарной сложной реакции) всегда определяется скоростью самой медленной (лимитирующей) элементарной стадии.
Например, для реакций протекающих по механизму (2.31) возможны два предельных случая:
-
при лимитировании первой стадии скорость реакции равна:
r = k1CNuCRZ (2.32)
-
при лимитировании второй стадии скорость реакции равна:
r = k2CRNuCY
но, поскольку, при быстрой скорости первой стадии, практически весь катализатор находится в виде промежуточного комплекса (т.е. [RNu][Nu]), то:
r = k2CNuCY (2.33)
Отсюда следует, что скорость нуклеофильных каталитических реакций зависит от нуклеофильности катализатора, которая определяется основностью и поляризуемостью реакционного центра (т.е. лабильной пары электронов). Количественная связь основности и поляризуемости нуклеофилов выражается корреляционным уравнением Эдвардса:
lg(kNu/kH2O) = P + H (2.34)
где:
kNu/kH2O - нуклеофильность Nu по отношению к воде, равная соотношению соответствующих констант скорости реакции;
Р=lg(RNu/RH2O) - параметр, характеризующий относительную поляризуемость нуклеофила по сравнению с водой (R - рефракция);
Н=lg(КВNu/КВH2O)- параметр, характеризующий основность нуклеофила по отношению к воде (КВNu=[NuH+][HO-]/[Nu] - константа основности; lg(КВH2O)=15.74);
и - параметры данной реакции, характеризующие чуствительность данной реакции к изменению поляризуемости и основности нуклеофила.
В реакциях нуклеофильного замещения при насыщенном атоме углерода в протонных растворителях (вода, спирты, кислоты и пр.) преобладающее влияние на нуклеофильность оказывает поляризуемость нуклеофила. В водных растворах такие реакции характеризуются значениями параметров, близкими к следующим:
= 3,6 и = 0,0624
Значения относительных нуклеофильностей (ЕNu = lg(kNu/kH2O)) приведены в таблице 2.3.
Таблица 2.3.
Нуклеофильность ЕNu в реакции нуклеофильного замещения при насыщенном атоме углерода и ее связь с основностью Н и поляризуемостью Р нуклеофила (Nu).
|
Nu |
Н |
Р |
ЕNu |
Nu |
Н |
Р |
ЕNu |
|
F- |
4.9 |
-0.149 |
-0.23 |
HO- |
17.48 |
0.142 |
1.60 |
|
H2O |
0 |
0 |
0 |
NH3 |
11.22 |
0.184 |
1.84 |
|
CH3COO- |
6.46 |
- |
0.95 |
CN- |
10.88 |
0.383 |
2.01 |
|
Cl- |
-3.00 |
0.389 |
1.21 |
I- |
-9.00 |
0.719 |
2.02 |
|
C6H5O- |
11.47 |
- |
1.46 |
S2O32- |
3.6 |
- |
2.52 |
|
Br- |
-6.00 |
0.539 |
1.57 |
C2H5O- |
18.3 |
- |
3.28 |
Из данных таблицы 2.3 видно, что такое сильное основание, как F- в данных условиях является очень слабым нуклеофилом из-за малой поляризуемости, а очень слабое основание I-, наоборот, проявляет высокую нуклеофильную активность.
В тех случаях, когда основность является фактором, определяющим нуклеофильность (P << H), первым членом в уравнении Эдвардса можно пренебречь и оно принимает вид уравнения Бренстеда:
lg(kNu/kH2O) = H = lg(КВNu/КВH2O) (2.35)
которое еще ранее было предложено Бренстедом в форме:
kNu = G(КВNu) или lg(kNu) = lg(G) + lg(КВNu) (2.36)
где lg(G) = lg(kH2O) - lg(КВH2O)
Корреляционное уравнение Бренстеда хорошо применимо для реакций, контролируемых зарядами взаимодействующих атомов, а также в сериях реакций, в котором атом реакционного центра одинаков и его поляризуемость можно считать постоянной (Р = const), например для нуклеофильных реакций фенолятов, меркаптидов, аминов и др. В соответствии с уравнением (2.36) для серий таких реакций наблюдается линейная зависимость lg(kNu) от lg(КВNu) со значениями в пределах 0<<1.
