
- •Классификации гетерогенных катализаторов с точки зрения электронного подхода.
- •Металлы.
- •Зонная теория.
- •Теория Полинга.
- •Выводы.
- •Механизмы некоторых реакций, катализируемых металлами.
- •Полупроводники
- •Примесная проводимость в полупроводниках.
- •Хемосорбция на полупроводниках
- •Реакции, катализируемые полупроводниковыми оксидами
Выводы.
На сегодняшний день очевидно, что и зонная теория и теория металлической связи по Полингу имеют множество недостатков. Главный их недостаток в том, что они характеризуют электронное состояние атомов металлов в объеме бесконечной кристаллической решетки, а не на поверхности, где решетка обрывается и у атомов появляются свободные связи (координационные места).
Таким образом, зонная модель и теория металлической связи Полинга могут во многих частных случаях ОБЪЯСНИТЬ наблюдаемые эффекты в катализе, но не могут служить инструментом для ПРЕДСКАЗАНИЯ каталитических свойств.
Кроме того на электронное взаимодействие металла и адсорбата может накладываться стерический фактор, что делает интерпретацию каталитических свойств с позиции только одного из факторов невозможным.
По этим причинам в конце этого раздела приведен ряд эмпирических обобщений по каталитическим свойствам металлов:
-
Металлы, как катализаторы, наиболее эффективны в реакциях гидрирования, гидрогенолиза, изомеризации и окисления.
-
В реакциях с участием водорода чаще всего соблюдается следующий ряд относительной активности:
Ru, Rh, Pd, Os, Ir, Pt > Fe, Co, Ni > Ta, W, Cr, Cu
-
Pd - эффективный катализатор гидрирования кратных С-С связей. Проявляет высокую селективность в присутствии других функциональных групп.
-
Каталитическая активность в некоторых случаях коррелирует с весом d-характера связи в металле.
-
Каталитическая активность в некоторых случаях коррелирует с параметрами кристаллической решетки металлов.
-
Наиболее устойчивы к О2 и S2 следующие металлы:
Rh Pd Ag
Ir Pt Au
В литературе приведено множество рядов относительной активности металлов для тех или иных реакций. Часто они сильно различаются и даже разнонаправлены. В Таблице 5.15 приведены некоторые из них.
Таблица 5.15.
Относительная каталитическая активность металлов.
|
Гидрирование олефинов Гидрирование этилена Гидрогенолиз Гидрирование ацетиленов Гидрирование ароматики Дегидрирование Изомеризация двойной связи в алкенах Гидратация |
Rh > Ru > Pd > Pt > Ir Ni > Co > Fe > Re Cu Rh , Ru > Pd > Pt > Ni > Co, Ir > Fe > Cu Rh Ni Co Fe > Pd > Pt Pd > Pt > Ni , Rh > Fe, Cu, Co, Ir, Ru > Os Pt > Rh > Ru > Ni > Pd > Co > Fe Rh > Pt > Pd > Ni > Co Fe Fe Ni Rh > Pd > Ru > Os > Pt > Ir Cu Pt > Rh > Pd >> Ni >> W >> Fe |
Механизмы некоторых реакций, катализируемых металлами.
В механизмах гетерогенного катализа переходными металлами много общего с гомогенным катализом комплексами переходных металлов.
Рассмотрим некоторые простейшие реакции.
Гидрирование этилена на некоторых металлах протекает по следующему каталитическому циклу:
 (5.33)
(5.33)
Вначале молекула водорода диссоциативно хемосорбируется на двух активных центрах (аналог реакции окислительного гомолитического присоединения). Затем ассоциативно, с разрывом -связи и образованием двухцентрового комплекса, хемосорбируется молекула этилена. Далее хемосорбированный водород атакует один из атомов углерода с образованием -СН3 группы и освобождением двух активных центров поверхности металла (стадия аналогичная восстановительному элиминировнаию). То же самое происходит и со вторым атомом углерода. Образовавшийся этан десорбируется и каталитический цикл завершается.
Изомеризация (миграция двойной связи и пространственная изомеризация) при катализе металлами часто протекает по следующему механизму:
(5.34)

Процесс протекает в присутствии веществ (водород, вещества - доноры водорода), образующих хемосорбированный водород на поверхности катализатора. Олефин (в котором фрагменты R1CH2- и R2- находятся в цис-положении) образует -комплекс с соседним атомом металла (одноцентровая молекулярная хемосорбция олефина). Затем водород атакует один из атомов углерода при двойной связи (реакция внедрения) и образуется -алкильный поверхностный комплекс. В этом комплексе возможно вращение вокруг -связей. В результате вращения на 120о вокруг связи С-С (продолжение каталитического цикло вправо на Рис. 5.34) к свободному активному центру поверхности приблизится атом водорода не тот, который вошел в молекулу на предыдущей стадии, а тот, который изначально был в составе молекулы. В результате последующего -элиминирования этого водорода образуется олефин, пространственно изомерный исходному (фрагменты R1CH2- и R2- находятся в транс-положении). При повороте -алкильного комплекса вокруг -связи металл-С (продолжение каталитического цикло влево на Рис. 5.34) соседнему активному центру становится доступен атом водорода в фрагменте R1CH2-. В результате -элиминирования этого атома водорода образуется олефин с переместившейся двойной связью.
Реакции гидрогенолиза часто протекают по механизму, характерному для реакции гидродехлорирования дихлоруксусной кислоты до монохлоруксусной, катализируемой палладием (Рис. 5.35).
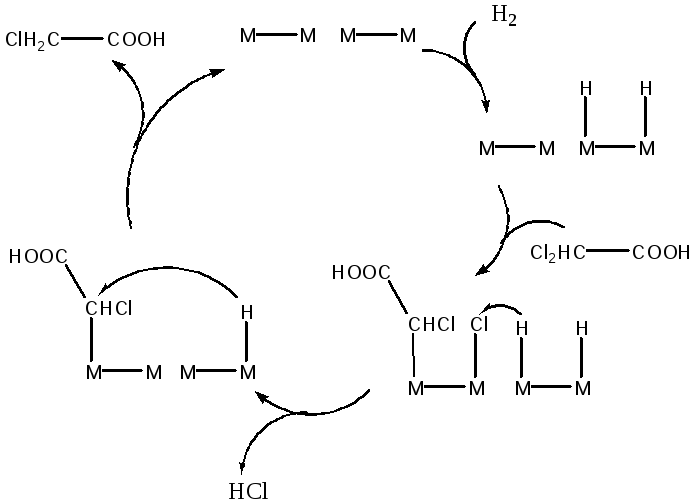 (5.35)
(5.35)
