10. Другий закон термодинаміки 2015
.pdf
Розрив хімічного зв’язку потребує витрати енергії. Енергія, що вивільнюється під час гідролізу ефірів фосфатної кислоти, зобов’язана своїм походженням не розриву специфічного фосфатного зв’язку, а структурним особливостям молекули АТФ, унаслідок чого вільна енергія продуктів гідролізу є меншою, ніж вихідних речовин.
Біологічні системи та ∆G0´
Стандартні умови розчинів у фізичній хімії та біохімії різні. У фізичній хімії стандартні умови за Т=298 К , р=101,3 кПа та концентрація всіх компонентів 1 моль. Оскільки переважна більшість біохімічних реакцій відбувається за участю йонів Гідрогену, а фізіологічне значення рН близьке до 7, стандартні умови, крім вищесказаних, в біохімії включають концентрацію йонів Гідрогену 10-7 моль/л, тобто рН=7. У зв’язку з цим стандартна вільна енергія в біохімії позначається ∆G0´. Різниця між ∆G0 та ∆G0´ складає 39,95 кДж:
∆G0´=∆G0±39,95 кДж/моль
В біохімії процеси, для яких ∆G0´˂0, називають екзергонічними, ∆G0´>0 –
ендергонічними.
Розглянемо як використовується величина ∆G0´ для визначення можливості перебігання тих чи інших реакцій в живих організмах.
Необхідна для різних біохімічних реакцій енергія виділяється при розщепленні макроергічних зв’язків, наприклад, при гідролізі АТФ:
АТФ + Н2О → АДФ + Фнеорг − ∆G0'
Ця реакція супроводжується зниженням стандартної вільної енергії. ∆G0´
гідролізу АТФ за рН=7 та Т=298 К становить -33,5 кДж/моль. Реакція гідролізу може відбуватися далі:
АДФ + Н О → АМФ + Ф |
; |
∆G0' = −30 кДж / моль |
|||
2 |
неорг |
|
|
|
|
АМФ + Н О → аденозин + Ф |
|
; ∆G0' |
= −14 кДж / моль |
||
2 |
|
неорг |
|
|
|
В біохімії важливу роль відграє принцип енергетичного спряження, який полягає в тому, що енергія, необхідна для ендергонічної реакції надходить за рахунок протікання екзергонічної реакції.

Наприклад перша стадія гліколітичного обміну полягає в перетворенні глюкози в глюкозо-6-фосфат:
Глюкоза + НРО42− → Глюкозо − 6 − фосфат + Н2О;
∆G0' = 13,4 кДж / моль
Оскільки, ця реакція ендергонічна вона не могла б протікати в звичайних умовах. Проте, реакція відбувається, якщо спряжена з іншою, екзергонічною реакцією – гідролізом АТФ:
Глюкоза + АТФ → Глюкозо − 6 = фосфат + АДФ;
∆G0' = −17,2 кДж / моль
Ця реакція самочинна, оскільки ∆G0´ - негативна величина.
Таким чином, енергетично невигідна, але необхідна для метаболізму реакція реалізується за рахунок спряження з іншою реакцією, в ході якої звільняється енергія. В організмі ці дві реакції не можуть відбуватися окремо, їх спряження можливе завдяки наявності спеціального ферменту, який об’єднує два процеси в один.
Приклади розв'язування типових задач

 Приклад 1. Розрахунок ∆S0 для реакцій
Приклад 1. Розрахунок ∆S0 для реакцій
Розрахуйте зміну ентропії, ∆S0, при 25° С
для реакції, в якій сечовина утворюється з NH3 і CO2.
2NH3(g) + CO2 (g) → NH2CONH2 (aq) + H2O(l)
Стандартна ентропія NH2CONH2 (aq) 174 Дж/(моль·К). Див. табл.2 для інших речовин.
Розрахунок ∆S0 аналогічний до ∆H0 із значень ∆H0f.
Розв’язок. Для зручності записуємо стандартні значення ентропії, помножені на стехіометричнї коефіцієнти нижче формул в збалансованому рівнянні.
2NH3(g) + CO2 (g) → NH2CONH2 (aq) + H2O(l)
S0 : 2 ×193 214 174 70
Розраховуємо зміну ентропії шляхом віднімання суми ентропій реагентів від суми ентропій продуктів.
∆S0 = ∑nS0 (продуктів) − ∑mS0 (реагентів)
= [(174 + 70) − (2×193+ 214)]J / K = −356J / K
Перевірка. Уважно перевірте математичні розрахунки. Крім того, зверніть увагу, оскільки зменшується кількість моль газів, тому очікуємо, що ентропія зменшується (і, таким чином, знак повинен бути негативним).


 Приклад 2. Розрахунок ∆G0, за ∆H0 і ∆S0
Приклад 2. Розрахунок ∆G0, за ∆H0 і ∆S0
Розрахувати зміну вільної енергії Гіббса, ∆G0, для наступної реакції за 25°C?
N2 (g) + 3H2 (g) → 2NH3(g)
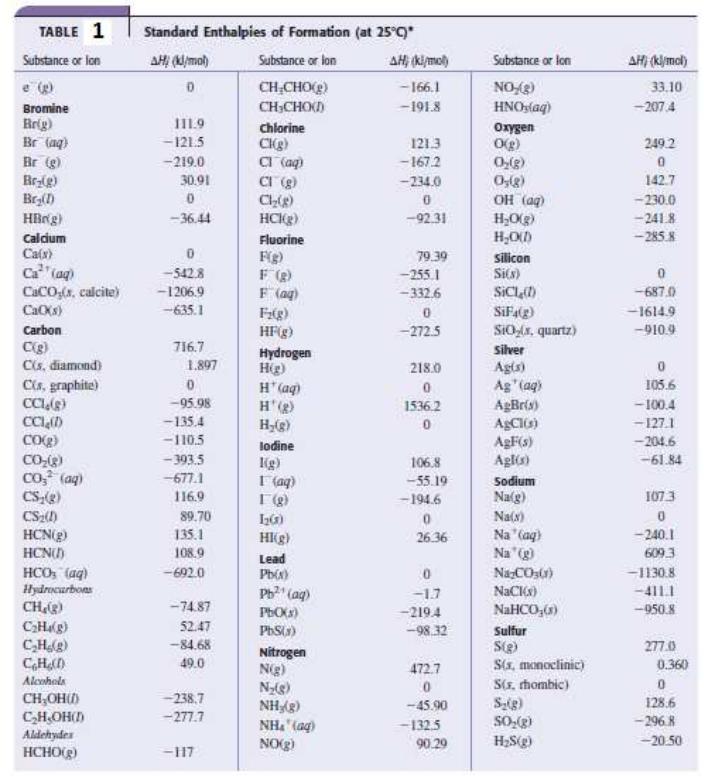
Значення ∆H0f і S0 використайте з таблиці 1 і 2.
Потрібно розрахувати ∆H0 і ∆S0, потім підставити ці значення у вираз ∆H0 - T∆S0 щоб отримати ∆G0.
Розрахунок. Напишіть рівняння реакції з коефіцієнтами, нижче кожної формули запишіть значення ∆H0f і S0, помножені на стехіометричні коефіцієнти.
|
|
N2 (g) + 3H2 (g) → 2NH3(g) |
||
∆H |
0 |
: 0 |
0 |
2×(−45.9)kJ |
|
f |
|
|
|
S0 :191.6 |
3×130.6 |
2×192.7 J / K |
||
Для обчислення ∆H0 і ∆S0 підставляємо значення для продуктів і реагентів у формули:
∆H0 = ∑n∆H0f (продуктів) − ∑m∆H0f (реагентів) = [2 ×(−45.9) − 0] kJ = −91.8 kJ
∆S0 = ∑n∆S0 (продуктів) − ∑m∆S0 (реагентів)
= [2 ×192.7 − (191.6 + 3×130.6)] J / K = −198.0 J / K Тепер підставимо значення ∆H0 і ∆S0 в рівняння для ∆G0. Зверніть увагу, що потрібно змінити одиниці ∆S0 в кДж/К.
∆G° = ∆H° − T∆S°
∆G0 = −91.8 kJ − (298 K)(−0.1980 kJ / K) = −32.8 kJ
Перевірка. Перевірте математичні розрахунки. Потрібно бути обережними із знаками, особливо при розрахунку ∆H; Індивідуальні ентальпії утворення можуть бути позитивними або негативними. Також потрібно віднімати значення продуктів від реагентів.

 Приклад 3. Розрахунок ∆G0 з стандартних вільних енергій утворення речовин
Приклад 3. Розрахунок ∆G0 з стандартних вільних енергій утворення речовин 

Розрахувати ∆G0 для спалювання 1 моль етанолу, C2H5OH, за 25°C.
C2H5OH(l) + 3O2 (g) → 2CO2 (g) + 3H2O(g)
Використовуйте стандартні вільні енергії утворення, наведені в таблиці 3.
Розраховують ∆G0 із значень ∆G0f, подібно до того, як розраховують ∆H0 із значень ∆H0f.
Розрахунки. Запишіть рівняння реакції зі значеннями ∆G0f

помноженими на стехіометричні коефіцієнти нижче кожної формули.
|
C2 H5OH(l) + 3O2 (g) → 2CO2 (g) + 3H2O(g) |
||
∆G0 |
: −174.9 |
0 |
2×(−394.4) 3×(−228.6) kJ |
f |
|
|
|
Розрахунок:
∆G0 = ∑n∆G0f (продуктів) − ∑m∆G0f (реагентів)
= [2(−394.4) + (−228.6) − (−174.9)] kJ = −1299.7 kJ
Перевірка. Як і в розрахунку значення ∆H, потрібно бути уважними зі знаками.

 Приклад 4. Інтерпретація значень ∆G0
Приклад 4. Інтерпретація значень ∆G0
Розрахувати ∆H0 і ∆G0 для реакції
2KClO3 (s) → 2KCl(s) + 3O2 (g)
Поясніть значення, отримані для ∆H0 і ∆G0. Значення ∆H0f (в кДж/моль):
KClO3(т) -397,7; KCl(т) -436,7. Аналогічно, значення ∆G0f (в кДж/моль): KClO3(т) -296,3; KCl(т) -408,8.
Слід зазначити, що О2(г) є простою речовиною, і тому ∆H0f = ∆G0f = 0.
Спершу розраховуємо ∆H0 і ∆G0; потім пояснюємо значення цих величин. Інтерпретація знаку ∆H обговорювалося раніше. Якщо ∆G0 не наближене до нуля, інтерпретувати знак можна наступним чином: негативне значення ∆G0 означає, що реагенти як правило, перетворюються на продукти; позитивне значення ∆G0 означає, що реакція несамочинна, як записана. Коли значення ∆G0 близьке до нуля, реакція дає рівноважну суміш.
Обчислення. Записуємо рівняння реакції і під кожною формулою записуємо значення ∆H0f і ∆G0f:
|
2KClO3 (s) |
→ 2KCl(s) + |
3O2 (g) |
|
∆H 0 |
: 2×(−397.7) |
2×(−436.7) |
0 |
kJ |
f |
|
|
|
|
∆G0 |
: 2×(−296.3) |
2×(−408.8) |
0 |
kJ |
f |
|
|
|
|
потім,
∆H0 = [2 × (−436.7) − 2 × (−397.7)] = −78.0 kJ
∆G0 = [2 × (−408.8) − 2 × (296.3)] = −225.0 kJ
Реакція є екзотермічною, виділяючи 78.0 кДж тепла. Велике від’ємне значення ∆G0 показує, що рівноважний склад це в основному калій хлорид і кисень.
Перевірка. Перевірте математичні розрахунки. Памятайте, що негативний знак для ∆H0 означає, що тепло виділяється з системи; велике негативне значення для ∆G0 означає, що реакція відбувається з переважанням продуктів реакції.