
07. Буферні розчини
.pdf
БУФЕРНІ СИСТЕМИ, КЛАСИФІКАЦІЯ ТА МЕХАНІЗМ ДІЇ.
1.Склад буферних розчинів з точки зору теорії Бренстеда-Лоурі.
2.рН буферних розчинів. Рівняння Гендерсона-Гассельбаха для буферних розчинів.
3.Механізм буферної дії при додаванні сильних кислот та лугів.
4.Вплив розведення на рН буферних розчинів.
На практиці часто виникає потреба мати розчин з певним та сталим значенням водневого показника рН, на який би мало впливали будь-які зміни в системі. Цього досягають за допомогою буферних розчинів.
Буферними називають розчини з достатньо стійкою концентрацією водневих іонів, а отже, з певним значенням рН, що майже не залежить від розбавлення і лише слабко змінюється в разі додавання до розчину невеликих об'ємів сильних кислот чи лугів.
Буферні розчини, утворені сумішшю слабкої кислоти та її солі, мають кислу реакцію (рН < 7). Наприклад, суміш СН3СООН і CH3COONa – ацетатний буферний розчин.
Буферні розчини, утворені сумішшю слабкої основи та її солі, мають лужне середовище (рН > 7). Суміш NH4OH і NH4Cl – амоніачний буферний розчин.
Склад буферних розчинів з точки зору Бренстеда-Лоурі теорії: (а) слабкі кислота та спряжені до них основи
Н2СО3/ НСО3-
СН3СООН / СН3СОО-
H2PO4-/HPO42-
(б) слабка основа і спряжена до неї кислота
NН3/NH4+
Такі властивості мають розчини, які містять слабку кислоту та її сіль або слабку основу та її сіль.

Концентрація недисоційованих молекул кислоти стає такою, що практично дорівнює загальній (вихідній) концентрації кислоти, а концентрація іонів цієї кислоти - загальній (вихідній) концентрації солі.
Додавання невеликої кількості сильної кислоти або лугу також мало впливає на рН. Це пояснюють тим, що в разі додавання сильної кислоти
утворені нею іони H+ зв'язуються з іонами солі з утворенням недисоційованих молекул слабкої кислоти. У разі додавання невеликої кількості лугу іони OH-
зв'язуються кислотою з утворенням іонів солі.
Здатність буферних розчинів підтримувати сталі значення рН у разі додавання кислоти або лугу характеризуються буферною ємністю.
Буферна ємність визначається кількістю кислоти або лугу, яку слід додати до 1 л буферного розчину, щоб знизити або підвищити його рН на одиницю.
Буферна ємність тим більша, чим вищі концентрації її компонентів.
ТИПИ БУФЕРНИХ СИСТЕМ І ОБЧИСЛЕННЯ РН
СЕРЕДОВИЩА
До буферних систем належать суміші, що містять:
слабку кислоту і сіль цієї кислоти, утворену сильною основою, на-
приклад СН3СООН + СН3СОONа (ацетатний буфер), Н2СO3 + NaНСO3
(гідрогенкарбонатний буфер);
слабку основу і сіль цієї основи, утворену сильною кислотою, наприклад
NН4ОН + NН4С1 (амонійний буфер);
солі багатоосновних кислот, наприклад NaН2РO4 + Na2НРO4 (фосфатний буферний розчин), Na2СO3 + NaНСO3 (карбонатний буфер);
сильну або слабку кислоту (кислотний компонент) і гліцин або луг
(основний компонент), наприклад, НС1 + NН2СН2СООН (діапазон рН
1,0-3,7), NН2СН2СООН + NaОН (діапазон рН 8,2-10Д, лимонна кислота +
луг (діапазон рН 2,2—6,5).
Буферні розчини.
HHb/Hb-; гемоглобіновий
HHbO2/HbO2-; оксигемоглобіновий

H2PO4-/HPO42-; фосфатний
H2CO3/HCO3-; бікарбонатний
PtCOOH/PtCOO-; білковий
СН3СООН / СН3СОО-; ацетатний
NH3/NH4+аміачний
Механізм регулювання pH в організмі
(1)Буферні розчини організму,
(2)Дихальна система,
(3)Сече-видільна система.
ЕКСПЕРИМЕНТАЛЬНЕ ДОСЛІДЖЕННЯ РН СЕРЕДОВИЩА
СОЛЕЙ, УТВОРЕНИХ СИЛЬНОЮ ОСНОВОЮ І СЛАБКОЮ
КИСЛОТОЮ
Теоретичні розрахунки рН середовища. Рівняння ГендельсонаГесельбаха
(Henderson-Hasselbalch).
Вибір буферних розчинів визначається необхідним діапазоном рН, який залежить від констант дисоціації кислоти (основи) та співвідношення компонентів буферної системи. Залежно від діапазону рН, буферні системи поділяють на дві групи – кислотні й основні.
З'ясуємо, на чому ґрунтується буферна дія, тобто здатність буферних систем підтримувати на певному рівні значення рН, і виведемо формули для обчислення рН кислотних і основних буферних розчинів.
Ацетатний буферний розчин (діапазон рН 3,7-5,6). Розглянемо ацетатну буферну систему, в якій концентрація компонентів – кислоти та солі - однакова і дорівнює ОД моль/дм3.
Запишемо рівняння електролітичної дисоціації складових частин такого буферу і вираз константи дисоціації кислоти як слабкого електроліту:
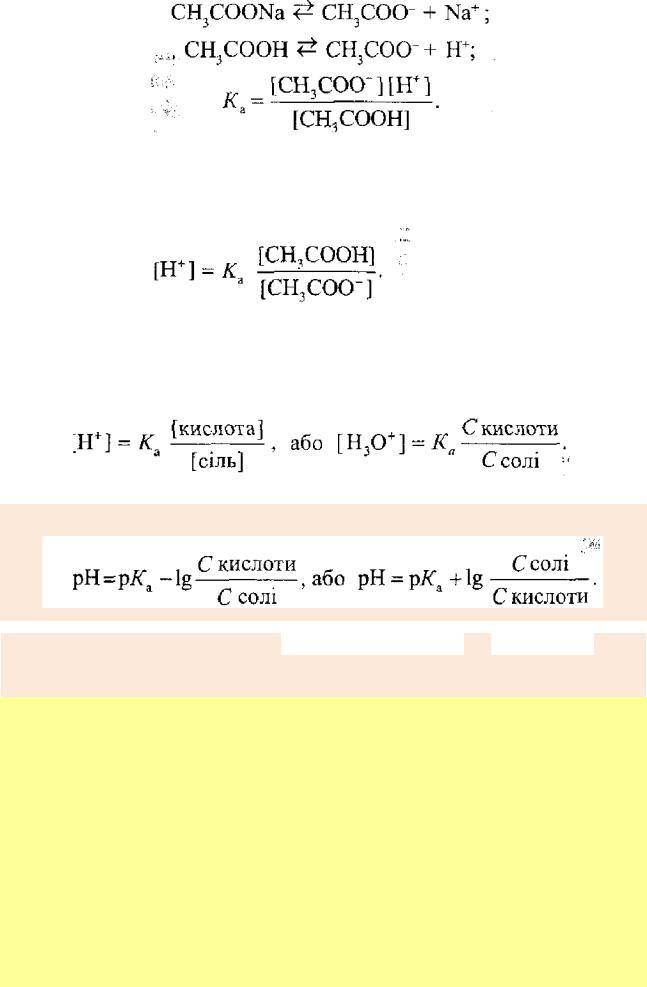
З рівняння константи дисоціації визначимо концентрацію йонів Гідрогену
Н+:
Враховуючи те, що концентрація кислоти в стані рівноваги практично дорівнює вихідній концентрації, а ацетат-іонів - концентрації солі» яка дисоціює повністю, отримаємо:
У логарифмічному вигляді це рівняння записують так:
Дане рівняння (називають рівнянням Гендерсона - Гассельбаха. Його використовують для обчислення рН різних буферних розчинів.
Рівняння Гендерсона-Гассельбаха дозволяє сформулювати ряд важливих висновків:
1. рН буферних розчинів залежить від негативної дії логарифма константи дисоціації слабкої кислоти рКа або основи рКВ і від відношення концентрацій компонентів пари кислота-основа, але практично не залежить від розбавлення розчину водою.
Слід зазначити, що сталість рН добре виконується при малих концентраціях буферних розчинів. При концентраціях компонентів вище 0,1
моль/л необхідно враховувати коефіцієнти активності іонів системи.

2. Значення рКа будь-якої кислоти і рКВ будь-якого розчину можна обчислити за вимірюваним рН розчину, якщо відомі молярні концентрації компонентів.
Крім того, рівняння Гендерсона-Гассельбаха дозволяє розрахувати рН буферного розчину, якщо відомі значення рКа і молярні концентрації компонентів.
3. Рівняння Гендерсона-Гассельбаха можна використовувати і для того,
щоб дізнатися, в якому співвідношенні потрібно взяти компоненти буферної суміші, щоб приготувати розчин з заданим значенням рН.
БУФЕРНА ДІЯ
Дія буферних розчинів основана на тому, що окремі компоненти буферних сумішей зв’язують йони Н+ або ОН- кислот або основ, що додаються до них,
утворюючи при цьому слабкий електроліт.
Наприклад:
Буферна суміш 0,1 М розчину СН3СООН і 0,1 М розчину СН3СООNa.
Розрахунок рН цього розчину.
Як слабкий електроліт ацетатна кислота йонізує за рівнянням:
СН3СООН = СН3СОО- + Н+
Константа цієї рівноваги:
З цього рівняння концентрація йонів [Н+]:
У розчині присутній сильний електроліт СН3СООNа, який практично повністю йонізує на йони:
СН3СООNa = СН3СОО- +Na+.
Концентрація кожного йону дорівнює концентрації солі (ВА): [СН3СОО-] = [Na+] = с(ВА).
Присутність великої кількості СН3СОО- йонів пригнічує йонізацію кислоти, тому, нехтуючи її частковою йонізацією, можна вважати, що
[СН3СООН] = с(НА), тоді:

де с (НА) - концентрація кислоти, с(ВА) - концентрація солі.
Прологарифмуємо це рівняння і замінимо знаки на зворотні, отримаємо:
Для даного буферного розчину, в якому с(НА) = 0,1 моль/дм3, с(ВА) = 0,1
моль/дм3, рКа = 4,76.
Розглянемо, як зміниться рН при додаванні до 1 дм3 буферного розчину
1*10-3 моль NaOH. Натрій гідроксид - сильний електроліт:
NaOH = Na+ + ОН-.
Ацетатна кислота - слабкий електроліт:
СН3СООH = СН3СОО- + H+.
В розчині відбудеться реакція утворення іншого слабкого електроліту Н2O.
Сумарне рівняння цього процесу:
СHзСООH + ОH- = СH3CОО- + Н2O.
Замість витрачених йонів гідрогену, унаслідок подальшої йонізації кислоти:
СН3СООH = СН3СОО- + H+.
з’являться нові йони гідрогену. При цьому концентрація кислоти зменшиться і стане рівною: с (СНзСООН) = 0,1 - 0001 = 0,099 моль/дмз, а солі -
збільшиться: с(СНзСООNа) = 0,1 + 0,001 = 0,101 моль/дмз;
В результаті рН розчину практично не зміниться.
Розрахуємо, як зміниться рН розчину, якщо до 1 дм3 буферного розчину додати 10-3 моль НС1. Хлоридна кислота - сильний електроліт:
НС1 = Н+ + С1-.
Аніони СHЗСОО-, що утворюються під час йонізації солі:

СН3СООNa = СН3СОО- +Na+.
з йонами гідрогену доданої кислоти утворюють слабку кислоту Н+ + СН3СОО - = СНзСООН
Розрахуємо концентрацію солі в такому розчині:
с(ВА) = 0,1 - 0,001 = 0,099 моль/дм3,
і кислоти с(НА) = 0,1 + 0,001 =0,101 моль∙л - 1.
Концентрація йонів гідрогену в буферному розчині, тобто рН розчину,
практично не зміниться. Розрахуємо, як зміниться рН буферного розчину під час розведення його в 100 разів:
При цьому розведенні рН буферного розчину не змінюється.
Таким чином, під час додавання до буферних розчинів невеликих кількостей кислоти або лугу і при їх розведенні рН практично не змінюється.
Проте це відбувається тільки при додаванні кислот і лугів у певних межах;
якщо їх додати багато, то буферні властивості зникають, оскільки буде перевищена буферна ємність розчину.
За одиницю буферної ємності суміші умовно приймають ємність такого розчину, для зміни рН якого на одиницю вимагається ввести 1 моль-еквівалент сильної кислоти або лугу на 1 дм3 буферного розчину.
Якщо буферна ємність розчину А більша від буферної ємності розчину В,
то це значить, що для зміни рН розчину на одну одиницю в розчин А необхідно додати більшу концентрацію кислоти або лугу, ніж у розчин В.
Якщо до буферного розчину, що має різну концентрацію компонентів,
додавати рівні кількості кислоти або лугу, то рН розчину змінюється в різному ступені.
Тепер проаналізуємо, як зміниться концентрація йонів Н3О+ і рН розчину після добавляння до нього сильної кислоти:
1. Обчислимо концентрацію йонів Гідрогену (формула 4,42) і рН

буферного розчину, враховуючи, що у ньому Скислот = Ссолі = 0,1 моль/дм3, Ка(СН3СООН)= 1,75∙10-5:
2. Обчислимо концентрацію йонів [Н3О+] і рН середовища після добавляння до буферного розчину сильної кислоти, наприклад, НС1, у
кількості 4∙10-2 моль/дм3. Врахуємо, що концентрація кислоти збільшиться і дорівнюватиме 0,1 + 0,04 = 0,14 моль/дм3, а солі - зменшиться відповідно на
0,04 моль/дм3 і становитиме 0,1 - 0,04 = 0,06 моль/дм3, оскільки катіони Н+
реагують з аніонами солі:
Отже, концентрація йонів Н3О+ і рН після додавання кислоти до буферного розчину змінилася незначною мірою (приблизно на 0,4 одиниці).
Якщо таку саму кількість кислоти добавити до чистої води, то концентрація йонів Гідрогену зміниться від 10-7 до 4∙10-2 моль/л, тобто у 400 000 разів, а рН зменшиться на 5,6 одиниці (від 7,0 до 1,4).
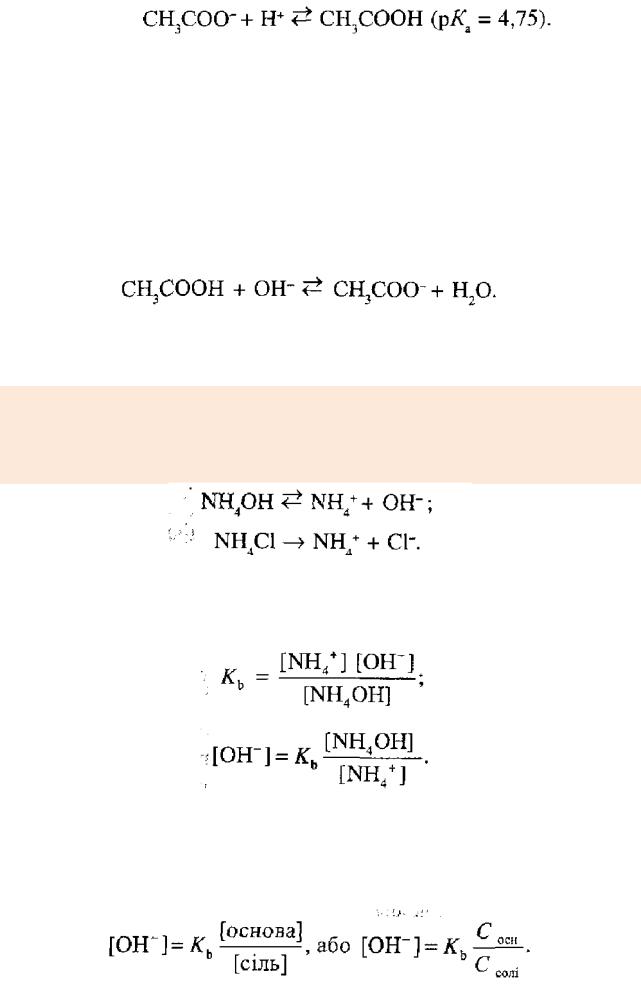
Механізм буферної дії ацетатного буферного розчину на основі теорії електролітичної дисоціації пояснюють так.
За рахунок часткової дисоціації кислоти і повної дисоціації солі в розчині будуть знаходитися одночасно йони СН3СОО_, Н+ і Na+:
Якщо до нього добавити сильної кислоти, то йони Гідрогену реагуватимуть з аніонами солі, утворюючи слабку ацетатну кислоту:
Як видно з наведеного рівняння, сильна кислота замінюється еквівалентною кількістю слабкої, причому за наявності однойменних йонів
(тобто ацетат-іонів СН3СОО-) рівновага процесу дисоціації кислоти зміщується вліво.
При добавлянні до цієї буферної суміші розчину лугу гідроксид-іони взаємодіятимуть з. йонами Н+ ацетатної кислоти з утворенням малодисоційованих молекул води:
Розглянемо рівноважні процеси в амонійному буферному розчині, який належить до основних буферних систем.
Амонійний буферний розчин (діапазон рН 8,4-10,3) складається із слабкої основи NН4ОН (NН3*Н2O), яка в розчині дисоціює частково, і солі
NН4Cl - дисоційованої повністю:
Запишемо вираз константи дисоціації для першої реакції і визначимо з нього концентрацію гідроксид-іонів;
Враховуючи те, що рівноважна концентрація недисоційованих молекул основи приблизно дорівнює початковій концентрації, а катіонів амонію -
концентрації солі, дістанемо:
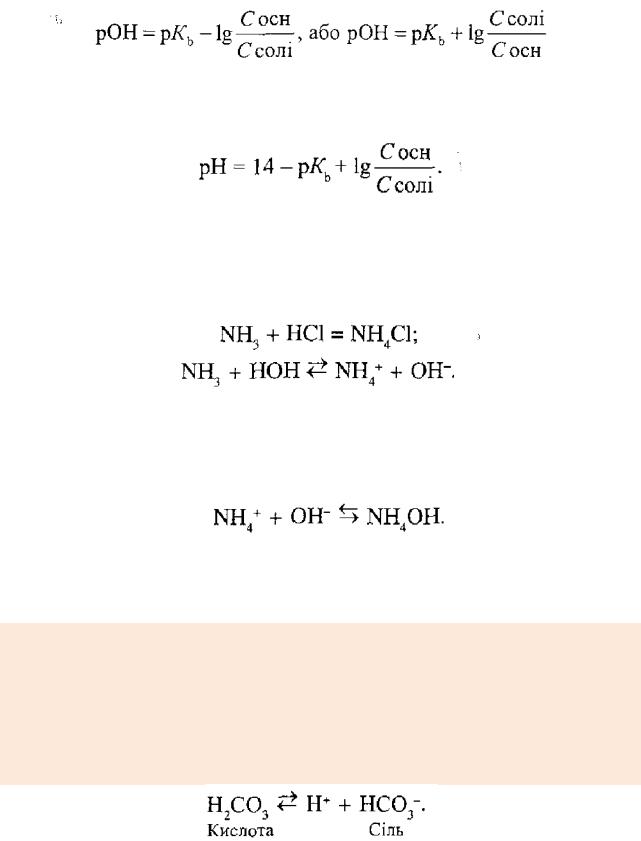
Взявши до уваги, що рОН = -lg[ОН_], після логарифмування рівняння
(4.44) матимемо:
Враховуючи, що рН = 14 - рОН, визначимо рН амонійного буферного розчину:
; |
Механізм буферної дії амонійної буферної системи пояснюють тим, що |
|
при добавлянні кислоти вона буде зв’язуватись з амоніаком, який у водному розчині існує в рівновазі з катіонами амонію:
При добавлянні лугу йони ОH- провзаємодіють з катіонами амонію,
внаслідок чого замість сильної основи утвориться еквівалентна кількість слабкої основи NН4ОН:
Отже, в обох випадках значення рН буферного розчину змінюється
незначною мірою.
Гідрогенкарбонатний буферний розчин (діапазон рН 6,0-8,0) є
складовою частиною буферних систем організму. Він містить суміш слабкої
карбонатної кислоти Н2СО3 та її кислої солі натрій гідрогенкарбонату NaНСO3.
Хімічну рівновагу між кислотою і сіллю у цій буферній системі виражають
рівнянням: ,
Це рівняння відповідає першій стадії дисоціації карбонатної кислоти.
Тому у формулу для обчислення рН буферного розчину входить перша
