
Коллоидная химия
.docxКоллоидная химия изучает свойства гетрогенных высокодисепрсных систем и высоко молекулярных веществ.
Дисперсной называют гетерогенную систему состоит из дисперсной фазы совокупности раздробленных частиц, равномерно распределенных в непрерывной дисперсионной среде.
Для характеристики раздробленности исп понятия:
Степень дисперсность-величина обратная среднему параметру системы.
Форм 1
Грубодисперсные системы-видимые в микроскоп частицы. Быстро оседают или всплывают
Колойдно-дисперсные системы. Диаметр частицы ---107-109м фильтруется через самые маленькие фильтры. Заметно не оседают.
Частицы проходят через все фильтры.
В зависимости от агрегатного состояния все системы можно разделить:
-
Дисперсная среда-газ, Аэрозоль.например:табачный дым.
-
Лиозоли-газ распределен в жизкости, (кислородный коктель)
-
Жидкость в жидкости
-
Твердое в жидком-суспензии.
-
Газ в твердом___например(пенза, твердые эмульсии, опал, жемчуг)
-
Твердое в твердом(цветные стекла)
По типу взаимодействия частиц дисперсной фазы:
-
Сводобно дисперсные системы-частицы фазы не связаны химическим взаим, но обладает текучестью
-
Связно дисперсные системы- в которой частицы фазы связаны между собой о образ сетки, решетки((напр гели:мозг, кожа, глазное яблоко, пасты, мембраны)
раствориться не могут, например коллойдные рры золота и серебра.
Методы получения дисперсных систем:
-
Диспергационные методы: механические, ультразвуковые, электродуговые и химические.(пептизация) например, при помощи шаровых мельниц загружают дисперсионную фазу и стабилизатор)
-
Коллоидные мельницы.жидкотсь получающие при помощи устроиства получающие уникальные своийства
Измельчение при помощи ультразвука: для получения золей золота и серебра: к электродам изготовленным из нужного ме, помещ их в нужную среду и материал эоектрода превращается в пар.
Пептизация заклячается во взаим веществ в определенные осадок.
Метод конденсации:
-
физическая конденсация( например, золь серы)
-
химическая конденсация-исп химические рции с образованием труднорастворимыйх веществ, например гидролиз)рцию надо проводить так, чтобы скорость образования частиц превышала скорость их роста.
Рекомендуется брать 1 разбавленны, один концентрации раствор.
Как устроена частица коллоидного или золя?
Agno3+kj-------Agj+ kno3
Оптические своиства исперсных систем
Видимый свет λ 3,8*10-7
Истинные растворители прозрачные
А у золя набл рассеивание. Некоторые коллойдные рры наблюдают явление свечения(для минерала «лунный камень» или наблядается конус тиндаля(в темной комнате на пучок света ставят раствор, луч проходящего света становится видимым, это и есть оптические своиства дисперсных систем)
Как устроена частица золя(мицелла)- в мицелле различеют агрегат---кристал труднорастворимого вещества, может иметь аморфное состояное. Агрегатом является agj абсорбируются ионы.
Агрегат ионы образуют ядро мицеллы(заряжено отрицательно-потенциал, оперделяющий ионы)
Ионы образую плотный слой противоионов. С абсобционным слоем образуют гранулу. Ионы абсорбционного слоя не полностью компенсируют заряд ядра. В нашем случаем гранула заряжена отицательно. Есть ионы плохо связаны, они образуют плотный слой диффузнфх ионов. Все это называется мицелла.
Противоионы----------(n-x)K+ связанные
Между ионом и ядром образуется 2 электрический слой.
По мере удаления от ядра убывает. Здесь проходит плоскость скольжения то есть к золи подключ источник пост тока,то гранула пойдет к аноду.
Потенциал возникающий на границе сколтьжения обуславливает скорость движения гранулы
Электро кинетический потенциал.
Чем больше электрокинетически потенциал, тем устойчивей коллойдный раствор.
Рис 1
Методы очистки растворов :
-
фильтрация:метод диалица. Мембрана пропускает электролиты но не пропускает коллоидные частицы.
Коагуляция коллидных растворов.
Важнейшим своиством золей является их устоичивость, то есть
Устойчивость:
-
характеризует распределение фазы. Кинетическая устоичивость. Кинетическая устоичивость оперделяется размерностью частиц или дисперсией. Сила тяжести действующее на частицу .
частота стлкневения таких частиц не велика.
-
Агрегативная-характеризуется способность дисперсной фазы сохранять размерность частиц. Потеря агрегативной устойчивости называется коагуляция .
В результате столкновения частиц происходит выдавливание частиц, наблядается расслоение. Более тяжелые частицы фазы оседают на дно.
Для жидкости сливание капель называется коалисценция. На стадии диссоциации происходит петптизация.
Коагуляция вызывается действием электролитов и неэлектролитов, облучением, действием электрического тока и другие факторы.
Коагуляция под действием лектролитов происходит изменение толщины двойного электрического слоя. Коагулирующим действием обладают ионы, противоположные зарядом гранулы. Если гранула заряжена отрицательно, то коагуляцию вызывает добавление катионов, если положительно, то коагулирующим действием обладают анионы.
Противоионный слой загоняют диффузный слой. Потенциал уменьшается, гранула теряет свой разряд.
Столкновение незаряженных частиц приводити к их слипанию. Внешних изменений не проихошо, но меняются осмос, скорость диффузии,интенсивность светорассеивания. Только физикозимческими методами можно заметить коагуляцию. Порог коагуляции электролита. Коагулирующая способность.
От чего зависит величина способности коагуляции. Правило 6-ой степени.
Ск1: Ск: Ск: Ск: Ск= (1/1)6 : (1/2)6 : и т д.
Коагуляция имеет большое значение для жизнедеятельнотси, например, физраствор.
Стабилизировать коолоиды нужно активными веществами.
Золотые числа-число мг вещества защиты 10 мл золя от коагуляции от 1 мл 10% nacl/ хорошей защитой является желатин и гемоглобин.
Можно ли предсказат какой золь будет устойчивым, а какой будет коагулироваться.
Величина электрокинетического потенциала.
Вязксть=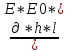
Свойства растворов высокомолекулярных соединений.
Только размеры роднят их с коллоидами. ВМС встречаются в природе и могут получаться химическим путем:
-
Искусственные
-
Синтетические(из низко молекулярных соединений)
-
Пластмассы
-
Эластомеры
-
Волокна
Мономером называется низкомолекулярные вещества, из которых образуются макромолекулы.
Степень полимеризации-число, показывающее, сколько молекул мономеров содержится в данной молекуле. По строению различают :
А.) линейные
Б.)разветвленные
В)сетчатые-имеют трехмерную сетку. По принадлежности к органическим и неорганическим полимерам различают металлоорганические, гомополимеры(одно и то же вещество), гетерополимеры.
Белок, нуклеиновые кислоты. Разны мономеры входят в состав.
Сополимеры-в полимер входят соединения из другого ВМС.
Гомоцепные.-полиэтилен-основная цепь содержит только атомы углерода. Так же входит еще азот. Интересными своиством является ррение полимеров (идет не так, как ррение низко молекулярных веществ )
Истинному рению полимеров предшествует набухание- самопризвольный процесс, поглощение обемов жидкости, сопровождающися изменением размеров системы.
Первым процессом набухания идет высокомолекулярного соединения .
Набухание имеет важное значение: на набухание влияют электролиты и даже рН.
Влияние температуры-скорость больше, а объем меньше
Влиание рН-минимальное набухание в изоэлектрической точке.
