
гиста / Эмбриология, тератология и основы репродукции человека _ В.Н. Запорожан, В.К. Напханюк, Е.Л. Холодкова. - О._ ОГМУ, 2000. - 378 с
.pdfми факторами, 3) иммунологическое, 4) трубное, 5) перитонеальное, 6) бесплодие неясного генеза.
Эндокринное бесплодие — такое состояние женского организма, когда в результате патологического изменения функции желез внутренней секреции нарушается процесс овуляции. Вследствие этого возникает неспособность яйцеклетки к оплодотворению, недостаточность секреторных преобразований в эндометрии, которые делают невозможной имплантацию плодного яйца. Удельный вес эндокринных форм бесплодия состав-
ляет 20–50 %.
По классификации ВОЗ (1992) на основе патогенеза выделены следующие группы расстройств овуляции:
1группа — гипоталамо-гипофизарная недостаточность, при которой наблюдается недоразвитие гениталий, аменорея, резкое снижение уровня ФСГ, ЛГ, эстрогенов;
2группа — гипоталамо-гипофизарная дисфункция с различными нарушениями менструального цикла (ановуляторные циклы, недостаточность лютеиновой фазы, аменорея), значительно повышенным содержанием эстрогенов и низким уровнем ГТГ и пролактина; к этой же группе относятся больные со склерокистозными яичниками;
3группа — яичниковая недостаточность, характеризующаяся аменореей на фоне значительного снижения уровня эстрогенов, угнетения выработки прогестерона при повышенной экскреции ГТГ;
4группа — врожденные и приобретенные нарушения половой системы, такие как облитерация полости матки в результате аборта, замещение эндометрия соединительной тканью, при которых нарушается трофическая функция нервных элементов, что в дальнейшем способствует развитию патологического процесса в эндокринной и высших отделах нервной систем;
5группа — гиперпролактинемия при наличии опухоли в ги- поталамо-гипофизарной области, вследствие чего в гипоталамусе не образуется пролактин-ингибирующий фактор и необходимое количество рилизинг-гормонов, что приводит к повышенной секреции пролактина и низкой ГТГ;
6группа — гиперпролактинемия без поражения гипотала- мо-гипофизарной области у женщин с различными расстройствами менструального цикла, четким продуцированием эстрогенов яичникового происхождения и повышенным уровнем пролактина;
359
7 группа — аменорея при опухоли в гипоталамо-гипофизар- ной области, снижение выработки пролактин-ингибирующего фактора, рилизинг-гормонов, ГТГ, вторичным снижением уровня эстрогенов и подавлением овуляции на фоне нормальной выработки пролактина.
Эндокринное бесплодие может быть обусловлено поражением коры надпочечников, опухолевым процессом или врожденной гиперплазией щитовидной железы, сахарным диабетом, хроническими инфекциями, интоксикациями, гипо- и авитаминозом, профессиональными вредностями, нарушением обмена веществ, алкоголизмом, злоупотреблением курением, нейрогенными расстройствами.
В развитии эндокринного бесплодия большое значение имеет недостаточность функции желтого тела. При этом уменьшается количество прогестерона в организме, что вызывает спазм маточных труб, нарушение их перистальтики, процесса транспорта яйцеклетки из яичника в матку, в которой отсутствует фаза секреции.
Возможность нормальной репродукции у большинства здоровых фертильных женщин существует благодаря наличию иммунологических барьеров, а также действию иммуносупрессивных факторов и специальных иммунорегулирующих механизмов тканей репродуктивной системы на всех ее уровнях. Общепринята точка зрения о том, что иммунные формы бесплодия, удельный вес которых среди всех видов бесплодия составляет около 10 %, в основном, обусловлены возникновением антиспермальных антител, чаще у мужчин и значительно реже у женщин. В женском организме также могут формироваться антитела к гормону беременности — хорионическому гонадотропину, к фосфолипидам мембран, гликопротеидам блестящей оболочки и даже эндогенным ЛГ и ФСГ и рецепторам к ним. Антисперматозоидный иммунитет может проявляться следующими реакциями: 1) возникновением гуморальных антител; 2) образованием тканевых антител; 3) усиленным фагоцитозом сперматозоидов сенсибилизированными моноцитами в шейке и полости матки; 4) отсроченной реакцией сенсибилизации в виде торможения имплантации бластоцисты или ее разрушения вследствие аллергической реакции, возникшей из-за контакта сперматозоидов с сенсибилизированной тканью полости матки; 5) выбросом эякулята из сенсибилизированной к сперме полости матки путем ее усиленных сокращений. Эти
360
реакции могут быть спровоцированы действием факторов, усиливающих иммунную агрессию эякулята. К ним относятся: инфекция во влагалище, имеющая собственную антигенную активность, наличие в эякуляте инфекции или лимфоцитов, усиливающих сенсибилизацию женского организма к эякуляту, а также присутствие в эякуляте таких иммуносупрессоров, как IgE и фракции гликопротеинов. Из перечисленных выше видов иммунных реакций женского организма основную роль играет локальный иммунитет, причем шейка матки является основным звеном местного иммунитета, а эндометрий и маточные трубы обладают этими свойствами в значительно меньшей степени.
Известно, что значительная обсемененность эякулята бактериями, особенно кишечной палочкой, вызывает агглютинацию сперматозоидов. Кроме того, генитальная инфекция, например, эпидидимит, может привести к частичной обструкции семявыносящего протока и застою спермы в сети яичка.
Существует также гипотеза о том, что в семенной плазме содержатся ингибины иммунного ответа, т. е. вещества, тормозящие реакцию женских половых органов на сперматозоиды. У некоторых мужчин возможно нарушение секреции этих ингибинов в связи с инфекцией, травмой или по другим причинам. Отсутствие ингибинов приводит к усилению иммунной реакции на эякулят.
Клиническая диагностика иммунного фактора бесплодия достаточно сложная. Этот фактор часто сочетается с другими, хотя может быть и изолированным.
Группу бесплодия, обусловленного преимущественно анатомическими изменениями в половой системе, составляют женщины с различной патологией, сопровождающейся анатомофункциональной недостаточностью. Для выявления анатомических изменений используют гистеросальпингографию, ультразвуковое исследование. Окончательный вывод о наличии пороков развития или анатомических изменениях органов малого таза можно сделать на основании лапароскопии и гистероскопического исследования. Гистероскопия также позволяет выявить гиперплазию эндометрия, полипоз, аденомиоз, внутриматочные синехии, подслизистые миоматозные узлы.
К перитонеальной форме относится бесплодие, обусловленное наличием перитубарных спаек при проходимых маточных трубах и отсутствии других факторов, приводящих к наруше-
361
нию репродуктивной функции у женщин. Как изолированную причину бесплодия перитубарные спайки обнаруживают у 14 % больных, длительно и безрезультатно лечившихся консервативными методами. Как сопутствующий при хроническом сальпингите перитонеальный фактор обнаруживается в 40 % случаев. Он вызывает нарушение репродуктивной функции вследствие изменения анатомических соотношений фимбриальных отделов маточных труб и яичников, в результате чего затрудняется захват яйцеклетки фимбриями трубы с поверхности яичника. К возникновению перитубарных спаек предрасполагают перенесенные воспалительные заболевания половых органов, спонтанные и самопроизвольные аборты, оперативные вмешательства на органах брюшной полости, аллергические заболевания, а также врачебные манипуляции инвазивного характера, в первую очередь, лечебные гидротубации, диагностические выскабливания и повторные гистеросальпингографии.
Удельный вес трубного бесплодия составляет 30–45 %. Причинами его являются полное или частичное нарушение проходимости маточных труб в результате воспалительного процесса различной этиологии или врожденных аномалий, а также резкое нарушение захвата и перемещения яйцеклетки трубой на почве дисфункции системы гипоталамус – гипофиз – яичники, кроме того — в результате перитубарных изменений. Большинство женщин с непроходимостью труб перенесли воспаление, изолированное или сочетанное с заболеваниями других органов половой системы. При поражении маточных труб хламидиозом образуются значительные анатомические изменения. В ряде случаев после аборта в результате асептического деструктивного процесса могут возникать рубцовые изменения маточных труб. Независимо от типа инфекции и пути ее попадания в трубы поражаются преимущественно ампулярные отделы. Это объясняется особенностями кровоснабжения этих отделов по типу венозных лакун и артериовенозных анастомозов, а также преобладанием реснитчатого эпителия, неустойчивого к повреждающим факторам. Выраженный воспалительный процесс в ампулярных отделах труб приводит к слипанию фимбрий в местах гибели реснитчатого эпителия, а затем к рубцеванию. Возникают грубые анатомические изменения труб по типу мешотчатых воспалительных псевдоопухолей — гидросальпинксов, что приводит к повышению давления в зам-
362
кнутой полости маточной трубы и прогрессирующей атрофии реснитчатых клеток.
Бесплодие неясной этиологии диагностируется при условии фертильности супруга, положительном посткоитальном тесте, проходимых маточных трубах у женщин с регулярными овуляторными менструальными циклами. Частота необъяснимого бесплодия по данным разных клиник колеблется от 5 до 40 %. Приблизительно у 40 % больных отмечается тенденция
кувеличению содержания пролактина в плазме, что приводит
кнарушению функции коры надпочечников и гиперсекреции андрогенов. Последнее, в свою очередь, обусловливает появление нерезко выраженных признаков гирсутизма с повышением гормональной фракции гирсутного числа. Эти отклонения приводят к нарушению функций маточных труб при отсутствии каких-либо анатомических изменений.
Как у женщин, так и у мужчин бесплодие может быть обусловлено не одним, а несколькими факторами. У женщин чаще всего встречается сочетание нарушения ритма менструаций с ановуляцией и поствоспалительными изменениями по типу хронического сальпингита с нарушением проходимости маточных труб (перитонеальное бесплодие). Перенесенные в анамнезе воспалительные процессы часто обусловливают сочетание трубного и перитонеального факторов.
Умужчин из-за нарушения симпатической иннервации мочеполового тракта расстройства эякуляции нередко сочетаются с системными нейроэндокринными заболеваниями, чаще всего с диабетом. Очень часто инфекции предстательной железы обнаруживаются в комбинации с расстройствами потенции. Хронические воспалительные заболевания половых органов зачастую комбинируются с варикоцеле и иммунологическим фактором бесплодия.
Характер половых расстройств, вызваных психоэмоциональными причинами довольно сложен. Изменения происходят не только в центральных регулирующих звеньях нервной системы, но и в самих гонадах. Доказано, что люди с неустойчивой психикой, неуверенные в себе, слабохарактерные, находящиеся под психологическим давлением членов семьи или окружающих, могут отставать в половом развитии. Если неблагоприятная обстановка возникает в детстве или пубертатном периоде, то у таких подростков развиваются нарушения овуляции, сперматогенеза и стероидогенеза в гонадах, что в даль-
363

нейшем приводит к нарушению имплантации или ранним спонтанным абортам, а также снижению потенции.
4.3. ВСПОМОГАТЕЛЬНЫЕ РЕПРОДУКТИВНЫЕ ТЕХНОЛОГИИ
Достижения современной экспериментальной эмбриологии дали возможность разработать принципиально новые технологии, используемые в репродукции человека. В настоящее время существуют различные методы вспомогательной репродукции, определены показания к их использованию.
Одним из наиболее распространенных методов является искусственная инсеминация спермой мужа или донора. Показаниями к использованию этой процедуры при мужском факторе бесплодия являются гипоспадия, неспособность по какимлибо причинам совершить половой акт, олиго-, астено- и тератозооспермия в различных сочетаниях, аспермия, ретроградная эякуляция. К женским факторам при искусственной инсеминации относят анатомические изменения шейки матки, препятствующие проникновению сперматозоидов, стойкий вагинизм, непроницаемость цервикальной слизи, в том числе обусловленная антиспермальными антителами, при этом обязательно наличие нормальных овуляций и проходимости маточных труб. В случаях тяжелых наследственных заболеваний супруга, резус-конфликта используют сперму донора. Противопоказаниями к искусственной инсеминации являются острые и хронические заболевания половых органов, эрозии шейки матки различной этиологии.
Более 20 лет успешно используется и совершенствуется ме-
тод экстракорпорального оплодотворения (ЭКО), при котором производят стимуляцию суперовуляции, забор ооцитов и сперматозоидов, их культивирование в специальных питательных средах, получение эмбрионов, а затем подсадку эмбрионов в полость матки. Технология ЭКО достаточно сложная и требует специального дорогостоящего оборудования, реактивов, а главное — высококвалифицированных специалистов. Абсолютным показанием к использованию ЭКО является трубное бесплодие вследствие непроходимости или отсутствия маточ-
364
ных труб; относительными — частичная непроходимость труб
иотсутствие беременности в течение года после операции на трубах, некоторые формы эндометриоза, бесплодие неясного генеза, иммунологическое бесплодие при постоянно высоком уровне антиспермальных антител, значительная олигоастенозооспермия, а также отсутствие положительного результата при 3–4 циклах внутриматочной инсеминации. Противопоказанием к ЭКО являются доминантно-наследуемые заболевания
иналичие нарушений, препятствующих наступлению и сохранению беременности: отсутствие полноценной функциональной активности матки, нечувствительность яичников к эндо- и экзогенной гормональной стимуляции, новообразования половых органов, воспалительные и анатомические изменения в органах малого таза.
Процедура ЭКО и переноса эмбрионов (ПЭ) состоит из пяти основных этапов: стимуляции суперовуляции, пункции яичников, оплодотворения яйцеклеток «в пробирке», культивирования оплодотворенных яйцеклеток и подсадки 4–6 клеточного эмбриона в полость матки.
Впоследнее время эта методика модифицирована, что позволяет увеличить время культивирования до 72–96 ч. и переносить зародыш в матку на стадии бластоцисты, таким образом неполноценные зародыши элиминируются еще до ПЭ, а вероятность успеха процедуры повышается.
Достаточно широко в лечении бесплодия применяется мето-
дика подсадки гамет в маточные трубы. В этом случае тре-
тий, четвертый и пятый этапы ЭКО происходят не в пробирке, а в наиболее физиологических условиях маточной трубы. Метод достаточно эффективен при бесплодии неясного генеза, эндометриозе, низком качестве спермы.
Новой ступенью в лечении мужского бесплодия стала инт-
рацитоплазматическая инъекция сперматозоида в яйцеклетку.
При этой процедуре единичные сперматозоиды вводятся с помощью микроманипуляторов либо непосредственно в ооплазму яйцеклетки, либо под блестящую оболочку. Затем эмбрионы культивируются в специальных питательных средах и переносятся в полость матки. Эта методика позволяет использовать сперматозоиды, полученные при помощи биопсии яичка или его придатка.
Одним из методов вспомогательной репродукции является так называемое суррогатное материнство. Данный метод ис-
365
пользуется в тех случаях, когда у «генетической матери» значительно недоразвита или отсутствует матка, но яичники функционируют нормально. Оплодотворение in vitro извлеченных из них яйцеклеток сперматозоидами мужа обеспечивает формирование «генетического» для этой пары эмбриона, который и переносится в матку суррогатной матери. В настоящее время таким способом зачаты и рождены тысячи детей, хотя дискуссии об этических проблемах суррогатного материнства продолжаются.
Техника проведения вспомогательных методов репродукции
Искусственная инсеминация
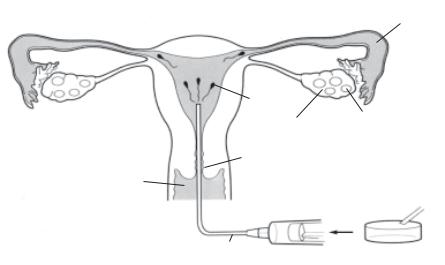
Инсеминацию выполняют амбулаторно, как правило, в течение 3 менструальных циклов в периовуляторный период (12–15-й дни при 28-дневном цикле), предпочтительно дважды в цикл. Сперму, полученную путем мастурбации после 3–5-дневного воздержания, собирают в стерильный контейнер и оставляют на 3–4 часа для разжижения, затем дважды центрифугируют с добавлением питательной среды. После 20-ми- нутной флотации при комнатной температуре обогащенную и концентрированную сперму в объеме не более 1 мл через специальный катетер вводят в полость матки (рис. 4.3.1). Для определения возникновения беременности используют измерение концентрации в крови β-субъединицы хорионического гонадотропина.
Для проведения этой методики может также использоваться криоконсервированная или донорская сперма.
Экстракорпоральное оплодотворение
Эта методика состоит из 5 этапов:
1.Стимуляция суперовуляции и созревание нескольких (до
20)фолликулов.
Для того, чтобы получить несколько зрелых яйцеклеток, по разным схемам проводится контролируемая гиперстимуляция яичников. Тем не менее, существуют основные принципы проведения стимуляции суперовуляции. Они включают введение антиэстрогенных препаратов (кломифенцитрат, кломид, кло-
366
маточные
трубы
сперматозоиды
яичник |
фолликулы |
|
|
в яичнике |
|
шейка матки |
|
|
влагалище |
подготовлен- |
|
ный образец |
||
|
||
|
спермы |
катетер
Рис. 4.3.1. Схема проведения внутриматочной инсеминации
стилбегит, тамоксифен), менопаузального гонадотропина или препаратов фолликулостимулирующего гормона. Перед назначением гонадотропина предварительно вводят агонисты гона- дотропин-рилизинг гормона (аГРГ) для десенситизации гипофиза, с целью уменьшения риска преждевременного спонтанного выброса ЛГ. Это снижает вероятность преждевременной овуляции недостаточно зрелых фолликулов.
Антигонадотропный гормон обычно назначают в середине или конце лютеиновой фазы или в самом начале фолликулиновой фазы и продолжают до назначения чХГ. Подтверждением десенситизации гипофиза служит снижение концентрации сывороточного эстрадиола до уровня, не превышающего 150 пмоль/л. Время, необходимое для достижения десенситизации гипофиза, зависит от того, какой препарат применялся (обычно от 8 до 17 дней). Лечение ФСГ можно начинать, если при ультразвуковом контроле подтверждено отсутствие активности фолликулов. Дозу ФСГ следует назначать индивидуально для каждого пациента. Когда при ультразвуковом исследовании будет определено увеличение толщины эндометрия и наличие фолликулов диаметром более 14 мм, необходимо измерить концентрацию эстрадиола в сыворотке, и продолжать введение такой же дозы препарата. Ультразвуковой монито-
367

ринг необходимо проводить каждые 1–2 дня. Лечение следует корректировать до появления признаков роста фолликулов и увеличения толщины эндометрия. Когда самый большой фолликул достигнет, по крайней мере, 18 мм в диаметре, не менее двух других — диаметра более 14 мм, а толщина слоя эндометрия — 8 мм и более, назначают чХГ.
2.Получение нескольких зрелых яйцеклеток путем трансвагинальной пункции яичников.
Спустя 32–35 часов после применения чХГ трансвагинальным катетером под контролем ультразвука производят чрезвлагалищную пункцию яичников с целью аспирации содержимого фолликулов и отбора яйцеклеток.
3.Оплодотворение яйцеклеток обогащенной спермой мужа или донора.
Ооциты помещают в специальную питательную среду и оставляют в инкубаторе. Через 3–4 часа к ним добавляют обработанную так же, как для инсеминации сперму из расчета 50– 100 тыс. сп-дов/мл/ооцит. Более высокая концентрация может стать причиной полиспермии — проникновения в яйцеклетку нескольких сперматозоидов и образования зиготы с несколькими пронуклеусами, что приводит к гибели зародыша на ранних стадиях развития или формированию зародыша с аномальным кариотипом.
аспираци- |
подготовлен- |
эмбрионы |
|
||
онная игла |
|
|
ный образец |
|
|
|
|
|
|
спермы |
|
яйцеклетки |
|
|
|
оплодотворение |
|
катетер
Рис. 4.3.2. Схема проведения экстракорпорального оплодотворения
368
