
Тести з хімії 2
.pdf
2.35.Яке рівняння є математичним виразом закону дії мас для реакції окиснення сульфур(ІV) оксиду?
А. J = k[SO2] + [O2]
B.J = k[SO3]
C.J = [SО2] [O2]
D.J = [SO2] [O2]2
E.J = k[SO2]2 [O2]
2.36.Яка реакція відбулася з найбільшою швидкістю, якщо за однаковий проміжок часу утворилось по 3,0 г продуктів?
I. ½H |
|
+ ½Cl |
|
= HCl |
||||
2(г) |
|
2(г) |
|
|
|
(г) |
||
II. H |
+ ½O |
= H O |
(г) |
|||||
2(г) |
|
|
2(г) |
|
|
2 |
||
III. ½H |
|
+ ½F |
|
|
= HF |
(г) |
||
|
2(г) |
2(г) |
|
|
||||
А. швидкість була однаковою
B.III
C.II
D.I
E.–
2.37.Яка з наведених реакцій відбувається з найбільшою швидкістю?
А. 2NH3 ¾t ® N2 + 3H2
B.Ва(OH)2 + 2HCl = ВаCl2 + 2H2O
C.2SO2+ O2 = 2SO3
D.(C6H10O5)n + nH2O
+
¾H¾¾, t ® nC6H12O6
E.2C2H5OH ¾¾®Kt (C2H5)2O + H2O
2.38.Яке рівняння є математичним виразом закону дії мас для реакції окиснення карбон(II) оксиду?
А. J = k[CO]2×[O2]
B.J= k[2CO] ×[O2]
C.J = [CO]2×[O2]
D.J = k[CO2]2
E.J = [CО]× [O2]
2.39.До зростання швидкості реакції у гетерогенних системах призводить:
А. охолодження
B.опромінення
C.збільшення поверхні поділу
21
фаз
D.усі названі способи
E.зменшення концентрації реактантів
2.40.Миттєву швидкість хімічної реакції визначають за рівнянням:
υ= c2
τ2 -τ1
B.υ = - DDτc
C.υ = tg α
D.υ = kc
E.υ = Dτc
2.41.Яке рівняння є математичним виразом закону дії мас для реакції− c1А.
С(гр) + СО2(г) = 2СО(г) ?
А. ϑ = k [С] [СO2]
B.ϑ = k [СO2]
C.ϑ = k[С] [СO]
D.ϑ = k[СО2]
E.ϑ = k[С]
2.42.Яке рівняння є математичним виразом закону дії мас для реакції
Н2О(г) + СО(г) = СО2(г) +Н2(г)?
А. ϑ = k ([Н2О ] + [СO])
B.ϑ = k [Н2 ] [СO2]
C.ϑ = k [СO]
D.ϑ = [Н2О ] [СO]
E.ϑ = k[Н2О ] [СO]
2.43.Укажіть правильний математичний вираз закону дії мас для реакції
N2(г) + 3Н2(г) = 2NH3(г)
А. ϑ = k[NH3 ]2
B.ϑ = 2[N2 ] 3[H2]
C.ϑ = k[N2 ] [H2]3
D.ϑ = [N2 ] [H2]3
E.ϑ = k[N2 ]+ [H2]3
2.44.Як називають основний закон хімічної кінетики?
А. законом збереження маси речовини
B.законом сталості складу
C.законом дії мас
D.законом еквівалентів
E.законом розведення Оствальда
2.45.У якому випадку в рівнянні
ϑ = − |
C |
, що є математичним |
|
τ |
|
виразом середньої швидкості хімічної реакції, ставимо знак ” мінус”?
А. його треба ставити завжди
B.коли швидкість визначаємо за зміною концентрації продуктів
C.його ставимо, якщо зміна концентрацій продукту незначна
D.коли швидкість визначаємо за зміною концентрації вихідних речовин
E.його ставимо, якщо зміна концентрацій у процесі реакції велика
2.46.Від зміни яких чинників залежить константа швидкості реакції?
1.від зміни тиску
2.від зміни температури
3.від зміни об’ єму
4.реакційного середовища
5.від введення каталізатора
6.від зміни концентрації реагуючих речовин
А. 1, 2, 3
B.3, 4, 5
C.2, 4
D.2, 5
E.1, 3
2.47.Як зміниться швидкість гомогенної реакції
2SO2 + O2 = 2SO3,
якщо концентрації вихідних речовин збільшити в два рази?
22
А. зросте в 4 рази
B.зросте в 16 разів
C.зросте в 2 рази
D.зросте в 12 разів
E.зросте у 8 разів
2.48.Якщо в системі, де відбувається
реакція 2Fe(к) + 3Cl2(г) = 2FeCl3(к),
тиск зменшити в 3 рази, то швидкість реакції:
А. зменшиться в 9 разів
B.зменшиться в 27 разів
C.не зміниться
D.збільшиться в 27 разів
E.збільшиться в 9 разів
2.49.У скільки разів слід підвищити тиск, щоб швидкість утворення
NO2 за реакцією 2NO + O2 → 2NO2 зросла в 1000 разів?
А. у 100 разів
B.у 10 разів
C.у 20 разів
D.у 50 разів
E.у 5 разів
2.50.У скільки разів зростає швидкість більшості хімічних реакцій при підвищенні температури на кожні 10 градусів?
А. у 2 – 3 рази
B.у 2 рази
C.у 3 рази
D.у 2 – 4 рази
E.у 4 рази
2.51.Головну роль у збільшенні швидкості реакції при підвищенні температури відіграє:
А. збільшення загального числа зіткнень між молекулами
B.зростання кінетичної енергії молекул
C.збільшення швидкості руху молекул
D.зменшення енергії активації
E.зростання частки активних молекул
2.52.Як зміниться швидкість реакції окиснення нітроген(ІІ) оксиду,
якщо об’ єм системи зменшити у 2 |
кість реакції зросла у 32 рази, як- |
||
рази? |
що γ = 2,0 |
||
А. |
зменшиться у 4 рази |
А. |
на 80 ˚С |
B. |
збільшиться у 8 разів |
B. на 40 ˚С |
|
C. |
збільшиться у 16 разів |
C. на 60 ˚С |
|
D. |
збільшиться у 4 разів |
D. на 50 ˚С |
|
E. |
зменшиться у 16 разів |
E. на 70 ˚С |
|
2.53.Як треба змінити концентрацію 2.58. У скільки разів необхідно підви-
карбон(ІІ) оксиду в реакції |
щити тиск, щоб швидкість утво- |
||||
2СО(г) = СО2(г) + С(г), |
рення NO2 за реакцією |
||||
щоб її швидкість збільшилась у 9 |
2NO + O2 → 2NO2 |
||||
разів? |
|
|
зросла в 125 разів? |
||
А. збільшити у |
5разів |
А. у 50 |
разів |
||
B. збільшити у |
3 |
рази |
B. у 25 |
разів |
|
C. збільшити у |
2 |
рази |
C. у 15 |
разів |
|
D. збільшити у |
6 |
разів |
D. у 5 разів |
|
|
E. збільшити у |
4 |
рази |
E. у 10 |
разів |
|
2.54. Обчисліть температурний коефіці- |
2.59. Як зміниться швидкість реакції |
||||
єнт реакції, якщо за температури |
між карбон(ІІ) оксидом і киснем, |
||||
80˚С вона закінчується за 320 с, а |
якщо концентрацію вихідних ре- |
||||
за 110˚С – за 40с. |
|
|
човин збільшити в 3 рази? |
||
А. γ = 2,5 |
|
|
А. зросте у |
27разів |
|
B. γ = 2 |
|
|
B. зросте у |
3 рази |
|
C. γ = 3 |
|
|
C. не зміниться |
||
D. γ = 3,2 |
|
|
D. зросте у |
6 разів |
|
E. γ = 2,8 |
|
|
E. зросте у |
9 разів |
|
2.55.За температури 40˚ С реакція від- 2.60. На скільки градусів потрібно під-
бувається за 160 с (γ = 3), а за тем- |
вищити температуру, щоб швид- |
||
ператури 60˚ С ця реакція закін- |
кість реакції зросла у 90 разів, |
||
читься за: |
якщо γ = 2,7? |
||
А. |
20 с |
А. |
на 20˚С |
B. |
60 с |
B. на 75˚С |
|
C. |
30 с |
C. на 60˚С |
|
D. |
0,3 с |
D. на 55˚С |
|
E. |
10 с |
E. на 45˚С |
|
2.56.У скільки разів зростає швидкість 2.61. Укажіть правильний математич-
більшості реакцій при підвищенні температури на кожні 10 градусів? А. у 3 рази
B.у 2–4 рази
C.у 4 рази
D.у 2–3 рази
E.у 2 рази
2.57.На скільки градусів потрібно підвищити температуру, щоб швид-
23
ний вираз закону дії мас для реакції
СаСО3(к) → СаО(к) + СО2(г)
А. ϑ = k
B.ϑ = k[СаСО3 ]
C.ϑ = k[СаО] + [СO2]
D.ϑ = [СаСО3 ]
E.ϑ = k[СаО ][СO2]
2.62.Обчисліть значення константи
швидкості реакції типу А + В = АВ, якщо при концентраціях речовин А
іВ, що відповідно дорівнюють 0,5
і0,1 моль/л швидкість реакції становила 5ּ10–3 моль/(лּхв).
А. k = 100
B.k = 0,1
C.k = 100
D.k = 0,05
E.k = 1ּ10– 2
2.63.У реакторі, де відбувається взає-
модія за рівнянням СО + Сl2 = COCl2, концентрацію СО збільшили від 0,3 до 1,2 моль/л, а Сl2 – від 0,2 до 0,6 моль/л. У скільки разів зросла швидкість прямої реакції? А. у 26 разів
B.у 8 разів
C.у 18 разів
D.у 12 разів
E.у 16 разів
2.64.При підвищенні температури від 120 до 150˚ С швидкість хімічної реакції зросла у 27 разів. Знайти температурний коефіцієнт швидкості реакції.
А. γ = 3,2
B.γ = 3
C.γ = 2,8
D.γ = 3,6
E.γ = 2,1
2.65.У скільки разів збільшиться швидкість реакції при підвищенні температури на 40˚ С, якщо при підвищенні температури на 10˚ С її швидкість зростає у три рази?
А. у 9 раз
B.у 3 рази
C.у 27 раз
D.у 18 разів
E.у 81 раз
2.66.Як зміниться швидкість реакції
2NO + Cl2 = 2NOCl,
якщо тиск у системі збільшити у 4 рази?
А. збільшиться у 16 рази
24
B.збільшиться у 64 рази
C.зменшиться у 16 разів
D.зменшиться у 64 рази
E.не зміниться
2.67.У скільки разів необхідно збільшити концентрацію хлору у системі
2Al(к) + 3Cl2(г) = 2AlCl3(к),
щоб швидкість реакції збільшилась у 64 рази?
А. у 4 рази
B.у 2 рази
C.у 10 разів
D.у 6 разів
E.у 8 разів
2.68.Як зміниться швидкість реакції
2Fe(к) + 3Cl2(г) = 2FeCl3(к),
якщо тиск у системі збільшити у 3 рази?
А. збільшиться у 9 разів
B.збільшиться у 27 разів
C.зменшиться у 27разів
D.збільшиться у 3 рази
E.зменшиться у 9 разів
2.69.При охолодженні системи, де відбувається реакція
2NO + О2 = 2NO2
від 80 до 40˚С швидкість реакції зменшилась у 250 разів. Знайти температурний коефіцієнт швидкості реакції.
А. γ = 4,0
B.γ = 2,3
C.γ = 2,8
D.γ = 3,6
E.γ = 3,0
2.70.Якщо в реакції
NH3 + HCl = NH4Cl
початкова концентрація HCl дорівнювала 0,65 моль/л, а через 0,2 с стала 0,25 моль/л, то середня швидкість цієї реакції становила:
А. 0,04 моль/(лּс)
B.0,02 моль/(лּс)
C.2 моль/(лּс)
D.0,1 моль/(лּс)
E.0,2 моль/(лּс)
2.71.Обчисліть швидкість реакції, внаслідок якої концентрація йонів
Н3О+ зменшилась на 0,01 моль/дм3 за 1 нс (наносекунду).
А. 107моль/(дм3ּс)
B.10– 6 моль/(дм3ּс)
C.109моль/(дм3ּс)
D.10– 9 моль/(дм3ּс)
E.105моль/(дм3ּс)
2.72.Обчисліть період піврозпаду радіонукліду Радону-220 (220Rn), якщо константа швидкості реакції дорівнює 1,26ּ10–2 с–1 .
А. 25 с
B.5 с
C.70 с
D.0,5 с
E.55 с
2.73.Якщо в реакції
СО(г) + Н2О(п)= СО2(г) + Н2(г)
концентрація карбон(ІІ) оксиду за 3 с змінилась від 1,0 моль/дм3 до 0,4 моль/дм3, то середня швидкість реакції становила:
А. 2,0 моль/(дм3ּс)
B.2,4 моль/(дм3ּс)
C.0,2 моль/(дм3ּс)
D.0,02 моль/(дм3ּс)
E.1,2 моль/(дм3ּс)
2.74.У скільки разів збільшиться швидкість хімічної реакції при підвищенні температури від 25 до 75 ˚ С, якщо γ = 2?
А. у 64 рази
B.у 50 разів
C.у 32 рази
D.у 25 разів
E.у 24 рази
2.75.При охолодженні реакційної суміші від 90 до 60˚С швидкість реакції зменшилась у 27 разів. Визначіть температурний коефіцієнт швидкості реакції.
А. 4
25
B.3
C.3,2
D.2
E.2,6
2.76.Як зміниться швидкість прямої реакції
3H2 + N2 2NH3,
якщо об’єм системи зменшити у 2 рази?
А. збільшиться у 12 разів
B.збільшиться у 16 разів
C.зменшиться у 8 разів
D.збільшиться у 4 рази
E.збільшиться у 8 разів
2.77.Як зміниться швидкість прямої реакції
2NO + O2 = 2NO2,
якщо концентрації вихідних речовин збільшити в два рази? А. зросте в 16 разів
B.зросте в 4 рази
C.зросте в 2 рази
D.зросте у 3 рази
E.зросте у 8 разів
2.78.Укажіть середню швидкість реакції
А2 + В2 = 2АВ, якщо у проміжку часу 10 хв. поча-
ткова концентрація А2 становила 0,1 моль/дм3, а кінцева 0,05 моль/дм3 А. 2ּ10– 3 моль/(дм3×хв)
B.5,2ּ10– 6 моль/(дм3×хв)
C.8,3ּ10– 5 моль/(дм3×хв)
D.4ּ10– 4 моль/(дм3×хв)
E.6,5ּ10– 3 моль/(дм3×хв)
2.79.Математичним виразом константи швидкості реакції нульового порядку є рівняння:
А. k0 = τ Cτ/C0
B.k0 = τ С0/Сτ
C.k0 = 1/τ (Сτ - С0)
D.k0 = 1/τ(С0 - Сτ)
E.k0 = Сτ - С0/∆τ
2.80.Математичним виразом константи

швидкості реакції І-го порядку є рівняння:
А. κ1 |
= |
1 |
lg |
c1 |
|
c0 |
|||
|
τ |
|
||
B. κ = − |
1 |
lg |
c0 |
|
|
c1 |
|||
1 |
τ |
|
||
|
|
|
|
|
C.κ1 = τ1 ln c1 − c0
D.κ1 = τ1 lg c0c
|
|
|
1 |
|
|
E. κ1 |
= |
2, 303 |
lg |
c0 |
|
τ |
c1 |
||||
|
|
|
2.81.Розкладання гідроген йодиду на поверхні металічного золота є реакцією:
А. першого порядку
B.другого порядку
C.дробового порядку
D.вищого порядку
E.нульового порядку
2.82.Розкладання амоніаку на поверхні вольфраму за схемою:
2NH3 ¾¾t ®N2 +3H2
єреакцією:
А. вищого порядку
B.нульового порядку
C.першого порядку
D.другого порядку
E.дробового порядку
2.83.Реакція гідролізу сахарози, що відбувається за рівнянням
С12Н22О11 + Н2О = С6Н12О6 (Гл) +
С6Н12О6(Фр)
за кінетичною класифікацією є: А. бімолекулярною реакцією
першого порядку
B.мономолекулярною реакцією першого порядку
C.бімолекулярною реакцією другого порядку
D.мономолекулярною реакцією
26
другого порядку
E.бімолекулярною реакцією нульового порядку
2.84.Реакція одержання фосгену COCl2 із карбон(ІІ) оксиду і хлору є реакцією:
А. мономолекулярною другого порядку
B.мономолекулярною нульового порядку
C.бімолекулярною першого порядку
D.мономолекулярною першого порядку
E.бімолекулярною другого порядку
2.85.Прикладом розгалуженої ланцюгової реакції є:
А. реакція взаємодії хлору з лужним металом
B.реакція взаємодії водню з хлором
C.реакція взаємодії водню з киснем
D.реакція взаємодії водню з азотом
E.реакція взаємодії хлору з метаном
2.86.Укажіть правильну кінетичну характеристику реакції
CuO(к) + H2(г) = Cu(к) + H2O(р):
А. реакція мономолекуляр-на першого порядку
B.реакція гетерогенна другого порядку
C.реакція бімолекулярна другого порядку
D.реакція бімолекулярна першого порядку
E.реакція гомогенна другого порядку
2.87.У якому випадку константа швидкості хімічної реакції дорівнює швидкості реакції?
А. коли реакції відбуваються у гетерогенній системі
B.у всіх перелічених випадках
C.коли концентрації реактантів дорівнюють 1 моль/дм3
D.коли реакції відбуваються у гомогенній системі
E.коли концентрації реактантів однакові і не дорівнюють 1 моль/дм3
2.88.У якому випадку порядок і молекулярність хімічних реакцій співпадають?
А. тільки для ферментних реакцій
B.вони співпадають завжди
C.для фотохімічних реакцій
D.тільки для простих одностадійних реакцій
E.для складних багатостадійних реакцій
2.89.Що таке енергія активації хімічної реакції?
А. різниця між кінетичною енергією молекул і потенціальною енергією
B.різниця між тепловмістом системи і енергією активованого комплексу
C.різниця між внутрішньою енергією і енергією активованого комплексу
D.різниця між енергією активованого комплексу і середньою енергією молекул реагуючих речовин
E.різниця між енергією активованого комплексу і теплоємністю системи
2.90.В яких межах знаходиться енергія активації переважної більшості хімічних реакцій?
А. 50–150 кДж/моль
B.150–300 кДж/моль
C.100–300 кДж/моль
D.100–200 кДж/моль
E.40–200 кДж/моль
2.91.Яка з наведених реакцій відбува-
27
ється за молекулярним механізмом?
А. H2 + Cl2 = 2HCl
B.2NO + O2 = 2NO2
C.2H2 + O2 = 2H2O
D.H3O+ + OH– = 2H2O
E.Ba2+ + SO42– = BaSO4
2.92.Яка з наведених реакцій відбувається за радикальним механізмом?
А. HNO3 + KOH = KNO3 + H2O
B.AgNO3 + HCl = AgCl↓ + HNO3
C.2NO + O2 = 2NO2
D.CH4 + Cl2 = CH3Cl + HCl
E.H2 + I2 = 2HI
2.93.У реакції фотосинтезу вуглеводів
із СО2 і Н2О сенсибілізатором є: А. УФ-випромінювання
B.сонячне світло
C.вуглекислий газ
D.йони перехідних металів
E.хлорофіл
2.94.Якщо хімічна реакція характеризу-
ється енергією активації Еа > 120 кДж/моль, то її швидкість:
А. мала
B.велика
C.середня
D.дуже велика
E.дуже мала
2.95.З якою швидкістю відбуваються реакції, які характеризуються малим значенням енергії активації
(Еа ≈ 40 кДж/моль)
А. з середньою швидкістю
B.з великою
C.з дуже малою швидкістю
D.з дуже великою швидкістю
E.з малою швидкістю
2.96.Чим пояснюється підвищення швидкості реакції при введенні в
систему каталізатора?
1.Зменшенням енергії активації
2.Збільшенням середньої кінетичної енергії молекул
3.Збільшенням числа активних
молекул 4. Збільшенням числа зіткнень
А. 1, 3
B.2, 3
C.1, 4
D.2, 4
E.1, 2
2.97.Яку роль відіграють ферменти у біохімічних реакціях?
А. знижують енергію активації реакцій
B.підвищують енергію активації реакцій
C.змінюють порядок реакції
D.змінюють константу швидкості реакції
E.інгібують паралельні реакції
2.98.З лікарських засобів, які широко використовують у медичній практиці, до групи ферментних препаратів належить:
А. фестал
B.еритроміцин
C.седалгін
D.кофеїн
E.баралгін
2.99.Яку роль виконує каталізатор у каталітичних реакціях?
1.Полегшує досягнення cтану хімічної рівноваги
2.Істотно збільшує константу хімічної рівноваги
3.Зменшує константу хімічної рівноваги
4.Утворює проміжну сполуку, яка легко розкладається на продукт взаємодії
5.Сприяє перебігу прямої реакції
А. 1, 4
B.1, 5
C.2,3
D.5
E.2, 5
2.100. Згідно теорії гетерогенного каталізу Баландіна активними центрами
28
на поверхні твердих каталізаторів є:
А. проміжні активовані комплекси
B.активні центри
C.активні ансамблі
D.мультиплети
E.активні точки
2.101. За участю яких активних частинок відбуваються ланцюгові реакції? А. катіонів і аніонів
B.йонних агрегатів
C.активних молекул
D.радикалів і атомів
E.тільки вільних радикалів
2.102. Як називають реакції, в яких одна відбувається одночасно з другою, термодинамічно неможливою?
А. поєднані
B.послідовні
C.паралельні
D.фотохімічні
E.ланцюгові
2.103. Для визначення енергії активації хімічної реакції треба знати:
А. порядок реакції
B.тепловий ефект реакції
C.зміну енергії Гіббса
D.порядок і молекулярність реакції
E.константи швидкості за двох температур
2.104. Яким кінетичним рівнянням описують реакцію розкладання лікарських речовин?
А. нульового порядку
B.третього порядку
C.другого порядку
D.першого порядку
E.дробового порядку
2.105. Як називають реакції, внаслідок яких утворення кінцевого продукту відбувається через декілька проміжних стадій?
А. паралельними B. радикальними

C.послідовними
D.спряженими
E.ланцюговими
2.106. Для реакції розкладання лікарської речовини період напівперетворен-
ня τ1/ 2 визначають за рівнянням:
А. τ1/ 2 = C0/2 k0
B.τ1/ 2 = 1/ k1C0
C.τ1/ 2 = 0,693/ k1
D.τ1/ 2 = lg2/ k1
E.τ1/ 2 = ln2/ k0
2.107. З перелічених нижче лікарських засобів до ферментних належить: А. баралгін
B.лідаза
C.пероксидаза
D.ціанокобаламін
E.АТФ
2.108. Як називають розділ медицини, що займається застосуванням ферментних засобів у медицині?
А. хіміотерапія
B.ензимотерапія
C.ферментологія
D.пульмонологія
E.нефрологія
2.109. Рівняння швидкості ферментних реакцій Михаеліса-Ментен записують так:
А. ϑ = ϑmax [S ]
KM +[S ]
B.ϑ = ϑo [S ]
KM +[S ]
C.ϑ = ϑзаг + [S ]
KM [S ]
D. ϑ = ϑmax [Е]
KM +[S ]
29
2.110.
2.111.
2.112.
2.113.
E. ϑ = ϑo [Е]
KM +[S ]
Який фізичний зміст константи Михаеліса?
А. КМ = [Е], якщо[Е] = [S]
B.–
C.КМ = [S], якщо ϑ = ϑ0
D.КМ = [Е], якщо ϑ = 1/2 ϑ
E.КМ = [S], якщо ϑ = ϑ/2
Зазначте основну одиницю вимірювання молекулярної активності ферментів:
А. мольּдм– 1ּс– 1
B.ммольּл– 1ּ с– 1
C.ммольּсм3ּс– 1
D.хв– 1
E.мольּл– 1ּ хв– 1
Для визначення константи Михаеліса будують графік, відкладаючи на осях (ордината - абсциса) такі значення:
А. 1/ϑ і 1/[S]
B.ϑ і 1/[S]
C.ϑ і [Е]
D.ϑ і [S]
E.1/ϑ і 1/[Е]
Водний розчин гідроген пероксиду з масовою часткою Н2О2 3 % використовують для обробки поранень. Чому в розчині Н2О2 розкладання відбувається повільно, а при нанесенні на рану – швидко?
А. пероксид швидко розкладається при контакті з вуглекислим газом повітря
B.фермент пероксидаза що міститься у крові, каталізує розкладання Н2О2
C.фермент каталаза, що міститься у крові, каталізує розкладання Н2О2
D.пероксид швидко розкладається при контакті з повітрям
E.пероксид швидко розкладається під дією електролітів
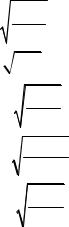
крові
2.114. Катіон якого біоелемента входить до складу ферменту карбоангідрази?
А. Кобальт B. Кальцій C. Ферум D. Цинк E. Купрум
2.115. Чим пояснюють токсичну дію йонів важких металів на організм? А. зв’язуванням аніонів електро-
літів, що містяться у крові B. блокуванням S-H груп актив-
них центрів ферментів
C. блокуванням процесу перенесення кисню від легень до клітин
D. утворення важкорозчинних сполук з біорідинами
E. впливом цих йонів на густину крові
2.116. Метод прискореного старіння ліків, який використовують для визначення їх терміну придатності, ґрунтується на застосуванні:
А. закону дії мас
B.рівняння Арреніуса
C.закону розподілу Больцмана
D.Законах Рауля
E.правила Вант-Гоффа
2.117. Як називають речовини, наприклад йони металів, нуклеотиди, вітаміни, які активують ферменти?
А. активаторами
B.субстратами
C.коферментами
D.ензимами
E.апоферментами
2.118. За якою формулою вираховують розчинність (S) малорозчинного електроліту типу AmBn, який дисоціює за схемою
AmBn mAn+ + nBm– ?
30
А. S =  ДР
ДР
m+n
B. S =
 ДР
ДР
C. S=(m×n) ДР
m × n
D. S=(m+n) ДР
mm × nn
E. S=(m+n) ДР
m+n
2.119. Який зв’язок енергії Гіббса з добутком розчинності?
А. G = RTlg ДР
B.lg ДР =DG/(2,303RT)
C.lg ДР = – DG/(2,303RT)
D.DG = RTln ДР
E.DG = - RTln ДР
2.120. У якому варіанті вказана умова утворення пересиченого розчину
BaSO4?
А. [Ba2+]×[SO42– ] = ДР
B.[Ba2+]· [SO42– ] > ДР
C.[Ba2+]×[SO42– ] » ДР
D.[Ba2+]· [SO42– ] < ДР
E.[Ba] ×[SO4]=ДР
2.121. Насичений розчин AgI утворюється за умови, що:
А. [Ag+]× [I– ] < ДР
B.[Ag+]•[I – ] > ДР
C.[Ag+]× [I– ]»ДР
D.[Ag+]•[I – ] = ДР
E.[Ag+]+[I– ] < ДР
2.122. Яка умова утворення осаду важкорозчинного електроліту?
А. ЙД = ДР
B.ЙД » ДР
C.ЙД < ДР
D.-
E.ЙД > ДР
2.123. Добуток розчинності малорозчинних електролітів залежить від: А. температури
B. концентрації солі
