
Тести з хімії 2
.pdfC.наявності каталізатора
D.молярної концентрації йонів
E.усі перелічені
2.124. Яке рівняння можна використати для знаходження ДР електроліту, що дисоціює за схемою
AmBn mAn+ + nBm– ?
А. ДР= [An+]×[Bm– ]
B.ДР= [A]m×[В]n
C.ДР= [An+]m×[Bm– ]n
D.ДР= aАn+ × aB m-
E.ДР= (aAn+ ) ×(aBm- )
2.125. Розчинність малорозчинних електролітів характеризують за допомогою спеціальної константи, яку називають:
А. коефіцієнтом абсорції
B.добутком розчинності
C.коефіцієнтом розчинності
D.ступенем розчинності
E.константою дисоціації
2.126. Вкажіть правильний варіант запису математичного виразу добутку розчинності ортофосфату кальцію
А. ДР = [Ca2+]3·[PO43– ]2
B.ДР = 3[Ca2+]3+2[PO43– ]2
C.ДР = ([Ca2+]3·[PO43– ]2)/
[Ca3(PO4)2]
D.ДР = 3[Ca2+]3· 2[PO43– ]2
E.ДР = [Ca2+]3 + [PO43– ]2
2.127. Виходячи зі значень добутків розчинності, вкажіть найменш розчинний у воді сульфід:
А. ДР(PbS) = 2,5·10– 27
B.ДР(CdS) = 1,2·10– 28
C.ДР(SnS) = 1,0·10– 27
D.ДР(TlS2) = 5·10– 21
E.ДР(HgS) = 4,0·10– 53
2.128. Які йони не можуть одночасно знаходитися в розчині?
А. K+, NO3–
B.NH4+, Cl–
C.Na+, SO42–
31
D.Cu2+, SO42–
E.Fe2+, OH–
2.129. Вкажіть пару сполук, які можуть бути в розчині одночасно:
А. Al(NO3)3 і HCl
B.NaOH і P2O5
C.Ba(OH)2 і CO2
D.AgNO3 і HCl
E.CuSO4 і BaCl2
2.130. Що таке добуток розчинності?
А. добуток молярних концентрацій йонів у насиченому розчині малорозчинного електроліту в степенях, що дорівнюють стехіометричним коефіцієнтам
B.відношення концентрацій йонів у розчині до концентрації недисоційованих молекул
C.добуток концентрацій йонів важкорозчинного електроліту
D.співвідношення концентрацій йонів важкорозчинного електроліту
E.добуток активностей йонів будь-якого електроліту
2.131. У виразі ДР малорозчинного електроліту активності йонів можна замінити їх концентраціями тому, що:
А. йонна сила насиченого розчину близька до нуля
B.коефіцієнт активності йонів більший одиниці
C.коефіцієнт активності йонів прямує до нуля
D.–
E.йонна сила насиченого розчину прямує до одиниці
2.132. Добуток розчинності малорозчинного електроліту характеризує: А. здатність малорозчинних еле-
ктролітів до дисоціації
B.електричну провідність таких розчинів
C.–

D.концентрацію важкорозчинного електроліту у розчині
E.рівновагу в гетерогенній системі:
тверда речовина насичений розчин малорозчинного електроліту
2.133. Яке рівняння є математичним виразом ДР малорозчинного магній гідроксиду?
А. ДР= 2[Mg2+]·2[OH– ]
B.ДР= [Mg2+]×[OH– ]
C.ДР = aMg2 + × aOH _
D.ДР= [Mg2+]×[OH– ]2
E.ДР= [Mg2+]·2[OH– ]
2.134. Математичним виразом ДР кальцій фториду є рівняння:
А. ДР = [Ca2+][F– ]2
B.ДР= [Ca2+] + [F– ]
C.ДР = [Ca2+][2F– ]
D.ДР = a(Ca2+) a(F– )
E.ДР= [Ca2+] / [F– ]2
2.135. Математичним виразом ДР аргентум хромату є рівняння:
А. ДР= [Ag+]+[Cr2O42– ]
B.ДР= [Ag+]2×[CrO42– ]
C.ДР= [Ag+]×[CrO42– ]
D.ДР= (aАg+ )2 × aCrO42-
E.ДР= 2[Ag+]•[CO 42– ]
2.136. Для розрахунку розчинності аргентум сульфіду (в моль/л) використовується рівняння:
А. S= 3 4ДР
4ДР
B. S= 3 ДР
4
C. S= 3 ДР
4
D.S=
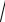 ДР
ДР
E.S= ДР
2
32
2.137.
2.138.
2.139.
2.140.
2.141.
Який вираз справедливий для розрахунку розчинності ферум(ІІІ) гідроксиду (в моль/л)?
А. S= 3 ДР 27
B.S= 3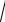 4ДР
4ДР
C.S= 3 ДР
4
D. S= 4 ДР
ДР
27
E. S=
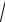 ДР
ДР
Розчинність AgCl за температури 25 °С дорівнює 1,34×10–5 . Вкажіть значення ДР.
А. 8,8 10– 10
B.5,2 10– 5
C.3,6 10– 4
D.1,2 10– 8
E.1,8 10– 10
Розчинність СuS за температури 25 °С дорівнює 2,44 ×10–18 . Вкажіть значення ДР.
А. 1,2 10– 32
B.8,2 10– 30
C.1,2 10– 18
D.5,4 10– 32
E.6,0 10– 36
Обчислити розчинність СаF2 у воді, (моль/л), якщо ДР(СаF2) = 4,0
×10–11
А. 8,2 10– 16
B.5,1 10– 13
C.8,5 10– 18
D.2,1 10– 14
E.4,0 10– 12
Обчисліть Крівн. реакції
2NO + O2 2NO2,
якщо рівноважні концентрації дорівнюють: [NO2] = 0,8 моль/дм3, [NO] = 0,4 моль/дм3, [O2] = 0,2
моль/дм3.
А. 16
B.24
C.20
D.22
E.18
2.142. Принцип Лє– Шател'є дає можливість контролю протікання хімічної реакції як в лабораторії, так і в промисловості. Вкажіть, який з наведених процесів повинен проводитися при підвищеному тиску:
А. 3H2(г) + N2(г) = 2NH3(г)
B.Fe + H2O(г) = FeO + H2(г)
C.H2(г) + Cl2(г) = 2HCl(г)
D.N2(г) + O2(г) = NO2(г)
E.CO(г) + Cl2(г) = COCl2(г)
2.143. Рівноважним називається такий стан системи, при якому:
швидкості прямої і зворотної реакції рівні
B.відбувається безперервний обмін речовин та енергії з навколишнім середовищем
C.концентрації реагуючих речовин однакові
D.не змінюються маси реагуючих речовин
E.необхідні постійні витрати енергії Гіббса
2.144. Константою хімічної рівноваги називається:
А. добуток зміни концентрацій реагентів
B.добуток рівноважних концентрацій продуктів реакцій в степенях, що дорівнюють стехіометричним коефіцієнтам
C.відношення констант швидкості прямої і зворотної реакції
D.відношення констант швидкості зворотної і прямої реакції
E.добуток рівноважних концентрацій вихідних речовин в степенях, що дорівнюють
33
стехіометричним коефіцієнтам
2.145. Математичним виразом константи рівноваги реакції
2SO2 + O2 2SO3
є рівняння:
А. Kp |
= |
[SO3 ]2 |
×[O2 ] |
|
|
[SO2 ]2 |
|||
|
|
|
||
B. |
Kp |
= |
|
[SO2 ]2 ×[O |
2 ] |
||
|
[SO3 ]2 |
|
|
||||
|
|
|
|
|
|
||
C. |
Kp |
= |
|
[SO2 ]2 |
|
|
|
[SO3 ]2 ×[O2 ] |
|||||||
|
|
|
|||||
D. |
Kp |
= |
|
[SO3 ]2 |
|
|
|
[SO2 ]2 ×[O2 ] |
|
|
|||||
|
|
|
|
|
|||
E. |
Kp |
= |
|
[SO3 ] |
|
|
|
|
[SO2 ]×[O2 ] |
|
|
||||
|
|
|
|
|
|
||
2.146. Чому дорівнює константа рівноваги реакції
H2 + I2 2HI,
якщо константа швидкості прямої реакції дорівнює 0,16, а зворотної
–0,05? А. 3,2
B.0,1
C.0,3
D.2,3
E.0,03
2.147. Яке рівняння є виразом константи рівноваги реакції
FeO(к) + H2(г) Fe(к) + H2O(г) ?
А. |
Kp |
= |
|
[H2O]×[Fe] |
|
|||
|
[H2 ]×[FeO] |
|||||||
|
|
|
|
|||||
B. |
Kp |
= |
|
|
[H2 ] |
|
|
|
[H2O] |
|
|
||||||
|
|
|
|
|
||||
C. |
Kp |
= |
|
[FeO]×[H |
2 ] |
|||
|
|
[Fe]×[H2O] |
||||||
|
|
|
|
|
||||
D. |
Kp |
= |
|
|
|
[H2O] |
|
|
[H2 ]×[FeO] |
||||||
|
|
|
|
||||
E. |
Kp |
= |
[H |
2О] |
|||
|
|
[H2 ] |
|
||||
|
|
|
|
|
|||
2.148. Cинтез метанолу за реакцією
CO(г) + 2H2(г) CH3OH(р)
є процесом екзотермічним, тому для збільшення виходу продукту необхідно:
підвищити температуру, збільшити концентрацію метанолу
B.підвищити температуру, підвищити тиск
C.підвищити температуру, виводити водень із зони реакції
D.понизити температуру, виводити СО із зони реакції
E.понизити температуру, виводити метанол із зони реакції
2.149. Які умови сприяють більшому виходу SО3 за реакцією
SO2 + 1/2O2 SO3 ; H°298 = – 98,9 кДж/моль .
А. підвищення температури, зменшення об’ єму реактора
B.підвищення температури, збільшення об’ єму реактора
C.зниження температури, зменшення концентрації кисню
D.підвищення температури, зменшення тиску
E.зниження температури, підвищення тиску
2.150. Більшому виходу аміаку в системі
N2 + 3H2 2NH3; H°298 = –92,4
кДж/моль
сприяє:
А. зниження температури, підвищення концентрації аміаку
B.збільшення об’ єму реактора, введення каталізатора
C.зниження температури, підвищення концентрації азоту і
34
водню
D.введення каталізатора, підвищення температури
E.підвищення температури, зменшення тиску
2.151. При 450 °С константа рівноваги реакції
H2 + Br2 2HBr
дорівнює 50. Визначити константу рівноваги реакції розкладу НВr при цій же температурі?
А. 0,02
B.0,07
C.0,2
D.0,05
E.0,5
2.152. Для яких з наведених нижче реакцій рівновага зміститься в бік утворення продуктів реакції при підвищенні температури і тиску:
N2(г) + 3H2(г) 2NH3(г) – Q; C(т) + O2(г) CO2(г) + Q;
N2O4(р) 2NO2(г) – Q?
А. 2
B.для всіх наведених реакцій
C.2, 3
D.1, 3
E.1
2.153. Стан системи, який не змінюється в часі при незмінних зовнішніх факторах, називається:
А. нерівноважним
B.стаціонарним
C.ізотермічним
D.ізобарним
E.рівноважним
2.154. Для якого з перелічених процесів зниження температури буде його прискорювати?
А. ендотермічного
B.адіабатичного
C.ізобарного
D.екзотермічного
E.ізохорного
2.155. Стаціонарним називається такий стан системи, при якому:
А. відсутній обмін речовин та енергії
B.відсутні будь-які градієнти
C.ентропія системи має максимально можливе значення
D.наявні сталі за величиною градієнти
E.швидкості прямої та зворотної реакції рівні
2.156. Для якої системи при збільшенні тиску рівновага зміститься в сторону прямої реакції?
А. COCl2(г) CO(г) + Cl2(г)
B.NH4Cl(т) HCl(г) + NH3(г)
C.CO2(г) + H2(г) CO(г) + H2O(г)
D.H2(г) + I2(г) 2HI(г)
E.2NO(г) + O2(г) 2NO2(г)
2.157. Для якого з процесів підвищення температури збільшує вихід продуктів реакції?
А. Ізобарного
B.екзотермічного
C.ендотермічного
D.адіабатичного
E.ізохорного
Розділ 3
3.1.До якого типу електродів відносять хлорсрібний електрод:
А. другого роду
B.першого роду
C.йон-селективних.
D.окисно-відновних
E.газових
3.2.Стандартний водневий електрод це платинова пластина, занурена в розчин сульфатної кислоти за температури 298 К і р =1,013·105 Па з
активністю йонів Н3О+ А. 1 моль/л
B.0,2 моль/л
C.0,1 моль/л
D.2 моль/л
E.0,5 моль/л
3.3.При проведенні окисно-відновної реакції потрібно знати, яка із реагуючих речовин буде відновником,
аяка – окисником. Напрямок проходження окисно-відновної реакції
35
визначається:
А. величиною стрибка потенціалу в ході окисно-відновної реакції.
B.температурою системи.
C.величиною стандартних електродних потенціалів учасників реакції.
D.величиною водневого показника системи.
E.різницею стандартних електродних потенціалів учасників реакції.
3.4.Як зміниться потенціал цинкового електрода при зменшенні концентрації йонів цинку в 100 разів?
А. збільшиться на 120 мВ
B.зменшиться на 120 мВ
C.зменшиться на 60 мВ
D.зменшиться на 40 мВ
E.збільшиться на 30 мВ
3.5.Мідна пластинка занурена в 0,1 М
розчин купрум сульфату. Який потенціал виникає на межі поділу 2-х фаз?
А. дифузійний
B.мембранний
C.електрокінетичний
D.електродний
E.контактний
3.6.Залежність величини електродного потенціалу від різних чинників виражається рівнянням:
А. Арреніуса
B.Гіббса
C.Вант-Гоффа
D.Нернста
E.Гесса
3.7.До якого типу електродів відносять каломельний електрод?
А. йон-селективних
B.газових
C.окисно-відновних
D.першого роду
E.другого роду
3.8.Вкажіть редокс-пари, для якого І2/2І– є відновником φо(І2/2І– ) = 0,54
Ві значення ЕРС процесу позитивне
А. Sn4+ = Sn2+, φо = 0,15B
B.Cl2 = 2Cl– , φо = 1,36В
C.SO42– = S, φо = 0,45B
D.2H+= H2, φо = 0,0B
E.2S2O32– = S4O62– , φо = 0,09B
3.9.До якого типу відносять електрод, складений за схемою Au3+| Au? А. до електродів ІІ роду
B.до електродів І роду
C.окисно-відновних електродів
D.до електродів ІІІ роду
E.йон-селективних електродів
3.10.Яким приблизно буде потенціал водневого електроду, зануреного до дистильованої води за стандартної температури ?
А. приблизно –0,8 В
B.приблизно +0,8 В
36
C.приблизно 0 В
D.приблизно –0,4 В
E.приблизно +0,4 В
3.11.Як зміниться потенціал водневого електрода за температури 298,15 К, якщо 1 М розчин HCl , в який занурений електрод, розбавити в 100 разів?
А. зменшиться на 0,413 В
B.збільшиться на 0,413 В
C.збільшиться на 0,206 В
D.зменшиться на 0,118 В
E.не зміниться
3.12.Як зміниться потенціал водневого електрода за температури 298,15 К , якщо 1 М розчин HCl цілком нейтралізувати?
А. не зміниться
B.зменшиться на 0,413 В
C.збільшиться на 0,118 В
D.зменшиться на 0,118 В
E.збільшиться на 0,413 В
3.13.У водневому електроді електродним матеріалом є:
А. водень
B.залізо
C.платина
D.золото
E.срібло
3.14.Яка величина рН електродного розчину стандартного водневого електроду?
А. 1
B.0,5
C.2
D.10
E.0
3.15.До якого типу електродів відносять хлорсрібний електрод?
А. другого роду
B.йон-селективних
C.окисно-відновних
D.першого роду
E.газових
3.16.До якого типу електродів відносять
каломельний електрод: А. другого роду
B.першого роду
C.газових
D.йон-селективних
E.окисно-відновних
3.17.До якого типу електродів відносять водневий електрод
А. першого роду
B.другого роду
C.йон-селективних
D.окисно-відновних
E.газових
3.18.До якого типу електродів відносять хінгідронний електрод:
А. газових
B.першого роду
C.йон-селективних
D.другого роду
E.окисно-відновних
3.19.До якого типу електродів відносять скляний електрод:
А. окисно-відновних
B.йон-селективних
C.першого роду
D.другого роду
E.газових
3.20.До якого типу відносять електрод, складений за схемою Au3+| Au?
А. окисно-відновних електродів
B.йон-селективних електродів
C.до електродів ІІ роду
D.до електродів ІІІ роду
E.до електродів І роду
3.21.До якого типу відносять електрод, складений за схемою
KCl, AgCl | Ag?
А. окисно-відновних електродів
B.йон-селективних електродів
C.до електродів ІІІ роду
D.до електродів І роду
E.до електродів ІІ роду
3.22.До якого типу відносять електрод, складений за схемою
KCl, Hg2Cl2 Hg?
37
А. до електродів ІІІ роду
B.йон-селективних електродів
C.окисно-відновних електродів
D.до електродів І роду
E.до електродів ІІ роду
3.23.До якого типу відносять електрод, складений за схемою Al3+| Al?
А. до електродів ІІІ роду
B.йон-селективних електродів
C.окисно-відновних електродів
D.до електродів І роду
E.до електродів ІІ роду
3.24.Електрод складений за схемою Au Sn4+, Sn2+ відносять до:
А. окисно-відновних
B.порівняння
C.йон-селективних
D.індикаторних
E.газових
3.25.Електрод складений за схемою С Sn4+, Sn2+ відносять до:
А. газових
B.йон-селективних
C.індикаторних
D.окисно-відновних
E.порівняння
3.26.Мідна пластинка занурена в 0,1 М розчин купрум сульфату. Який заряд набуває електрод?
А. позитивний
B.нейтральний
C.–
D.негативний
E.–
3.27.Мідна пластинка занурена в 1 М розчин купрум хлоридуу. Який заряд набуває електрод?
А. –
B.негативний
C.нейтральний
D.–
E.позитивний
3.28.Алюмінієва пластинка занурена в 0,1 М розчин алюміній сульфату. Який заряд набуває електрод?
А. позитивний
B.негативний
C.–
D.–
E.нейтральний
3.29.Алюмінієва пластинка занурена в 1 М розчин алюміній сульфату. Який заряд набуває електрод?
А. –
B.позитивний
C.–
D.негативний
E.нейтральний
3.30.Який з наведених електродів: магнієвий, цинковий, алюмінієвий, мідний, золотий має найбільший негативний заряд?
А. магнієвий
B.цинковий
C.мідний
D.золотий
E.алюмінієвий
3.31.Який з наведених електродів: магнієвий, цинковий, алюмінієвий, мідний, золотий має найбільший позитивний заряд?
А. золотий
B.мідний
C.магнієвий
D.алюмінієвий
E.цинковий
3.32.Потенціал водневого електроду вважають стандартним, якщо він відповідає таким вимогам:
А. р(Н2) = 10 атм; а(н+) = 10
моль/л
B.р(Н2) = 1 атм; а(н+) = 7 моль/л
C.р(Н2) = 0 атм; а(н+) = 0 моль/л
D.р(Н2) = 1 атм; а(н+) = 1 моль/л
E.р(Н2) = 0,1 атм; а(н+) = 0,1
моль/л
3.33.Потенціал цинкового електроду вважають стандартним, якщо він відповідає таким вимогам:
А. а((Zn2+)) = 0,1 моль/л
B.а((Zn2+)) = 10 моль/л
38
C.а((Zn2+)) = 7 моль/л
D.а((Zn2+))= 0 моль/л
E.а(Zn2+) = 1 моль/л
3.34.Рівняння для обчислення величини потенціалу електродів І роду має вигляд:
А. ϕ = ϕ0 + RT/nF ×lga(Katn+)
B.ϕ = ϕ0 + ×lna(Katn+)
C.ϕ = ϕ0 – RT/nF ×lna(Ann– )
D.ϕ = ϕ0 + RT/nF ×lna(Katn+)
E.ϕ = ϕ0 + RT/nF ×lga(Ann– )
3.35.Рівняння для обчислення величини потенціалу електродів ІІ роду має вигляд:
А. ϕ = ϕ0 + RT/nF ×lna(Katn+)
B.ϕ = ϕ0 – RT/nF ×lna(Ann– )
C.ϕ = ϕ0 – ln a(Ann– )
D.ϕ = ϕ0 + RT/nF ×lga(Ann– )
E.ϕ = ϕ0 + RT/nF ×lga(Katn+)
3.36.Мідна пластинка занурена в 0,1 М розчин купрум сульфату. Який потенціал виникає на межі поділу 2-х фаз?
А. контактний
B.електрокінетичний
C.електродний
D.дифузійний
E.мембранний
3.37.Пластинку з алюмінію помістили в 0,01 М розчині алюміній сульфату. Який потенціал виникає на межі поділу 2-х фаз?
А. електрокінетичний
B.контактний
C.дифузійний
D.мембранний
E.електродний
3.38.Стандартний водневий електрод це платинова пластина, занурена в розчин сульфатної кислоти за температури 298 К і р =1,013·105 Па з
активністю йонів Н3О+ А. 2 моль/л
B.0,1 моль/л
C.1 моль/л
D.0,2 моль/л
E.0,5 моль/л
3.39.Залежність величини електродного потенціалу від різних чинників виражається рівнянням:
А. Гіббса
B.Нернста
C.Арреніуса
D.Вант-Гоффа
E.Гесса
3.40.Потенціал окисно-відновного електрода вважається стандартним коли:
А. аок > авідн
B.авідн = 1 моль/л
C.аок = авідн
D.аок < авідн
E.аок = 1 моль/л
3.41.Що таке електродний потенціал? А. це стрибок потенціалу на межі
метал – метал
B.це стрибок потенціалу на межі повітря – розчин електроліту
C.різниця мембранного і дифузійного потенціалів
D.це різниця електричних потенціалів у розчині електроліту
E.це стрибок потенціалу на межі метал – розчин електроліту
3.42.Дифузійний потенціал виникає на межі поділу таких фаз:
А. розчин електроліту – повітря
B.метал – метал
C.двох розчинів електроліту різної концентрації
D.метал – повітря
E.метал – розчин електроліту
3.43.Дифузійний потенціал виникає внаслідок:
А. асоціації йонів електроліту
B.надлишку аніонів у вихідному розчині
C.різної швидкості йонів електроліту
D.надлишку катіонів у вихідному розчині
39
E.однакової швидкості йонів електроліту
3.44.Як називають потенціал, що виникає на межі між двома розчинами, розділеними напівпроникною мембраною?
А. мембраним
B.дифузійним
C.стандартним
D.електродним
E.окисно-відновним
3.45.Яка величина потенціалу хлорсрібного електроду в насиченому розчині KCl?
А. –0,22 В
B.0,25 В
C.–0,44 В
D.0,22 В
E.0,44 В
3.46.Яка величина потенціалу каломельного електроду в насиченому розчині KCl?
А. 0,25 В B. 0,22 В C. –0,50 В D. –0,25 В E. 0,50 В
3.47. Як зміниться потенціал водневого електрода за температури 298,15 К, якщо 1 М розчин HCl , в який занурений електрод, розбавити в 100 разів?
А. збільшиться на 0,413В B. збільшиться на 0,206В C. зменшиться на 0,118В D. не зміниться
E. зменшиться на 0,413В
3.48. Як зміниться потенціал водневого електрода за температури 298,15 К , якщо 1 М розчин HCl цілком нейтралізувати?
А. зменшиться на 0,118В B. зменшиться на 0,413В C. збільшиться на 0,118В D. не зміниться
E.збільшиться на 0,413В
3.49.Який з наведених електродів: срібний, хлорсрібний, водневий, цинковий, мідний використовують, як електрод порівняння?
А. цинковий
B.мідний
C.хлорсрібний
D.водневий
E.срібний
3.50.Який з наведених електродів: срібний, каломельний, водневий, цинковий, мідний використовують, як електрод порівняння?
А. цинковий
B.мідний
C.срібний
D.водневий
E.каломельний
3.51.Як зміниться потенціал цинкового електроду (н.у.) при зменшенні концентрації йонів цинку в 100 разів?
А. зменшиться на 29 мВ
B.зменшиться на 59 мВ
C.збільшиться на 50 мВ
D.зменшиться на 100 мВ
E.збільшиться на 100 мВ
3.52.На скільки мВ зміниться потенціал кадмиєвого електроду (н.у.) при збільшенні концентрації йонів кадмію в 10 разів?
А. на 15 мВ
B.на 120 мВ
C.на 59 мВ
D.на 30 мВ
E.на 10 мВ
3.53.Яким приблизно буде потенціал водневого електроду, зануреного до дистильованої води за стандартної температури ?
А. |
– 0,8 В |
B. |
–0,4 В |
C. |
+0,4 В |
D. +0,8 В
40
E.0 В
3.54.Яким приблизно буде потенціал водневого електроду (н. у.), зануреного в розчин з рН = 2 ?
А. 0 В
B.–0,6 В
C.+0,6 В
D.–0,12 В
E.+0,12 В
3.55.Яким приблизно буде потенціал водневого електроду (н. у.), зануреного в розчин з рН = 4?
А. +0,24 В B. –0,6 В C. +0,6 В
D. 0 В
E. –0,24 В
3.56. Яка величина електродного потенціалу системи Cu CuSO4, якщо С(CuSO4) = 2 моль/л, а α=0,5?
А. 0,34 В B. 0,68 В C. –0,34 В D. 0,17 В E. –0,68 В
3.57. Яка величина електродного потенціалу системи Zn ZnSO4, якщо С(ZnSO4) = 4 моль/л, а α=0,25?
А. –0,76 В
B.3,14 В
C.0,76 В
D.–0,38 В
E.–3,14 В
3.58.Який з наведених гальванічних елементів: Якобі– Даніеля, Вестона, концентраційний срібний, кислотний акумулятор, лужний акумулятор використовують, як стандартний?
А. –
B.Якобі– Даніеля
C.концентраційний срібний
D.Вестона
E.кислотний акумулятор
3.59.На аноді гальванічного елементу
