
75 группа 2 вариант / ГТ и ПГУ / Книги / Общая энергетика. Часть 1
..pdfвиде функциональной зависимости (р, , T) = 0. Это уравнение можно также выразить в виде
р = 1 (T, ); = 2 (р, T); T = 3 (р, ).
Следовательно, состояние тела определяется значениями двух из трёх величин: р, , Т. Исходя из этого, состояние тела может быть изображено в двухосной системе координат, чаще всего с р по оси ординат и по оси абсцисс. При этом каждой точке на диаграмме соответствует одно определённое состояние тела.
Давление р измеряется в Н/м2 (Па), где 1 Н (ньютон) – единица силы в системе СИ. Ньютон на квадратный метр называется паскаль (Па). Более крупными единицами измерения давлений служат: 1 кН/м2 (кПа – килопаскаль) = 103 Н/м2 (Па), 1 МН/м2 (МПа – мегапаскаль) = 106 Н/м2 (Па).
Давление столба воды высотой 10 м на площадь 1 м2 (в си-
стеме МКГСС соответствует одной технической атмосфере) 1 ат (кгс/см2) = ρqН =103·9,8066·10 = 9,8066·104 Н/м2 (Па) =
0,0981 МПа, где ρ – плотность воды, кг/м3; q – ускорение силы
тяжести, м/с2; Н – высота столба жидкости, м. Соответственно
1Па = 1Н/м2 = 1 кг/(м с2) = 0,102 кгс/м2 = 0,102·10- 4 кгс/см2 (ат).
При этом 1 мм вод.ст. = 9,81 Н/м2 (Па). Так как плотность ртути в 13,6 раз больше плотности воды, то 1 мм рт.ст. = = 133,322 Н/м2 (Па). Полезно будет запомнить следующие соотношения: 1 ат = 735,6 мм рт.ст.; 1 бар = 105 Н/м2 (Па) = 750 мм рт.ст, тогда для перевода давления из технических атмосфер в бары применяют коэффициент 1,02= 750/ 735,6 и, следовательно, 1 бар = 1,02 ат.
Исходя из практических условий измерения давления с помощью манометра, величина абсолютного давления р опреде-
ляется как |
|
р = рман + ратм, |
(1.1) |
где рман – манометрическое (избыточное) давление, измеряемое манометром; ратм – атмосферное (барометрическое) давление, измеряемое барометром.
Если давление ниже атмосферного, то абсолютное давление
р = ратм – рвак, |
(1.2) |
где рвак – вакуумметрическое давление (разрежение или вакуум), измеряемое вакуумметром.
Объём V, м3, – это объём тела произвольного количества массы m, кг. Удельный объём тела = V / m, м3/кг, а величина,
11
обратная ему, есть плотность тела (масса в единице объёма)
= 1/ = m / V , кг/м3 .
Термодинамическая (абсолютная) температура Т измеряется в градусах шкалы Кельвина (К), один градус которой (1 К) численно равен одному градусу шкалы Цельсия (1 С) и определяется соотношением
Т = t ( С) + 273,15.
1.3.Идеальный газ
1.3.1.Основное уравнение идеального газа
Упрощенной моделью газообразного тела служит так называемый идеальный газ. Под идеальным газом понимают воображаемый газ, состоящий из вполне упругих молекул, между которыми не действуют силы взаимного притяжения, а объем, занимаемый молекулами, исчезающе мал по сравнению с объемом пространства между молекулами.
Изучение законов идеального газа помогает определять поведение реального газа в различных условиях. Степень расхождения свойств идеального и реального газов зависит от условий, в которых находится реальный газ. Чем ниже давление и выше температура, тем ближе свойства реального газа к свойствам идеального. Все законы состояния наиболее просто формулируются для идеального газа.
Составление уравнения состояния реальных газов является исключительно сложной задачей. Эта задача в полной мере решена лишь для разреженных газов, имеющих небольшую плотность. Уравнение состояния идеальных газов было получено в 1834 г. Клапейроном на основании опытных законов Бойля – Мариотта и Гей-Люссака. Уравнение Клапейрона содержит константу, зависящую от природы газа и потому не являющуюся универсальной. В 1874 г. Д. И. Менделеев на основании уравнения Клапейрона и закона Авогадро вывел общее уравнение состояния для идеальных газов, которое не содержало индивидуальной константы. Это послужило основанием называть уравнение состояния идеальных газов уравнением Клапейрона – Менделеева.
Для 1 кг идеального газа уравнение состояния имеет вид
р = RT, |
(1.3) |
12
где R – газовая постоянная для 1 кг данного газа, Дж/кг град; р – давление, Н/м2 (Па); – удельный объём, м3/кг; Т – абсолютная температура, К; V – объём, м3.
Для произвольного количества однородного газа массой m
уравнение состояния примет вид |
|
рV = mRT. |
(1.4) |
Для 1 кмоль идеального газа уравнение состояния можно за-
писать в таком виде: |
|
рV = RT, |
(1.5) |
где – молекулярная масса газа, кг/кмоль; V – объем 1 кмоль идеального газа.
По закону Авогадро 1 кмоль идеального газа любого химического состава при одинаковых давлениях и температурах занимает один и тот же объем. При давлении ро = 0,10132 МН/м2 (760 мм рт.ст.) и температуре То = 273,15 К (0 оС) объем 1 кмоль идеального газа V = 22,4146 м3. Подставив эти значения в
уравнение, получим |
|
|
||
R = R = |
0,10132 106 22,4146 |
= 8 314. |
(1.6) |
|
273,15 |
||||
|
|
|
||
Таким образом, R (Дж/кмоль град) одинакова для всех газов и поэтому называется универсальной газовой постоянной. Следовательно, для 1 кг газа газовая постоянная определяется из соотношения
R = R / .
1.3.2. Первый закон термодинамики
Внутренняя энергия U термодинамического тела, взаимодействующего с внешней средой, увеличивается на количество полученной им теплоты Q и уменьшается на величину совершенной телом работы расширения L, то есть
U2 – U1 = Q – L. (1.7)
Это уравнение энергетического баланса обычно записывается в виде
Q = U2 – U1 + L |
(1.8) |
и рассматривается как аналитическое (математическое) выражение первого закона термодинамики для термодинамического тела или неизолированной системы. В соответствии с уравнением (1.8) первый закон термодинамики может быть сформулиро-
13

ван следующим образом: теплота, сообщаемая телу, рас-
ходуется на увеличение его внутренней энергии и на работу по преодолению внешнего давления. Для одного кило-
грамма вещества первый закон термодинамики имеет вид
q = u2 – u1 + . |
(1.9) |
В этом уравнении все величины (q, u, ) являются удельны-
ми, т. е. относятся к 1 кг массы рабочего тела и измеряются в Дж/кг.
1.3.3.Внутренняя энергия тела
Сточки зрения молекулярно-кинетической теории под внутренней энергией тела понимается сумма кинетической и потен-
|
циальной энергий атомов (мо- |
|
|
лекул), обусловленных: первая |
|
|
– скоростью движения и массой |
|
|
частиц, вторая – взаимным их |
|
|
расположением и силами взаи- |
|
|
модействия. |
Следовательно, |
|
каждое тело в данном состоя- |
|
|
нии обладает известной внут- |
|
|
ренней энергией u, определяе- |
|
|
мой данным состоянием тела. |
|
|
Другими словами, внутренняя |
|
Рис. 1.1. Изменение внутренней |
энергия является функцией со- |
|
энергии рабочего тела |
стояния тела, точнее функцией |
|
термодинамических параметров, характеризующих состояние тела (р, , Т), и, следовательно, du есть полный дифференциал этой функции, т.е. u = (p, , Т) и du = d (p, , Т).
Поэтому, при переходе тела (рис.1.1) из состояния 1, определяемого величинами p1, 1, Т1, в состояние 2, определяемое величинами p2, 2, Т2, изменение внутренней энергии 1 кг тела определяется как
2 |
|
u2 – u1 = du = (p2, 2, Т2) – (p1, 1, Т1), |
(1.10) |
1 |
|
где u1 – величина внутренней энергии 1 кг тела в начальном состоянии и u2 – в конечном состоянии.
Таким образом, изменение внутренней энергии тела вполне определяется начальным и конечным состояниями тела и не зависит от промежуточных состояний, а следовательно, и от
14
условий перехода тела из одного состояния в другое, или, как говорят, от характера процесса. Так как внутренняя энергия u является подобно давлению, удельному объёму и температуре величиной, характеризующей состояние тела, то она может служить для его определения, и, следовательно, внутренняя энергия является параметром состояния.
1.3.4. Работа расширения
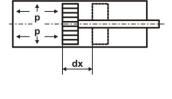
Рассмотрим цилиндр с невесомым поршнем, двигающимся без трения, в котором находится какой-либо газ или пар с давлением
p (рис.1.2). За счёт подвода тепла dQ произойдёт бесконечно малое расширение газа с изменением объема на величину dV, которое вызовет бесконечно малое перемещение поршня dx, причём dV =
= F dx , где F – площадь поршня. Работа совершается полным давлением газа на поршень, и по правилам механики
dL = р Fdx = p dV. |
(1.11) |
Работа тела неразрывно связана с изменением объёма и определяется им и давлением. Для 1 кг тела удельная работа
d = p d . |
(1.12) |
Работа же 1 кг тела при конечном изменении удельного объёма от значения 1 до значения 2 может быть получена интегрированием уравнения (1.12) в соответствующих пределах:
|
|
|
|
= |
2 |
p d . |
(1.13) |
|
1 |
|
|
Если дана функциональная зависимость р = ( ) между давлением р и удельным объемом , то она может быть изображена графически в прямоугольной двухосной системе координат (рис.1.3). Каждая точка кривой своими координатами определяет одновременные значения p и , вся же кривая даёт изменение давления в зависимости от объёма в процессе 1-2. При бесконечно малом d площадь заштрихованной полоски равна
2
p d = d , следовательно, работа в процессе 1-2 равна = p d
1
и изображается в масштабе площадью под кривой процесса.
15

Поскольку абсолютное давление p – величина всегда положительная, то диффе-
Рис. 1.3. Графическое изображение работы расширения в p, - диаграмме
ренциалы d и d имеют
одинаковые знаки. Если d > 0, то происходит процесс расширения и работа положительна
(d > 0). Если d < 0, то
имеет место процесс сжатия – работа отрица-
тельна (d < 0). В этом
случае не тело совершает работу, а на его сжатие затрачивается работа извне. При ра-
венстве давления тела и внешнего давления d = d уравнение
первого закона термодинамики можно записать так: |
|
dq = du + d = du + p d , |
(1.14) |
а для любого конечного изменения состояния |
|
q = u2 – u1 + . |
(1.15) |
Ранее было определено, что изменение внутренней энергии определяется разностью (u2 – u1) в конце и начале процесса независимо от характера процесса. Величина же работы начальным и конечным состояниями тела не определяется, а зависит от процесса (рис. 1.4). Поэтому при одних и тех же значениях внутренней энергии в точках 1 и 2 (рис. 1.4) работы, совершаемые телом в процессах а, б и в, будут соотноситься следующим
образом: а > б > в, т.е. будут существенно различны,
Рис. 1.4. Зависимость работы рас- |
как и площади под этими |
|
ширения от процесса |
||
процессами. Работа не яв- |
||
|
ляется функцией состояния тела, а является функцией процес-
16

са, поэтому для конечного процесса работу следует обозначать одним символом .
В связи с тем, что работа зависит от процесса, то и количество тепла, сообщаемое телу, зависит от характера процесса, т.е. теплота не является функцией состояния, а зависит только от процесса. Следовательно, количества теплоты, подводимые к телу в процессах а, б и в, будут соотноситься следующим образом: qа > qб > qв.
1.4. Теплоёмкость идеальных газов
Для того чтобы изменить температуру различных тел с одинаковой массой на одну и ту же величину, нужно затратить различное количество теплоты. Следовательно, каждое вещество обладает своей, присущей только ему теплоёмкостью. Для характеристики теплоёмкости различных веществ, для возможности сравнения их между собой и для технических расчётов введено понятие удельной теплоёмкости.
Удельной теплоёмкостью называют количество тепла, необходимое для изменения температуры единицы количества вещества на 1 градус. В зависимости от выбранной единицы количества вещества различают следующие виды теплоёмкостей:
а) удельную массовую, отнесённую к 1 кг массы вещества и измеряемую в Дж/кг град,
C = |
1 Q |
; |
(1.16) |
m T |
б) удельную объёмную, отнесённую к 1 м3 вещества и измеряемую в Дж/м3 град,
C = |
1 Q |
; |
(1.17) |
||
|
|
||||
V T |
|||||
|
|
|
|||
в) удельную мольную, отнесённую к 1 моль и измеряемую в Дж/моль град,
|
Q |
|
C = |
m T . |
(1.18) |
Все три вида теплоёмкостей связаны между собой зависимостями
C = C , |
C = |
Cμ |
, |
C = |
С' |
= C , |
|
|
|
||||||
|
|
||||||
|
|
|
|
|
где – плотность вещества, кг/м3; – молярная масса вещества, кг/моль.
17
Теплоёмкость газа зависит от физических свойств газа, от условий, в которых происходит процесс, а также и от температуры (а для реальных газов и от давления). Иногда в теплотехнических расчётах, не требующих большой точности, не считаются с изменением теплоёмкости при изменении температуры, принимая её средней в интервале температур. В этом случае теплоёмкость считают постоянной. Если учесть, что теплоёмкость газа – величина переменная, зависящая от температуры, то это будет означать, что для нагрева единицы массы газа на каждый градус необходимо разное количество тепла.
В практических расчётах удобнее пользоваться средней теплоёмкостью. Средней теплоёмкостью Cm называют количество теплоты q, необходимое для повышения температуры единицы массы газа в среднем на 1 градус от температуры t1 до t2:
Cm = q / (t2 – t1). |
(1.19) |
1.5. Энтальпия идеального газа
Энтальпия иначе называется полной энергией, а ранее в технической системе единиц называлась теплосодержанием. Энтальпия представляет собой сумму внутренней энергии и энергии давления. Для одного килограмма вещества энтальпия определяется из выражения
h = u + p . |
(1.20) |
Энтальпия для тела произвольной массы может быть определена как
H = U + p V . |
(1.21) |
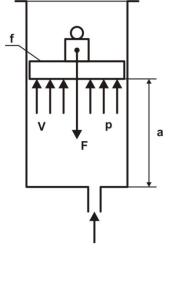
В правой части равенства второе слагаемое представляет собой энергию давления. Физический смысл энергии давления газа может быть пояснен при рассмотрении
Рис.1.5. Иллюстрация энергии заполнения цилиндра с нагружен- давления ным поршнем (рис.1.5). В условиях внешнего вакуума на поршень площадью f действует снизу сила давления газа P = f·p, а сверху – вес гири F, и эти силы уравновешиваются. При дополнительном заполнении цилиндра газом
18
поршень поднимается на высоту а, при этом и газом совершается работа, увеличивающая потенциальную энергию поднимаемой гири в поле тяготения Земли. Эта работа может быть представлена в виде произведения силы F и высоты подъема а, и в то же время F·а равно произведению f·а·р , а так как произведение f·а = V и представляет собой объем поступившего газа, то увеличение потенциальной энергии поднятого груза F·а = p·V.
Таким образом, полная энергия системы, включающая в себя газ и груз на поршне, представляет собой сумму внутренней энергии газа и потенциальной энергии груза, что по уравнению (1.20) соответствует определению энтальпии газа, поступившего в цилиндр.
1.6.Второй закон термодинамики
1.6.1.Основные формулировки 2-го закона термодинамики
Из опыта известно, что механическую энергию можно полностью превратить в теплоту трения. Обратный процесс преобразования теплоты в работу имеет ограничения. Именно меру преобразования теплоты в работу и направление процессов устанавливает второй закон термодинамики. Осмысление наблюдаемых явлений действительности позволило сформулировать второй закон термодинамики. Этот закон весьма многогранен. Разные исследователи подходили к этому закону с разных позиций и базировались на разных фактах его проявления, и в результате появилось много формулировок закона. Основными из них являются следующие.
1.При тепловом взаимодействии тел с различными температурами теплота передается от тела с высокой температурой к телу с низкой температурой (Р. Клаузиус).
2.В круговом процессе изменения состояния термодинамического тела теплота, получаемая им от нагревателя, не может быть полностью превращена в работу (В. Томсон-Кельвин).
3.Наиболее холодное тело физической системы не может служить теплоотдатчиком в круговом процессе рабочего тела установки, предназначенной для получения работы (В. ТомсонКельвин).
4.Термодинамически равновесная система не работоспособна, т.е. невозможен вечный двигатель второго рода.
5.Все реальные процессы, протекающие в замкнутой физической системе, в конечном итоге приводят к переходу этой си-
19
стемы от менее вероятного состояния к более вероятному состоянию (Л. Больцман).
Таким образом, второй закон термодинамики устанавливает направление перехода теплоты, а также ту её часть, которую можно перевести в работу в тепловом двигателе. Непрерывное преобразование теплоты в работу осуществляется только в круговом процессе или цикле. Первый и второй законы термодинамики являются независимыми друг от друга. Первый и второй законы термодинамики являются непреложными законами природы и как всякие законы природы основываются исключительно на весьма обширном опыте.
1.6.2.Энтропия
Втермодинамике используют еще один параметр состояния рабочего тела – энтропию, устанавливающую связь между количеством теплоты и температурой. Поясним этот параметр исходя из следующих соображений.
Уравнение первого закона термодинамики можно записать в виде
dq = du + pdυ = du + dl. |
(1.22) |
В этом уравнении dq не является полным дифференциалом, поскольку в правую часть уравнения входит член dl, не являющийся полным дифференциалом, так как работа является не параметром состояния газа, а функцией процесса. Известно, что всякий двучлен можно представить в виде полного дифференциала, если его умножить на так называемый интегрирующий множитель.
При умножении на интегрирующий множитель 1/Т (где Т – абсолютная температура) приведенное выше уравнение примет вид
dq |
|
du |
|
dl |
. |
(1.23) |
|
|
|
||||
T |
|
T |
|
T |
|
|
Уравнение (1.22) можно представить в несколько ином виде, а именно:
dq /T = cvdT/T + R dυ/υ. |
(1.24) |
Выражение (1.23) говорит о том, что dq/T представляет собой полный дифференциал некоторой функции S (т.е. dq /T = ds), являющейся параметром состояния газа, поскольку она зависит только от двух параметров состояния (Т и ) и поэтому не зависит от того, каким путем газ из одного состояния перешел в дру-
20
