
75 группа 2 вариант / ГТ и ПГУ / Книги / Общая энергетика. Часть 1
..pdfгое. Этот параметр состояния в общем случае называют энтропией, обозначают буквой S и измеряют в Дж/К. Энтропию, отнесенную к 1 кг массы тела, называют удельной энтропией и обозначают буквой s [Дж/(кг К)]. Следовательно, можно записать: dq /T = ds, а dq = Tds. Полное количество теплоты в термодинамическом процессе можно определить как
2 |
|
q = T ds . |
(1.25) |
1 |
|
Этот интеграл можно вычислить, если известна функциональная зависимость между температурой и энтропией. Пользуясь этой зависимостью, в координатах Т, s строят кривые, отображающие те или иные термодинамические процессы.
Энтропию нельзя измерить, ее смысл затруднительно продемонстрировать с помощью наглядных пособий, но можно понять по следующим интерпретациям:
1)Энтропия – мера ценности теплоты, ее работоспособности
итехнологической эффективности.
2)Энтропия – мера потери работы вследствие необратимости реальных процессов. Чем более необратим процесс в изолированной системе, тем больше возрастает энтропия и тем большая доля энергии не превращается в работу, а рассеивается в окружающую среду.
1.6.3.Тепловая Т, s - диаграмма
Поскольку каждому состоянию тела соответствуют определённые значения энтропии и температуры, то можно воспользоваться этими величинами для графического изображения состояния в виде точки, а процесса – в виде кривой в системе координат, где по оси абсцисс отложены значения энтропии, а по оси ординат – значения температуры, т. е. в Т, s - диаграмме.
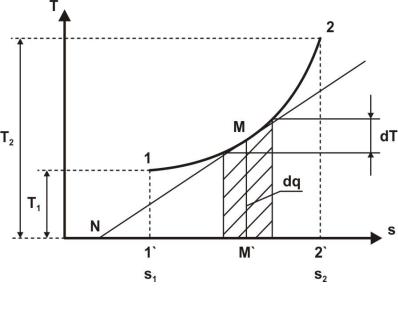
На рис.1.6 в Т, s - диаграмме кривой 1 – 2 представлен процесс изменения состояния термодинамического тела массой 1 кг. Заштрихованная площадка под бесконечно малым участком М этого процесса равняется произведению Т ds и представляет собой количество теплоты dq, получаемое телом на этом участке процесса. Так как абсолютная температура T всегда положительна (T > 0), то ds и dq в обратимых процессах имеют одинаковые знаки, т.е. сообщение телу теплоты связано с увеличением энтропии, отвод же теплоты – с её уменьшением. Площадь под кривой процесса 1 – 2 представляет собой количество теп-
21
S2
лоты q = TdS , сообщенное телу извне, поскольку процесс свя-
S1
зан с увеличением энтропии. Изображение процессов в T, s - диаграмме, названной тепловой, в некоторых случаях более наглядно и удобно, чем в р, - диаграмме.
Рис.1.6. Тепловая T, s - диаграмма
Так же, как и для р, - диаграммы, здесь справедливо замечание о допустимости графического изображения лишь равновесных процессов. Только для такого процесса подводимое количество теплоты в T, s - диаграмме численно равно площади, расположенной под кривой процесса, т. е., например, для процесса 1 – 2, приведенного на рис 1.6, количество подведенной теплоты равно площади 1’ – 1 – 2 – 2’.
Еще одним свойством Т, s - диаграммы является то, что в ней тангенс угла наклона касательной к любой точке процесса соответствует истинной теплоемкости рабочего тела в этой точке процесса. Например, тангенс угла наклона касательной NM (рис 1.6) численно равен истинной теплоемкости рабочего тела в точке M в процессе 1 – 2.
22

1.6.4. Круговые процессы или циклы
Все процессы в природе и технике протекают в направлении превращения энергии упорядоченного движения в энергию хаотического молекулярного движения и выравнивания потенциалов (давления, температуры, электрического потенциала и т.п.).
В технической термо- |
|
||||
динамике второй закон |
|
||||
применяется |
к тепло- |
|
|||
вым |
процессам |
для |
|
||
установления условий, |
|
||||
при которых возможно |
|
||||
превращение |
тепла в |
|
|||
механическую |
работу. |
|
|||
При |
этом имеется в |
|
|||
виду, что соблюдаются |
|
||||
количественные |
соот- |
|
|||
ношения |
между |
теп- |
|
||
лом и работой, выте- |
|
||||
кающие |
из |
первого |
Рис.1.7. Круговой процесс в р, - диаграм- |
||
закона |
термодинами- |
||||
ки. Чтобы непрерывно |
ме |
||||
производить работу в тепловом двигателе, необходимо совершение кругового процесса (рис.1.7). Рабочее тело многократно изменяет своё состояние по замкнутой кривой А-В-С-D-А и возвращается в начальное состояние А.
Таким образом, начальное и конечное состояния рабочего тела идентичны. На участке А-В-С рассматриваемого кругового процесса рабочее тело расширяется (прямой ход) и производит при этом положительную работу расширения А-В-С-С1-А1 (заштрихованная площадь). Эта работа совершается за счёт подвода теплоты q1 и изменения внутренней энергии uC – uA, проис-
ходящего согласно соотношению q1 = uC – uA + расш.
На другом участке рабочее тело возвращается в начальное состояние А (обратный ход). При этом оно сжимается в процес-
се С-D-А с затратой работы сжатия сж, выраженной площадью С-D-А-А1-С1. По аналогии с прямым ходом справедливо соотношение q2 = (uC – uA) + сж.
Разность работы расширения и работы сжатия представляет собой полезную работу двигателя за один цикл и выражается
23

площадью А-В-С-D-А:
= расш – сж. |
(1.26) |
Это уравнение справедливо для обратимых и необратимых процессов. Изменение внутренней энергии u = 0 вследствие возврата рабочего тела в исходное положение – в точку А.
Для получения полезной работы цикла необходимо, чтобы
работа расширения расш была больше работы сжатия сж. |
|
Из вышеприведенных уравнений получим |
|
= расш – сж = q1 – q2. |
(1.27) |
Следовательно, работа, произведённая в цикле, равна разности подведённой и отведённой теплоты в круговом процессе.
В приведённой схеме непрерывно действующего двигателя рабочее тело повторяет один и тот же круговой цикл. В действительных условиях рабочее тело обычно обновляют, периодически заменяя его равным количеством при том же состоянии. Однако это не вносит различий в цикл по сравнению с циклами с одним и тем же рабочим телом.
Из рассмотренного выше следует очень важный вывод, который составляет содержание второго закона термодинамики. При превращении теплоты в работу в непрерывно действующем двигателе лишь часть подведённой от горячего источника теплоты q1 превращается в работу; остальная часть q2 обязательно должна быть отдана в виде теплоты источнику с более низкой температурой.
Такой двигатель, в котором вся теплота, подведённая от горячего источника, целиком превращалась бы в работу, Кельвин назвал вечным двигателем второго рода. Второй закон термо-
динамики на основании опыта устанавливает, что вечный двигатель второго рода невозможен. Критерием для оценки теплового цикла служит КПД, представляющий собой отношение количества теплоты, превращённой в полезную работу, ко всей подведённой теплоте. Если цикл состоит только из обратимых процессов, то его называют идеальным циклом, а его КПД – термическим:
с = |
|
|
q1 q2 |
1 |
q2 |
. |
(1.28) |
q |
q |
|
|||||
|
|
|
q |
|
|||
1 |
1 |
1 |
|
|
|||
Из этого уравнения видно, что термический КПД цикла всегда всегда меньше единицы, т.к. величина q2 > 0.
24
1.6.5. Цикл Карно
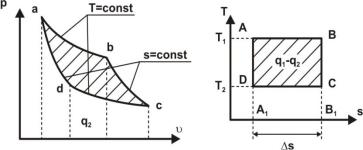
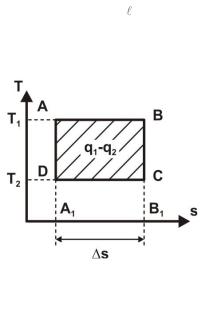
При громадном количестве топлива, расходуемого на получение механической энергии, очень важно повысить термический КПД двигателей. Но необходимо знать и тот предел, к которому нужно стремиться, т.к. попытки достичь невозможного бесполезны. Ответ на этот вопрос дал французский инженер Сади Карно (1796 – 1832 гг.). Он показал, как должен строиться цикл изменения состояния рабочего тела, чтобы для заданных условий работы двигателя термический КПД имел наибольшее значение. Этот цикл получил название цикла Карно (рис. 1.8, а, б).
Идеальный обратимый цикл Карно состоит из двух изотерм и двух адиабат. Подвод и отвод теплоты осуществляются при постоянной температуре от источников с бесконечной теплоёмкостью. В процессе изотермического расширения А-В рабочее тело получает теплоту q1, в процессе В-С происходит адиабатное расширение рабочего тела до температуры Т2. В процессе изотермического сжатия С-D рабочее тело отдает теплоту q2 теплоприемнику. Замыкается цикл адиабатой сжатия D-А с повышением температуры рабочего тела от Т2 до Т1.
Полезная работа цикла , численно равная площади прямо-
угольника, изображающего цикл в Т,s - диаграмме (рис. 1.8, б), определяется как разность подведенной q1 и отведенной q2 теплоты. Таким образом, при осуществлении цикла Карно не вся теплота q1 источника превращается в работу, а только часть её (q1 – q2), другая же часть q2 отдается охладителю и не может быть использована ни для получения работы, ни для нагревательных целей, то есть является тепловым отбросом кругового процесса.
а |
б |
Рис.1.8. Цикл Карно в Р, - диаграмме (а) и в Т,s - диаграмме (б)
25
Тогда термический КПД цикла Карно может быть определен по выражению
к |
|
|
q1 q2 |
1 |
q2 |
1 |
T2 S |
1 |
T2 |
. (1.29) |
|
|
|
T1 S |
|
||||||
t |
q1 |
|
q1 |
|
q1 |
|
|
T1 |
|
|
|
|
|
|
|
|
Теорема Карно: Термический коэффициент полезного действия цикла Карно зависит только от абсолютных температур источника тепла и «холодильника» и не зависит от свойств рабочего тела.
Чем больше разность температур, то есть чем больше температура горячего источника теплоты и меньше температура «холодильника», тем выше КПД цикла Карно. Термический КПД всех других циклов в данном интервале температур T1 и T2 не может быть больше КПД цикла Карно.
При равенстве температур T1 и T2 термический КПД цикла Карно равен нулю, что указывает на невозможность превращения теплоты в работу, если рабочее тело находится в тепловом равновесии с окружающей средой.
Рассмотренный выше обратимый цикл Карно, протекающий по часовой стрелке, является циклом двигателя, вырабатывающего механическую энергию. Цикл Карно с противоположным направлением протекания процессов называется обратным циклом Карно. Он характерен для холодильных машин и тепловых насосов.
Осуществим цикл Карно в обратной последовательности (рис.1.9), то есть А-D-С-В-А. Рабочее тело, называемое в этом случае холодильным агентом, отбирает теплоту q2 от охлаждаемого тела при изотермическом расширении D-С и отдает теплоту в окружающую среду в процессе В-А. Затрачиваемая работа
в цикле (площадь А-D-С-В-А) превращается в теплоту и также отдается в окружающую среду. Такой обратный цикл Карно яв-
26

ляется идеальным циклом холодильной установки, а его совершенство оценивается холодильным коэффициентом
|
q2 |
|
|
q2 |
|
|
T2 |
. |
(1.30) |
|
|
q |
|
|
|||||
|
|
|
q |
T |
T |
|
|||
|
|
1 |
2 |
1 |
2 |
|
|
||
Холодильный коэффициент представляет собой отношение отведённого от тела низкой температуры количества
теплоты q2 ко всей затраченной работе .
Чем меньше температура холодного источника T2 и больше температура горячего источника T1, тем меньше холодильный коэффициент. Чтобы отнять у холодного источника некоторое
количество тепла q2, требуется тем большая затрата работы ,
чем больше разность температур T1 – T2. При заданных температурах T1 и T2 обратный цикл Карно является самым экономичным циклом холодильной установки.
Следует помнить, что холодильный коэффициент в отличие от КПД может иметь значения как меньше, так и больше единицы и может быть равен единице.
1.7.Водяной пар
1.7.1.Основные термодинамические свойства
водяного пара
Водяной пар как рабочее тело получил широкое применение в теплотехнике. Пар представляет собой промежуточное состояние между жидкостью и газом. При высоких температурах и низких давлениях пар по своим свойствам приближается к идеальному газу. В паровых двигателях и теплообменных аппаратах пар используется при таких давлениях и температурах, что применение к нему законов и уравнений состояния идеального газа приводит к большим неточностям при вычислениях. Наиболее точные уравнения состояния водяного пара имеют довольно сложный вид и требуют громоздких вычислений. Поэтому при расчётах
Рис.1.10. Кипение воды и образование пара
27
обычно применяются таблицы и диаграммы, построенные по
|
опытным данным. |
|
|
|
||||
|
Водяной |
пар |
может |
быть |
||||
|
влажным, сухим насыщенным и |
|||||||
|
перегретым. Чтобы понять раз- |
|||||||
|
ницу между этими состояниями, |
|||||||
|
рассмотрим процесс превраще- |
|||||||
|
ния воды в пар. |
Если |
воду |
|||||
|
нагревать в открытом сосуде |
|||||||
|
(рис. 1.10), то при определен- |
|||||||
|
ной температуре начинается её |
|||||||
|
кипение и образование над её |
|||||||
|
поверхностью пара. |
|
|
|||||
|
Температуры кипящей воды |
|||||||
|
и образующегося |
при |
кипении |
|||||
|
пара одинаковы и неизменны в |
|||||||
|
процессе всего выкипания жид- |
|||||||
|
кости. |
|
|
|
|
|
|
|
|
Если описанный выше опыт |
|||||||
Рис.1.11. Образование сухого |
поставить |
при |
атмосферном |
|||||
насыщенного пара |
давлении (760 мм |
рт. ст.), то |
||||||
|
||||||||
|
кипение |
воды |
и |
образование |
||||
|
пара |
будут |
происходить |
при |
||||
|
100 °С. Эту температуру назы- |
|||||||
|
вают |
температурой |
кипения, |
|||||
|
или |
температурой |
насыще- |
|||||
|
ния, и обозначают tн. Послед- |
|||||||
|
нее название связано с тем, что |
|||||||
|
при спокойном кипении над по- |
|||||||
|
верхностью |
воды |
образуется |
|||||
|
сухой насыщенный пар – пар, в |
|||||||
|
котором |
отсутствуют |
капельки |
|||||
|
воды (рис. 1.11). Если темпера- |
|||||||
|
туру сухого насыщенного пара |
|||||||
|
снизить (а это можно сделать |
|||||||
|
только |
путем |
одновременного |
|||||
|
снижения давления), то часть |
|||||||
|
пара сконденсируется и в нем |
|||||||
Рис.1.12. Образование влажно- |
появятся |
капельки |
воды, «па- |
|||||
го пара |
рящие» |
в объеме пара |
(рис. |
|||||
1.12). Такой пар называется влажным. |
Если, наоборот, сухой |
|||||||
28
насыщенный пар нагреть, то его температура будет повышаться и он окажется перегретым по отношению к температуре насыщения.
Если снизить давление в сосуде, то кипение и испарение будут происходить при меньшей температуре. Наоборот, если повысить давление в сосуде, то вода закипит и начнет испаряться при более высокой температуре. Это свойство широко используется в теплоэнергетическом оборудовании. Например, в деаэраторе питательной воды турбоустановки поддерживается давление 6 кгс/см2, и вода в нем закипает при нагреве до 159 °С.
Важно усвоить, что температура насыщения воды однозначно определяется давлением над ее поверхностью.
После нагревания воды в сосуде до температуры насыщения происходит процесс парообразования (кипения) во всем объёме жидкости, при котором вся теплота, подводимая к воде, расходуется на генерацию пара и температура кипящей воды остается неизменной. Тепловая энергия, расходуемая на поддержание кипения в сосуде, затрачивается на разрыв связей между молекулами воды, т.е. на ее испарение. Молекулы испарившейся жидкости обладают большей, чем молекулы воды,
энергией на величину удельной (скрытой) теплоты парообра-
зования r, представляющей собой количество тепловой энергии, необходимой для испарения 1 кг кипящей жидкости.
Образовавшийся в сосуде водяной пар может при определенных условиях вновь превратиться в жидкость. Представим себе, что в сосуд, показанный на рис. 1.13, а, некоторое время подается пар под давлением через вентиль 2 при открытом в атмосферу вентиле 1. После заполнения сосуда паром вентили 1 и 2 последовательно закрываются, и сосуд оказывается под некоторым давлением пара. Если теперь этот сосуд начать охлаждать, поместив его в холодную воду, то пар будет конденсироваться, отдавая тепловую энергию через стенки сосуда окружающей его холодной воде. При этом давление пара над зеркалом воды в сосуде будет уменьшаться и всегда совпадать с давлением насыщения, соответствующем температуре образующейся жидкости.
Пар превращается в воду потому, что от него отбирается теплота конденсации, равная теплоте парообразования r. В результате конденсации пара на дне сосуда образуется конденсат, а над зеркалом конденсата – насыщенный водяной пар. Чем сильнее будет охлажден пар в сосуде, тем больше образуется
29
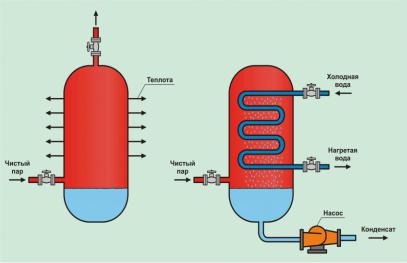
конденсата на его дне и тем более низкое давление будет получено в сосуде. В процессе конденсации пара в сосуде может быть получено давление существенно ниже атмосферного, т.е. вакуум.
1
2
а |
б |
Рис.1.13. Процесс конденсации водяного пара в теплообменниках
На рис. 1.13, б показана принципиальная схема установки для непрерывной конденсации постоянно поступающего пара. Если в сосуде установить змеевик, по которому пропускать относительно холодную воду, то пар, поступающий в сосуд, будет встречать на своем пути холодную поверхность змеевика и конденсироваться на ней.
Для удаления образующегося конденсата применяется насос, благодаря чему происходит непрерывная конденсация поступающего пара, а внутри сосуда поддерживается давление, соответствующее температуре образующегося конденсата. На описанном принципе основана работа конденсаторов, сетевых и регенеративных подогревателей и многих других теплообменных аппаратов, применяемых в энергетике.
Таким образом, процесс превращения пара в жидкость, осуществляющийся при отнятии от него тепла и являющийся процессом, обратным парообразованию, называется конденсацией. Этот процесс, так же как и парообразование, происходит при постоянной температуре, если давление постоянно.
30
