
- •Г.А. Тихановская, л.М. Воропай, в.В. Кочетова химия
- •Предисловие
- •Введение
- •Основные понятия и законы в химии
- •1.1. Основные химические понятия
- •1.2 Закон эквивалентов. Понятие эквивалент. Молярная масса эквивалента
- •1.3. Законы газового состояния. Определение молярных масс газообразных веществ
- •2. Строение атома и периодический закон д.И.Менделеева
- •2.1. Этапы на пути создания квантовой механики
- •2.2. Элементы квантово-механической теории атома
- •Характеристика квантовых чисел
- •3. Типы химической связи
- •3.1. Ковалентная связь. Метод валентных связей
- •Возможная геометрическая конфигурация молекул при Sp3 – гибридизации
- •3.2. Ионная связь
- •3.3. Металлическая связь
- •3.4. Водородная связь
- •3.5. Молекулярное взаимодействие
- •4. Общие закономерности протекания и типы химических реакций
- •4.1. Энергетика химических превращений
- •4.1.1. Термохимия. Закон Гесса
- •4.1.2. Энтропия
- •4.1.3. Энергия Гиббса и направленность химических процессов
- •4.2. Химическая кинетика
- •Стандартные теплоты (энтальпии) образования некоторых веществ
- •Стандартная энергия Гиббса образования некоторых веществ
- •Стандартные абсолютные энтропии некоторых веществ
- •4.2.1. Скорость химической реакции
- •4.2.2. Физические методы стимулирования химических превращений
- •4.2.3. Катализ
- •4.3. Химическое равновесие
- •4.3.1. Константа химического равновесия
- •4.3.2. Принцип Ле Шателье
- •5. Дисперсные системы
- •5.1. Способы выражения концентрации растворов
- •5.2. Свойства разбавленных растворов
- •5.3 Растворы электролитов
- •Степень диссоциации различных электролитов
- •5.4. Ионное произведение воды. Водородный показатель
- •5.5 Равновесие в гетерогенных системах, произведение растворимости
- •6. Гидролиз солей
- •Примеры сильных и слабых кислот и оснований
- •6.1. Произведение растворимости. Примеры решения задач
- •7. Жесткость воды
- •8. Окислительно-восстановительные процессы
- •8.1. Электродные потенциалы и электродвижущие силы
- •Стандартные электронные потенциалы(∆е0) некоторых металлов
- •8.2. Электролиз
- •8.3. Коррозия металлов
- •9. Кристаллическое состояние
- •9.1.Основные понятия
- •9.2 Симметрия кристаллов. Система кристаллов
- •9.3. Кристаллические решетки
- •10. Сплавы
- •10.1. Диаграммы состояния металлических систем
- •Библиографический список
- •Произведение растворимости малорастворимых веществ в воде при 25оС
- •Стандартные, окислительно – восстановительные потенциалы ( по отношению к потенциалу стандартного водородного электрода при t 25oC).
- •Термодинамические константы некоторых веществ
- •Оглавление
4.1.2. Энтропия
Большинство процессов представляет собой два одновременно происходящих явления: передачу энергии и изменение в упорядоченности расположения частиц друг относительно друга.
Частицам (молекулам, атомам, ионам) присуще стремление к беспорядочному движению, поэтому система стремится перейти из более упорядоченного состояния в менее упорядоченное. Количественной мерой беспорядка является энтропия S. Изменение энтропии ΔS в изолированной системе, переходящей из состояния 1 в состояние 2, можно определить соотношением
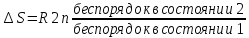
где R- газовая постоянная.
Если, например, баллон с газом соединить с вакуумированным сосудом, то газ из баллона будет распределяться по всему объёму сосуда. При этом система из более упорядоченного состояния (с меньшим беспорядком) переходит в состояние менее упорядоченное (с большим беспорядком). Таким образом, при переходе системы из более упорядоченного состояния в менее упорядоченное состояние энтропия возрастает.
Переход же системы из менее упорядоченного состояния в более упорядоченное состояние связан с уменьшением энтропии, и самопроизвольное протекание подобного процесса менее вероятно. Так, ясно, что в рассматриваемом примере система самопроизвольно не может перейти из состояния 2 в состояние 1, т.е. невероятно, чтобы газ сам собой собрался в баллоне. В случае перехода системы из менее упорядоченного состояния в более упорядоченное ΔS системы - величина отрицательная, т.е. энтропия S системы уменьшается.
Энтропия возрастает при переходе жидкости в пар, при растворении кристаллического вещества и т.д. В процессах конденсации и кристаллизации вещества энтропия уменьшается. Энтропия вещества в газовом состоянии значительно больше, чем в жидком, а тем более, чем в твердом.
Энтропии веществ, как и их теплоты образования, принято относить к определенным условиям, обычно при температуре 25 0С (298 К) и давлении 1 атм. Энтропию при этих условиях обозначают S0298 и называют стандартной энтропией.
Значениями энтропии веществ пользуются для установления изменения энтропии системы в результате соответствующих процессов. Так, для химической реакции
аА+bB+…= dD+еЕ+…изменение энтропии системы будет
ΔS= (dSD + eSE+…)-( aSA + bSB+...) или ΔS= ∑Sпрод. - ∑Sисх.
Об изменении энтропии в химических реакциях можно судить по изменению объёма системы в ходе реакции. Например, в реакции ½ С (графит)+½ СО2(г)=СО(г) наблюдается увеличение объёма ΔV>0; следовательно, энтропия возрастает ΔS> 0 (ΔS0298=87,7 дж/моль∙град). В случае же реакции образования Н3N из водорода и азота 3/2 Н2 (г)+1/2 N2 (г)= H3N(г) наоборот, объём системы уменьшается ΔV<0; следовательно, энтропия уменьшается ΔS<0 (ΔS0298=99,1дж/моль∙град).
Если же реакция протекает между твердыми веществами, например,
Аl(к)+Sb(к)=АlSb(к), то изменения объёма системы и её энтропии практически не происходит (ΔS0298=4,03дж/моль∙град). То же самое относится и к процессам, в которых число молей газообразных веществ не изменяется, например, С (графит)+ О2 (г)= СО2 (г), ΔS=2,9дж/моль∙град.
