
- •Основы молекулярной физики и термодинамика
- ••Молекулярная физика – раздел физики, в котором изучаются физические и физико- химические свойства
- •Броуновское движение
- ••Разделами молекулярной физики являются:
- ••Термодинамика – это наука о тепловых явлениях.
- ••Общим для всех разделов молекулярной физики является теоретический подход, основанный на применении феноменологического
- ••Атомы и молекулы, взаимодействуют друг с другом, образуют разнообразные вещества (системы).
- ••Для описания состояния макросистемы вводят параметры, которые называются параметрами состояния.
- ••Объем газа V — это объем сосуда, в котором газ находится. В СИ
- ••Температура — скалярная физическая величина вводится для количественной характеристики внутренней энергии тела. Опыт
- •Идеальный газ
- •Идеальный газ
- •Идеальный газ
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Состояние системы
- •Изопроцессы
- •Изопроцессы
- •Закон Шарля
- •Изопроцессы
- •Изобарный процесс
- •Закон Гей-Люссака
- •Закон Авогадро
- •Закон Дальтона
- •Уравнение Клапейрона - Менделеева
- •Уравнение Клапейрона - Менделеева
- •Уравнение Клапейрона - Менделеева
- •Давление идеального газа
- •Основное уравнение молекулярно- кинетической теории идеальных газов
- •• Если газ в объеме V содержит N молекул, движущихся со скоростями ,
- ••Средняя кинетическая энергия поступательного движения одной молекулы идеального газа из уравнений (2) и
- •Закон Максвелла для распределения молекул идеального газа по скоростям
- ••Закон Максвелла описывается некоторой функцией f(v), называемой функцией распределения молекул по скоростям.
- ••Применяя методы теории вероятностей, Максвелл нашел функцию f(v) – закон распределения молекул идеального
- ••В показателе степени стоит отношение
- •Распределение Максвелла имеет вид
- ••Из графика видно, что при «малых» υ, т.е. при
- •• Величину скорости, на которую приходится
- ••Для одного моля газа:
- ••Все три скорости незначительно отличаются друг от друга множителем порядка единицы, причем
- •На рисунке показана зависимость f(υ) при различных температурах и массах молекул газа
- ••Закон Максвелла для распределения молекул идеального газа по скоростям и все вытекающие следствия
- •Распределение Больцмана
- •Распределение Больцмана
- ••Если высота сосуда много меньше чем kT/mg, то зависимостью концентрации от высоты можно
- •Распределение Больцмана
- •Опытное обоснование молекулярно- кинетической теории
- •Броуновское движение
- •Броуновское движение
- •Броуновское движение
- •Броуновское движение
- •Первое экспериментальное определение скорости молекул. Опыты Штерна.
- •Опыт Штерна
- •Опыт Штерна
- •Опыт Штерна
- •Опыт Штерна
- ••Легко связать это смещение S со скоростью молекул v. Молекулы достигают стенки за
- ••По формуле рассчитывали скорость.
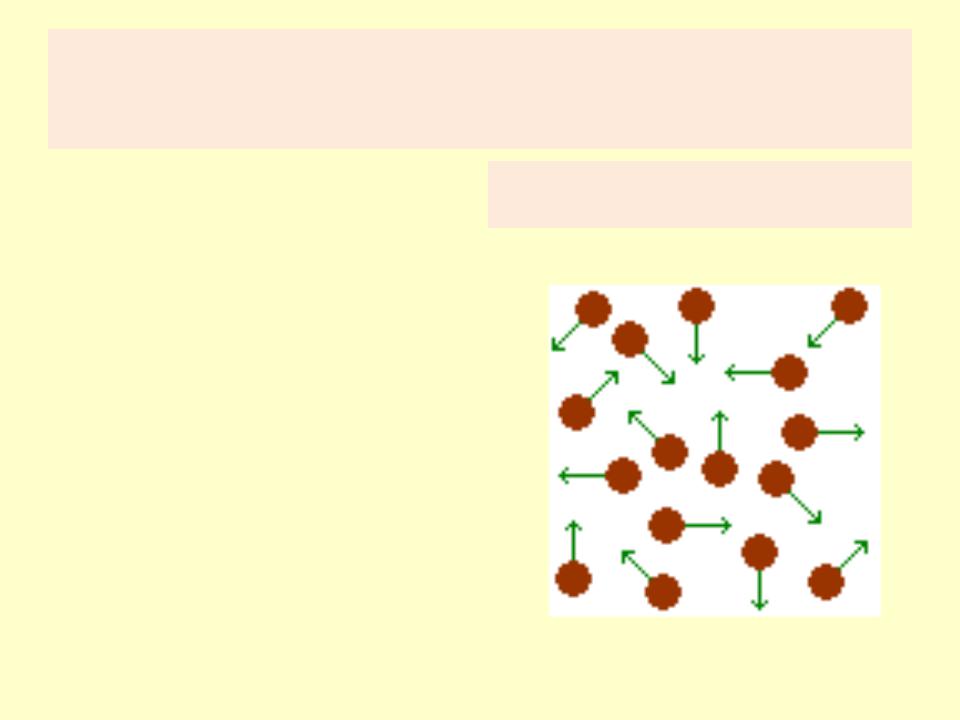
Идеальный газ
•Простейшей моделью молекулярно-кинетической теории является модель идеального газа.
•В кинетической модели идеального газа молекулы рассматриваются как идеально упругие шарики, взаимодействующие между собой и со стенками только во время упругих столкновений.
Механическая модель идеального газа

Идеальный газ
•Суммарный объем всех молекул предполагается малым по сравнению с объемом сосуда, в котором находится газ.
•Модель идеального газа достаточно хорошо описывает поведение реальных газов в широком диапазоне давлений и температур.

Идеальный газ
•Задача молекулярно-кинетической теории состоит в том, чтобы установить связь между микроскопическими (масса, скорость, кинетическая энергия молекул) и макроскопическими параметрами (давление, газ, температура).
Врезультате каждого столкновения между молекулами и молекул со стенкой скорости молекул могут изменяться по модулю и по направлению; на интервалах между последовательными столкновениями молекулы движутся равномерно и прямолинейно.
Вмодели идеального газа предполагается, что все столкновения происходят по
законам упругого удара, т. е.
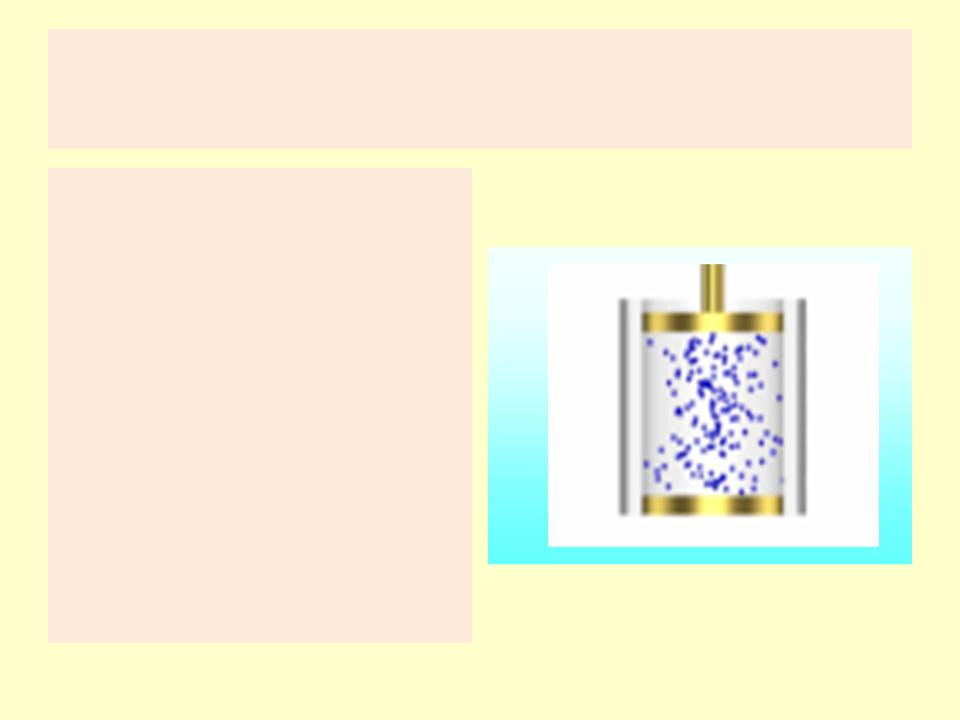
Состояние системы
•Система состоит из совокупности тел.
•Тела, не входящие в систему, называют окружающей средой.
•Дан газ (система) в закрытом цилиндре под поршнем (окружающая среда).
•Изменение положения поршня или температуры изменяют состояние системы.

Состояние системы
•Величины, характеризующие состояние системы, называются ее параметрами.
•Состояние таких простейших систем, как газ, характеризуется следующими макроскопическими параметрами:
•объемом V,
давлением р, температурой Т.

Состояние системы
•Нужны также параметры, определяющие систему –
•m - массам системы
•М – относительная молекулярная масса
•µ - молярная масса, масса одного моля
•Моль – количество данного вещества, масса которого, выраженная в граммах, численно равна относительной молекулярной массе. Размерность в СИ кг/моль
•µ = М кг/моль.

Состояние системы
•Если внешние условия неизменны, то система с течением времени приходит в равновесное состояние: выравниваются давления и температуры ее отдельных систем.
•В равновесном состоянии системы между параметрами имеется связь: заданные два параметра системы (например, ее температура и объем) однозначно определяют третий (давление).
•F(V, p, T)= 0 – уравнение состояния.
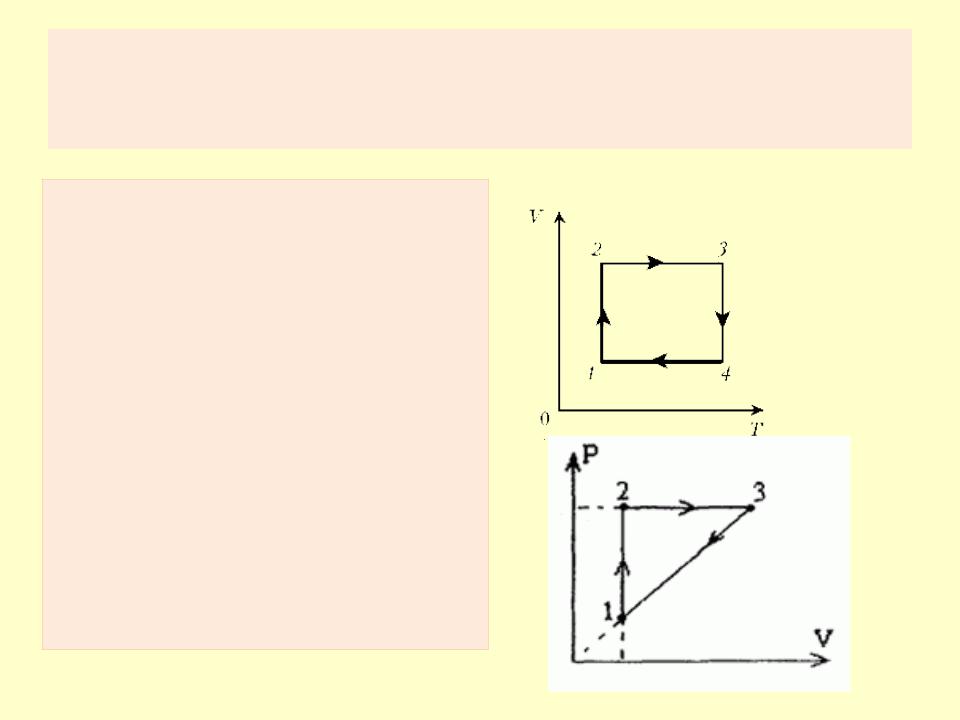
Состояние системы
Равновесное состояние может быть изображено точкой на плоскости.
Под процессом понимается всякий переход системы из одного состояния в другое. При бесконечно медленном протекании процесса можно считать, что в каждый данный момент времени состояние системы равновесно.
Такой процесс называют равновесным процессом и его можно представить себе как последовательность равновесных состояний.
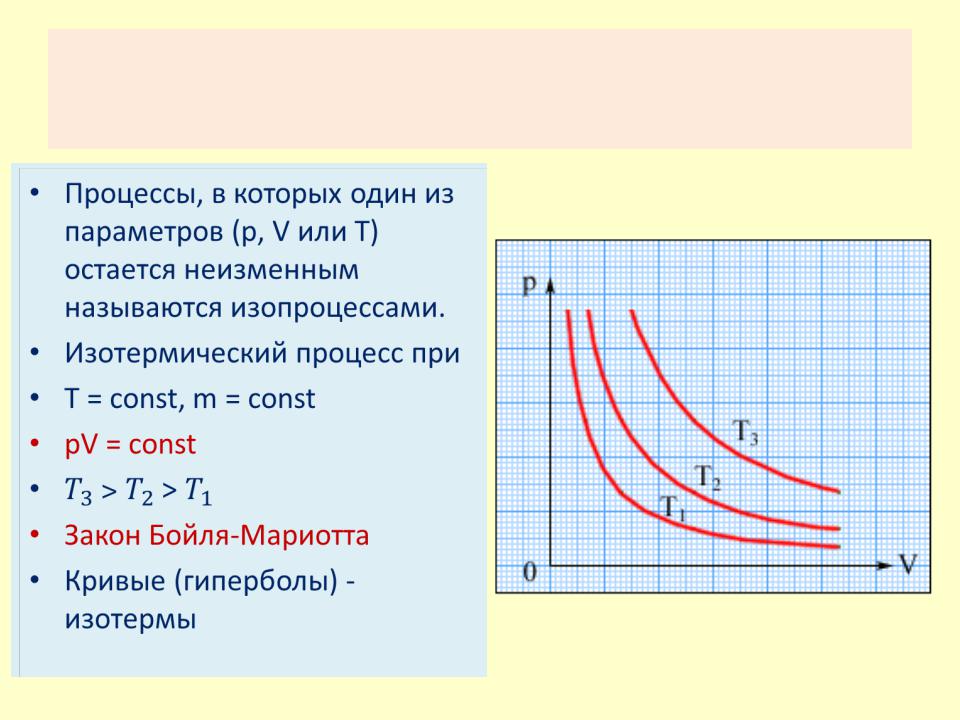
Изопроцессы
•Процессы, в которых один из параметров (p, V или T) остается неизменным называются изопроцессами.
•Изотермический процесс при
•Т = const, m = const
•pV = const
•˃
•Закон Бойля-Мариотта
•Кривые (гиперболы) -
изотермы
Изопроцессы
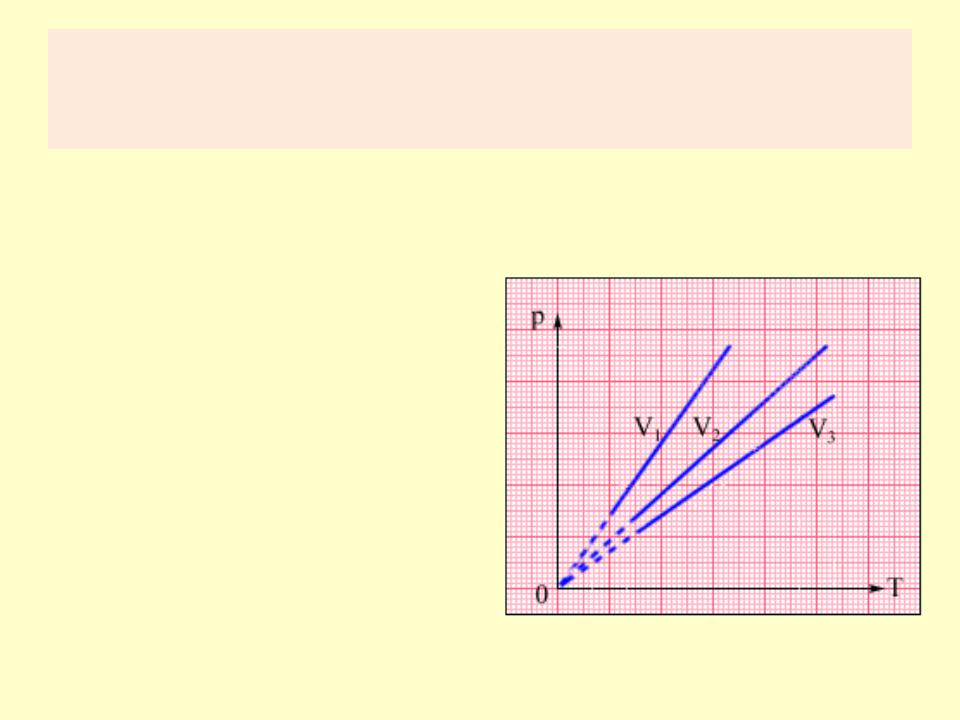
Изохорный процесс (V = const)
•Изохорный процесс – это процесс квазистатического нагревания или охлаждения газа при постоянном объеме V и при условии, что количество вещества ν в сосуде остается неизменным.
•P/T = const
Семейство изохор на плоскости (p, T). V3 > V2 > V1.
